siRNA沉默HIF-1α对大鼠心肌细胞CT-1表达的影响
2013-08-28符史干董战玲许闽广陈国斌高凌峰
王 晗,符史干,董战玲,许闽广,王 杨,陈国斌,高凌峰
(海南医学院生理学教研室,海南海口571199)
低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是介导细胞低氧反应的核转录因子,由α和β两个亚单位组成,HIF-1α的稳定性受环境中氧的水平的调节,而β亚单位则不受氧的影响[1]。正常氧分压条件下,HIF-1α通过泛素-蛋白酶小体途径被降解,当氧分压降低时,HIF-1α降解途径被阻断,在胞质中聚集,转移至核内与β亚单位聚合后发挥转录因子的作用。
心脏营养素-1(Cardiotrophin-1,CT-1)是IL-6家族成员之一,CT-1可以抑制心肌细胞凋亡,缺血性心脏病中CT-1表达增加,体现代偿性保护作用[2]。在心肌细胞低氧情况下,CT-1表达是否受到低氧激活的HIF-1调控尚不清楚。因此,本研究合成了干扰HIF-1α的siRNA片段,通过转染大鼠心肌细胞系H9C2,探讨了HIF-1α基因沉默对低氧心肌细胞中CT-1基因的调控作用。
1 材料与方法
1.1 材料
大鼠心肌细胞系H9C2(上海越研生物科技有限公司),氯化钴(CoCl2)(海南青鸟生物科技有限公司),Cell Counting Kit-8(CCK-8试剂盒)(广州研创生物技术发展有限公司)。Trizol试剂、脂质体lipofactamine 2000(invitrogen公司),siRNA片段(广州锐博生物公司合成),PCR相关试剂(博大泰克公司),HIF-1α抗体、CT-1抗体和 actin抗体(Santa Cruz公司)。
1.2 方法
1.2.1 细胞培养与低氧孵育:H9C2细胞系在含10%胎牛血清的DMEM培养基中培养,放置于37℃,5%CO2孵箱中。低氧环境通过在培养基中加入CoCl2实现。
1.2.2 细胞存活检测:H9C2细胞存活率通过Cell Counting Kit-8(CCK-8试剂盒)检测。种植于96孔板的细胞,按照每孔100 μL培养基加入10 μL CCK-8溶液的比例进行孵育,2 h后,检测A450。
1.2.3 RNA干扰:转染前24 h,将细胞以5×104个/孔接种于6孔细胞培养板。按照lipofectamine2000的说明书将siRNA片段转染于细胞中,48 h后进行后续实验。采用siRNA片段如下:si-HIF-1α(正义链):5'-GATCCCGCACAGTTACAGTATTCCATCAAGAGTG GAATACTGTAACTGTGCTTTT TT-3';si-HIF-1α(反义链):5'-C TAGAAAAAAGCACAGTTACAGTATTCC ACTCTTGATGGAATACTGTAACTGTGCGG-3'。对照的siRNA片段:si-control(正义链):5'-GATCCCGTC GCGACTATAGAGTAAGTCAAGAGCTTACTCTATAGT CGCGACTTTTTT-3';si-control(反义链):5'-CTAGA AAAAAGTCGCGACTATAGAGTAAGCTCTTGACTTAC TCTATAGTCGCGACGG-3'。
1.2.4 Real-time PCR检测干扰效果:Trizol法提取各组细胞总RNA。Real-time PCR扩增过程及荧光信号检查、数据的储存和分析均由仪器(ABI Prism 7300 sequence detection system(PE Applied Biosystems公司)及自带的SDS软件自动完成。PCR反应条件:95℃ 预变性10 min,95℃ 10 s、64℃ 5 s、72℃ 20 s,共34个循环。溶解曲线与琼脂糖电泳相结合确定扩增的目的片段的大小。actin作为内对照来评估HIF-1α mRNA和CT-1 mRNA的表达。
1.2.5 Western blot检测HIF-1α蛋白和CT-1蛋白水平的表达:收集细胞后加入裂解液各200 μL,经8%SDS-聚丙烯酰胺凝胶电泳分离,转移到硝酸纤维素膜,蛋白封闭液封闭膜4℃过夜;一抗为小鼠抗大鼠HIF-1α单克隆抗体(1∶500稀释),室温摇床孵育2 h,二抗为辣根过氧化物酶标记的羊抗鼠多克隆抗体(1∶1 000稀释),室温孵育1 h,化学荧光显色。actin作为内对照,一抗为小鼠抗大鼠肌动蛋白单克隆抗体(1∶500稀释),余条件同 HIF-1α。CT-1蛋白水平检测方法同HIF-1α。
1.3 统计学分析
采用SPSS11.5软件进行统计分析,配对组间比较采用t检验,计量资料以均值±标准差±s)表示。
2 结果
2.1 CoCl2模拟低氧合并siRNA-HIF-1α转染时CT-1在心肌细胞系H9C2中表达情况
2.1.1 Real-time PCR检测siRNA-HIF-1α的干扰效果及对CT-1 mRNA水平的影响:在100 μmol/L CoCl2处理48 h模拟低氧条件下,干扰组(转染干扰HIF-1α siRNA的H9C2)中HIF-1α mRNA比对照组(转染无义干扰片段的H9C2)明显减少(P<0.05)(图1)。低氧情况下转染无义干扰片段的H9C2细胞中CT-1基因mRNA表达较常氧情况下未转染的细胞明显增高(P<0.05),而低氧情况下干扰组(转染干扰HIF-1α siRNA的H9C2)中的CT-1 mRNA比对照组(转染无义干扰片段的 H9C2)明显减少(P<0.05)(图2)。
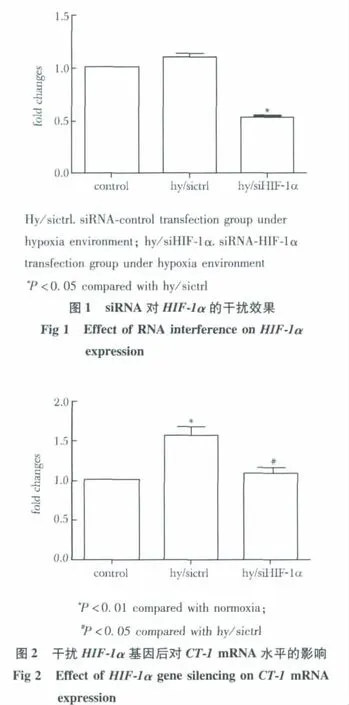
2.1.2 Western blot检测siRNA对HIF-1α蛋白和CT-1蛋白的影响:在低氧情况下干扰组细胞中HIF-1α蛋白的表达为 0.46±0.05,较对照组的0.74±0.03明显减少 (P<0.05),干扰组细胞中CT-1蛋白的表达为0.68±0.12,也较对照组的1.08±0.08明显减少 (P<0.05)(图3)。
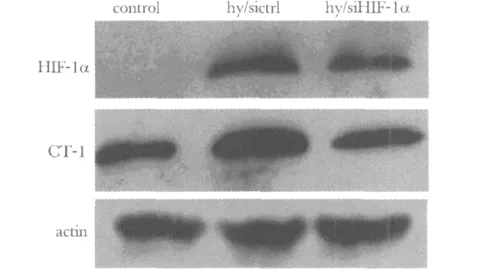
图3 干扰HIF-1α的siRNA对HIF-1α蛋白和CT-1蛋白的影响Fig 3 Effect of RNA interference on HIF-1α and CT-1 protein expression
2.2 CoCl2模拟低氧合并siRNA-HIF-1α转染时H9C2细胞的增殖情况
随着时间的延长,细胞存活率逐渐增加,使用CoCl2后细胞存活率均较常氧条件下下降,且使用CoCl296 h模拟低氧条件下,干扰组比对照组细胞存活率下降(P<0.05)(图4)。
图4 CCK-8试剂盒检测干扰HIF-1α基因后H9C2细胞的增殖情况Fig 4 Effect of HIF-1α gene silencing on viability of H9C2 cells by Cell Counting Kit-8
2.3 CoCl2模拟低氧时CT-1在心肌细胞系H9C2中的表达情况
2.3.1 低氧后HIF-1α mRNA和CT-1 mRNA的表达水平的变化:H9C2在未经CoCl2处理,即常氧情况下HIF-1α mRNA就存在较高的表达,在CoCl2模拟的低氧条件下,HIF-1α mRNA较常氧时无显著差异,CT-1 mRNA较常氧时显著增加(P<0.05)(表1)。
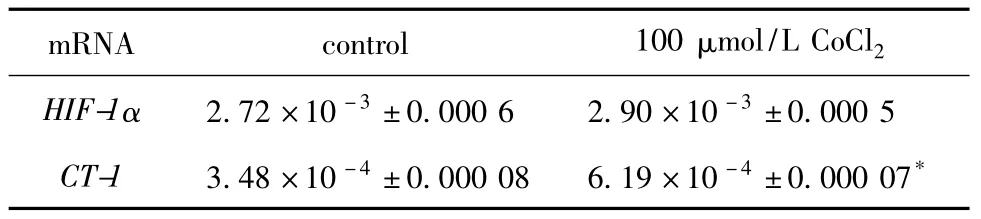
表1 CoCl2处理细胞后HIF-1α和CT-1 mRNA相对表达量Table 1 Relative expression of HIF-1α and CT-1 mRNA by treating cells with CoCl2
2.3.2 使用CoCl2后HIF-1α蛋白和CT-1蛋白表达水平的变化:常氧情况下HIF-1α蛋白水平为2.39×10-3±2×10-4,低氧后蛋白水平为 0.34 ±0.06,较常氧时明显增高(P<0.05)。常氧情况下CT-1蛋白有一定的表达,为0.34±0.05,低氧后CT-1蛋白水平为0.55±0.05,较常氧时明显增高(P<0.05)(图5)。
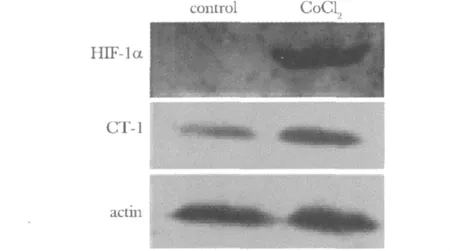
图5 CoCl2处理细胞后HIF-1α和CT-1蛋白表达的改变Fig 5 Expression of HIF-1α and CT-1 protein by treating cells with CoCl2
3 讨论
HIF-1是低氧条件下激活的最主要的转录因子,能与促红细胞生成素基因上的低氧反应元件(hypoxia response elements,HRE)结合从而促进其转录[3],在细胞增殖、细胞凋亡、血管舒缩、肿瘤耐药等方面发挥重要作用[4]。HIF-1还参与缺血时的心肌代谢和血管新生过程[5]。虽然调节HIF-1活性的机制很多,但氧诱导的羟化酶的作用是调节HIF-1的最主要的方向。HIF-1的两个亚单位中HIF-1α的氧依赖区 (ODD)与靶基因启动子DNA的结合增强了其转录活性,因此该研究选择HIF-1α基因作为研究对象,探讨低氧情况下心肌进行代偿的可能机制。
该研究中设计了1对HIF-1α-siRNA寡核苷酸片段,通过化学合成并转染心肌细胞系H9C2,实时定量PCR和 Western blot鉴定结果显示,HIF-1αsiRNA对HIF-1α的抑制效果显著,表达量较对照组有显著性差异。
CT-1是从小鼠的囊胚内层细胞团中获取全能胚胎干细胞,然后建立胚胎小体cDNA文库,逐级筛选、分离,最后克隆出的一个新的蛋白质[6-7]。CT-1在生理病理过程中起重要作用,例如代偿肿瘤坏死因子 α(tumor necrosis factor,TNF-α)所致的损伤、参与肝细胞代谢的调节和免疫反应、促进神经元的存活等[8]。近年来,CT-1作为心肌肥大、心衰和心肌重构的主要细胞因子之一被广泛研究。在鼠心肌梗死模型中,CT-1在保护心肌受损过程中发挥重要的作用[9]。CT-1在小鼠胚胎细胞中受 HIF-1的调控[10]。在缺血低氧性心脏病中,HIF-1主要通过上调VEGF、iNOS 的表达发挥代偿作用[11],HIF-1 是否也能通过上调CT-1的表达使心肌存活率增加值得探讨。
低氧环境下,HIF-1α mRNA无明显变化,蛋白水平增加,符合低氧诱导 HIF-1α表达的机制,HIF-1α蛋白增加伴随着CT-1 mRNA和蛋白水平的升高。该研究检测了siRNA干扰HIF-1α基因后,心肌细胞系H9C2细胞中HIF-1α基因的表达变化,结果表明,当HIF-1α被抑制后,CT-1的上调机制被阻断,细胞CT-1的表达无论从mRNA水平或蛋白质水平都明显减低,反之,说明低氧条件下CT-1基因的上调作用有可能是通过低氧激活HIF-1α而诱导产生的。
该研究通过干扰H9C2细胞HIF-1α的表达及研究HIF-1α对CT-1基因的调控作用,为低氧情况下心肌的代偿机制提供新的见解和实验资料,对治疗缺血性心脏病提供新的思路。
[1]González IR,Moreno-Manzano V,Rodríguez-Jimenez FJ,et al.The biology of HIFα proteins in cell differentiation and disease[J].Vitam Horm,2011,87:367 -379.
[2]Freed DH,Moon MC,Borowiec AM,et al.Cardiotrophin-1:expression in experimental myocardial infarction and potential role in post-MI wound healing[J].Mol Cell Biochem,2003,254:247-256.
[3]Carmeliet P,Dor Y,Herbert JM,et al.Role of HIF-1alpha in hypoxia-mediated apoptosis,cell proliferation and tumour angiogenesis[J].Nature,1998,394:485 -490.
[4]吴维光,陈亚琼,曹秀琴.RNA干扰沉默HIF-1α基因对宫颈癌HeLa细胞定植和侵袭的影响[J].基础医学与临床,2010,30:284-288.
[5] Tekin D,Dursun AD,Xi L.Hypoxia inducible factor 1(HIF-1)and cardioprotection[J].Acta Pharmacol Sin,2010,31:1085-1094.
[6] Jougasaki M.Cardiotrophin-1 in cardiovascular regulation[J].Adv Clin Chem,2010,52:41-76.
[7]符史干,董战玲,周升等.MARK信号通路介导CT-1促进心肌细胞存活[J].基础医学与临床,2009,27:31-35.
[8]Yang ZF,Lau CK,Nqai P,et al.Cardiotrophin-1 enhances regeneration of cirrhotic liver remnant after hepatectomy through promotion of angiogenesis and cell proliferation[J].Liver Int,2008,28:622 -631.
[9]Ruixing Y,Jinzhen W,Dezhai Y,et al.Cardioprotective role of cardiotrophin-1 gene transfer in a murine model of myocardial infarction[J].Growth Factors,2007,25:286-294.
[10]Ateghang B,Wartenberg M,Gassmann M,et al.Regulation of cardiotrophin-1 expression in mouse embryonic stem cells by HIF-1alpha and intracellular reactive oxygen species[J].J Cell Sci,2006,119:1043 - 1052.
[11]Tekin D,Dursun AD,Xi L.Hypoxia-inducible factor-1(HIF-1)and cardioprotection[J].Acta Pharmacol Sin,2010,31:1085-1094.
