人睾丸组织TRIM69蛋白具有催化多聚泛素链形成的活性
2013-08-28韩永卿高晋兰缪时英王琳芳
韩永卿,李 容,高晋兰,缪时英,王琳芳
(中国医学科学院北京协和医学院基础医学研究所医学分子生物学国家重点实验室,北京100005)
精子发生的每一个发育阶段,都伴有差异基因精确而有序地表达[1]。因此,深入了解与精子发生密切相关的差异表达基因,将有助于揭示生殖及进化的奥秘。
研究表明,泛素化修饰在精子发生过程中发挥重要的作用,该修饰过程是通过多种酶级联反应实现的[2],其中E3泛素连接酶具有特异性识别底物的功能,目前精子发生过程中已有很多个差异表达基因被鉴定为E3泛素连接酶,其在精子发生过程中的作用机制正逐渐成为研究热点[3]。
从人睾丸消减cDNA文库中扩增到一个差异表达基因,命名为HSD-34,经序列比对为人源TRIM69基因编码区,该基因编码的蛋白属于TRIM家族蛋白,文献提示TRIM家族很多成员都具有E3泛素连接酶活性[4-6]。该家族蛋白结构特点是含有保守的RING finger结构域,该结构域在介导泛素化修饰过程中发挥重要作用,因此推测,TRIM69也具有E3泛素连接酶活性,能够促进多聚泛素链形成。本研究旨在鉴定TRIM69是否具有催化多聚泛素链形成的活性,为进一步验证其是一个新的E3泛素连接酶奠定基础。
1 材料与方法
1.1 质粒和重组体构建
通过PCR技术,分别把TRIM69WT(1~1 503 bp)、TRIM69CA(1 ~1 503 bp,C61/64A)、TRIM69ΔR(247~1 503 bp)构建到 pcDNA6/V5-HisB载体上;把TRIM69WT(1~1 503 bp)构建到pGEX-4T-3载体上以及把HA-Ub构建到pMSCVpuro载体上。
1.2 抗体来源
anti-Flag和anti-HA抗体(Sigma-Aldrich公司),anti-GST抗体(MBL公司),anti-ubiquitin(P4D1)抗体(Santa Cruz公司)。
1.3 细胞培养和细胞转染
HEK 293T和HeLa细胞(ATCC公司),培养基为加有10%胎牛血清的高糖DMEM培养基,细胞在含5%CO2,37℃的培养箱内培养。HEK293T细胞用engreen-D转染试剂(英格恩公司)转染,HeLa细胞用Lipofectamine 2000转染试剂(英俊公司)转染。
1.4 稳定细胞筛选
首先确定HeLa细胞的嘌呤霉素最小致死浓度,经筛选确定为5 mg/L;将构建好的真核表达质粒pMSCVpuro-HA-Ub,转染进HeLa细胞,转染48 h后加入最小致死浓度的嘌呤霉素,每天换液1次,经过2周左右的筛选,存活的细胞为稳定表达HA-Ub基因的细胞。
1.5 诱导表达纯化
将pGEX-4T-3和pGEX-4T-3-TRIM69重组质粒转化到大肠杆菌BL21(DE3),IPTG诱导表达,裂解细胞,收集上清,过Glutathione SepharoseTM4B亲和层析柱上,洗脱、分管收集、鉴定,将含目标蛋白质的组分合并、浓缩、上样于Superdex200柱上纯化2次,用于后续泛素化实验。
1.6 免疫沉淀
转染后48 h收集细胞,用如下裂解液裂解细胞,[50 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,0.5%NP40,1%SDS],100 ℃ 煮沸10 min,15.7 ×1 000 g室温离心15 min,上清1 mg用稀释缓冲液稀释10倍[50 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,0.5%NP40],然后加入 Flag-M2-agarose(Sigma-Aldrich公司)室温孵育1 h,免疫沉淀物用洗脱缓冲液(50 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,0.5%NP40,0.1%SDS)洗 5 次,8%SDSPAGE跑胶,用相应抗体检测。
2 结果
2.1 TRIM69蛋白结构域分析以及RING结构域氨基酸序列比对
TRIM69编码的蛋白结构域分析(图1A):N-末端41~82位氨基酸残基构成RING结构域,110~144位氨基酸残基构成B-box结构域,175~195位和226~253位氨基酸残基构成coiled-coil结构域,C-末端305~500位氨基酸残基构成 B30.2结构域,即具有RING-B-box-coiled-coil(RBCC)3个连续的结构域,因此,该蛋白质属于TRIM/RBCC蛋白质家族成员。TRIM69属于C-IV亚家族,与该亚家族的其他几个成员相比含有相同的C3HC4 RING结构域(图1B)。
2.2 GST和GST-TRIM69的诱导表达
考马斯亮蓝结果(图2)显示目标分子质量位置(GST:26 ku和GST-TRIM69:82 ku)有高表达的蛋白条带,在该种诱导条件下,GST蛋白在上清中有较多表达,而GST-TRIM69融和蛋白在上清中有少量表达。

图1 TRIM69结构域模式图Fig 1 The domain structure of TRIM69
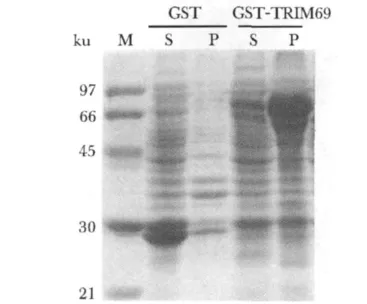
图2 GST-TRIM69以及GST在大肠杆菌BL21(DE3)细胞中的诱导表达Fig 2 The expression of GST or GST-TRIM69 fusion protein induced in Escherichia coli BL21(DE3)
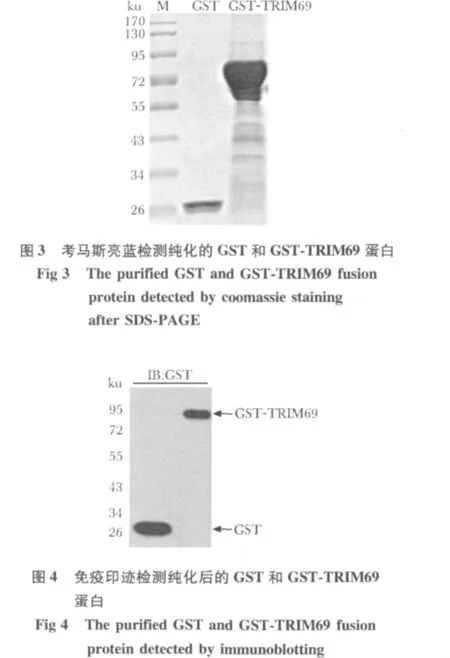
2.3 GST和GST-TRIM69蛋白的纯化
层析纯化的产物经过考马斯亮蓝和Western blot鉴定(图3,4),目的蛋白质纯度达到95%以上,可以用于后续的泛素化实验。
2.4 细胞外泛素化实验分析TRIM69能够催化多聚泛素修饰的产物形成
纯化的GST蛋白和GST-TRIM69融合蛋白偶连GSH-Sepharose4B珠子上,在有或无293T细胞提取物存在条件下,30℃孵育1 h,用泛素抗体检测泛素化条带。
在293T细胞提取物存在条件下,加入GSTTRIM69融合蛋白的实验组能够检测到泛素化条带,而加入GST蛋白的对照组则检测不到泛素化条带,说明TRIM69具有催化多聚泛素链形成活性;另外在没有293T提取物存在条件下,即使加入GSTTRIM69也未见泛素化条带,说明293T细胞提取物含有泛素化反应所需的其他物质,如E1、E2等(图5)。
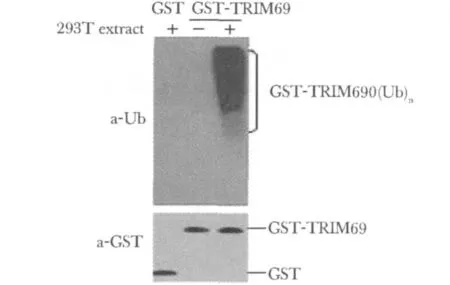
图5 细胞外泛素化试验分析TRIM69能够催化多聚泛素修饰的产物形成Fig 5 The activity of TRIM69 in catalyzing the formation of muti-uiquitination assayed by‘in vitro ubiquitination’experiment
2.5 细胞内泛素化实验分析TRIM69能够催化多聚泛素修饰的产物形成
将Flag-TRIM69和pcDNA6-Flag空载质粒分别与HA-Ub质粒共转染293T细胞,转染40 h后收集细胞,经免疫沉淀和Western blot检测,结果显示:(anti-HA抗体和anti-Flag)两种抗体检测的结果相同,与对照组相比,实验组可见明显呈阶梯状的条带,说明TRIM69具有催化多聚泛素链形成的活性(图6A)。
带Flag标签空载、带Flag标签的TRIM69WT、TRIM69CA、TRIM69ΔR质粒分别转染进 HA-Ub稳定表达的HeLa细胞株,经免疫沉淀和Western blot检测,结果显示,与空载对照组相比,TRIM69WT组可见明显高分子量弥散条带,而当RING结构域点突变 (CA)或缺失 (ΔR),催化形成的高分子量弥散条带明显减弱,提示TRIM69具有催化多聚泛素链形成的活性且该活性与RING结构域有关(图6B)。
3 讨论
TRIM69小鼠同源物基因特异地表达于小鼠睾丸圆形精子细胞中[7]。有关它的功能,仅有1篇文献报道[8]。有关人源 TRIM69基因功能方面的文章,还没有文献报道。本研究通过细胞内外泛素化实验观察到TRIM69能够催化多聚泛素化产物形成,而且该反应过程依赖于 RING结构域,提示TRIM69具有E3泛素连接酶活性。
E3泛素连接酶在精子发生过程中发挥重要作用,如RNF8在圆形精子细胞向长形精子细胞发育过程中发挥作用[9-10];RNF151在顶体形成过程中发挥作用[11];ZNF645在精子质量控制方面发挥作用[12]。
在人、小鼠及大鼠精子发生过程中,有很多含有RING结构域的蛋白参与其中,但其中只有少数蛋白被鉴定具有E3泛素连接酶活性。所以鉴定了TRIM69蛋白具有催化多聚泛素化的活性,为进一步阐明其是一个新的E3泛素连接酶以及其在精子发生过程中的作用提供了依据。
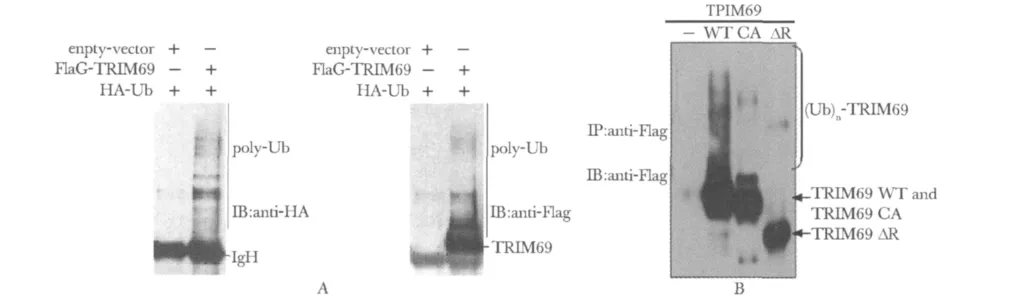
图6 细胞内泛素化试验分析TRIM69能够催化多聚泛素修饰的产物形成Fig 6 The activity of TRIM69 in catalyzing the formation of muti-uiquitination assayed by in vivo ubiquitination
[1]Dym M.Spermatogonial stem cells of the testis[J].Proc Natl Acad Sci USA,1994,91:11287-11289.
[2]Hershko A,Ciechanover A.The ubiquitin system[J].Annu Rev Biochem,1998,67:425 -479.
[3]Hou X,Zhang W,Xiao Z,et al.Mining and characterization of ubiquitin E3 ligases expressed in the mouse testis[J].BMC Genomics,2012,13.doi:10.1186/1471-2164-13-495.
[4]Bell JL,Malyukova A,Holien JK,et al.TRIM16 acts as an E3 ubiquitin ligase and can heterodimerize with other TRIM family members[J].PLoS One,2012,7.doi:10.1371/jour-nal.pone.0037470.
[5]Parodi S,Di Zanni E,Di Lascio S,et al.The E3 ubiquitin ligase TRIM11 mediates the degradation of congenital centralhypoventilation syndrome-associated polyalanine-expanded PHOX2B [J].J Mol Med(Berl),2012,90:1025-1035.
[6]Urano T,Usui T,Takeda S,et al.TRIM44 interacts with and stabilizes terf,a TRIM ubiquitin E3 ligase[J].Biochem Biophys Res Commun,2009,383:263 -268.
[7]Shyu HW,Hsu SH,Hsieh-Li HM,et al.A novel member of the RBCC family,Trif,expressed specifically in the spermatids of mouse testis [J].Mech Dev,2001,108:213-216.
[8]Shyu HW,Hsu SH,Hsieh-Li HM,et al.Forced expression of RNF36 induces cell apoptosis[J].Exp Cell Res,2003,287:301-313.
[9]Ma T,Keller JA,Yu X.RNF8-dependent histone ubiquitination during DNA damage response and spermatogenesis[J].Acta Biochim Biophys Sin(Shanghai),2011,43:339-345.
[10]Rai R,Li JM,Zheng H,et al.The E3 ubiquitin ligase Rnf8 stabilizes Tpp1 to promote telomere end protection[J].Nat Struct Mol Biol,2011,18:1400 -1407.
[11]Nian H,Fan C,Liao S,et al.RNF151,a testis-specific RING finger protein,interacts with dysbindin[J].Arch Biochem Biophys,2007,465:157 -163.
[12]Liu YQ,Bai G,Zhang H,et al.Human RING finger protein ZNF645 is a novel testis-specific E3 ubiquitin ligase[J].Asian J Androl,2010,12:658-666.
