超临界流体制粒技术及其在抗生素药物微粒制备领域中的应用
2013-08-27周敦晖史益强颜庭轩王志祥
周敦晖 史益强 颜庭轩 王志祥
(中国药科大学制药工程教研室,江苏南京210009)
0 引言
抗生素是由生物包括微生物、植物和动物在内,在其生命活动过程中所产生的(或由其他方法获得的),能在低微浓度下有选择地抑制或影响他种生物功能的有机物质。众所周知,抗生素类药物是战胜细菌感染疾病的良方。然而,在传统的抗生素制备工艺中,发酵液的分离和精制十分复杂。对于合成的抗生素类药物,一些常规的制备微粒的技术由于各自存在的缺点而限制了它们的应用。因此,寻求制备粒径小、结晶纯度高、粒度均匀、粒径可控的抗生素微粒制备的方法成为了当前的研究热点。
超临界流体制粒技术是一种新型的微粒制备技术,可以避免传统的微粒制备方法(如机械粉碎、冷冻干燥、喷雾干燥、溶剂蒸发等)制备的产品粒径大、粒径分布不均匀、溶剂残留量大、易变性且纯度低的缺点,同时该技术可用于制备纳米材料和结晶分离热敏性物质。
本文主要对超临界流体技术制备微粒各种方法的基本原理、设备组成及其各自特点进行综述,并重点总结了超临界流体制粒技术在抗生素微粒制备方面的应用。
1 超临界流体制备微细颗粒的方法
根据超临界流体(SCF)在微细颗粒制备过程中所起的作用,一般将超临界流体制备颗粒的方法分为:SCF作为溶剂的超临界流体快速膨胀法(Rapid Expansion of Supercritical Solution,RESS)、SCF作为抗溶剂的超临界流体抗溶剂法(Supercritical Anti-Solvent,SAS)、SCF作为溶质的气体饱和溶液沉析法(Precipitation from Gas Saturated Solution,PGSS)等。
1.1 超临界流体快速膨胀法(RESS)
1.1.1 RESS法及应用
RESS法制备微细颗粒的原理主要是以超临界流体对溶质特殊的溶解作用为基础,利用溶质在超临界条件下的溶解度随压力急剧变化的特点,使含有溶质的超临界流体在极短的时间内快速减压膨胀的过程,这个转变使溶质迅速成核并生长成为微粒而沉积。RESS过程装置如图1所示。其主要过程是:先将溶质溶解在超临界流体中,然后使超临界流体在非常短的时间内(约10-8~10-5s)通过喷嘴(直径为40~200μm)进行减压膨胀,并形成以音速传递的机械搅动。膨胀过程中因压力、温度的突然变化使溶质的过饱和度骤然升高,析出大量微核,并在极短的时间内快速生成,形成粒度均匀的微米或纳米级颗粒。
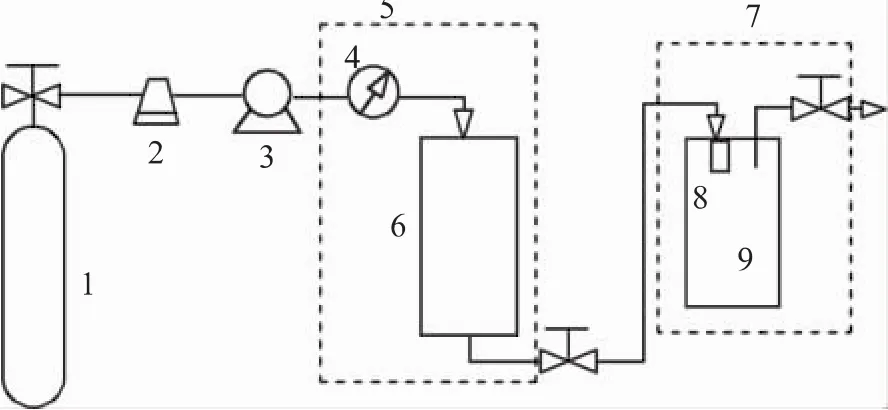
图1 RESS过程装置图
RESS法最大的特点是快速扰动和高过饱和度的结合,前者使介质中的组分分布均一,从而形成很窄的粒径分布,后者使微粒超细化,二者结合既可以控制产品的大小,又可以控制粒度的分布。在超临界流体中,物质结晶时的黏度和表面张力下降,从而使得生成的微粒不能凝聚,得到的微粒可达微米级,甚至是纳米级。由于RESS具有设备及过程简单、操作容易,且形成的粒子尺寸小等特点而受到人们的广泛重视。但是,RESS法最大的局限性在于它只能处理可较好溶于超临界流体的物料。一般物料在超临界流体中的溶解度极低,大多数极性和非极性化合物都难溶于环境友好溶剂CO2,即使使用助溶剂增加溶解性也是不可行的,这些都限制了其使用。
1.1.2 其他RESS技术
1.1.2.1 RESS结合流化床技术
RESS法制备复合微粒时,由于大多数情况下芯材颗粒静置在喷胀室内,存在“死区”,使得析出的包覆剂微粒不能形成对芯材的完全包覆,导致形成的包覆层不均匀。RESS结合流化床技术可以避免这些现象,其原理是在气流的作用下,芯材可以处于悬浮状态,溶有壁材的溶液均匀地喷洒在悬浮的芯材颗粒上,随着溶剂的蒸发,壁材析出并沉积在芯材颗粒的表面,形成复合微粒。与单纯RESS过程相比,引入流化床技术,不仅解决了RESS中的“死区”存在问题,还避免了细微颗粒的团聚问题。
1.1.2.2 RESS-撞击流技术
RESS-撞击流技术就是将芯材颗粒和溶有壁材的超临界流体在萃取釜中搅拌混合,形成悬浮液,然后通过安装在撞击流容器内的2个毛细喷嘴喷射出的2股快速膨胀形成的雾化液滴在喷嘴间区域相向撞击制得复合微粒。在RESS中引入撞击流过程可以促进微粒的制备,减弱颗粒间的团聚现象。
1.2 超临界流体抗溶剂法(SAS)
SAS法根据实施的不同过程可分为:气体抗溶剂法(Gas Anti-solvent,简称GAS)、压缩流体抗溶剂沉淀法(Precipitation w ith a Compressed Fluid Anti-solvent,简称PCA)或称气溶胶溶剂萃取法(Aerosol Solvent Extraction System,ASES)、超临界流体增强溶液分散法(Solution Enhanced Dispersion by Supercritical Fluids,简称SEDS)等。
1.2.1 SAS法原理及特点
SAS法的基本原理是把溶质溶于有机溶剂中形成溶液,选择一种能溶于溶剂但不能和溶质互溶的超临界流体(通常为CO2)作为抗溶剂,但抗溶剂与溶液接触时,抗溶剂迅速扩散到溶剂中,使溶剂体积膨胀,溶质在溶剂中的溶解度极剧下降,在极短的时间内形成较大的过饱和度,使溶质结晶析出粒径较小的超微颗粒。
SAS法的特点是,通过改变结晶过程参数,如温度、压力、溶液浓度、进样速度等,能够很好地控制粒径的大小、分布以及粒子的形态。此外,合适的溶剂和操作条件的选择是决定抗溶剂法成功制备出干燥超细微粒的先决条件。
1.2.2 SAS法的分类
1.2.2.1 GAS法
GAS法的流程装置如图2所示,先用高效液相泵向结晶釜中通入含有溶质的溶液,然后通过高压泵将超临界抗溶剂加入结晶釜,利用超临界流体对溶剂有较大的溶解度这一特点,使釜内溶剂膨胀,从而降低溶质在溶剂中的溶解度,过饱和的溶质迅速沉淀析出晶体,继续在等压条件下通入超临界CO2,待釜内溶剂完全被带走,干燥所得微粒即为溶质的超细微粒。

图2 GAS流程装置图
GAS法的特点是制粒过程操作简单、设备要求低,但缺点是结晶釜中通入CO2时溶液难以达到均匀的体积膨胀,难以实现均一的过饱和度,导致析出的晶体颗粒粒径相差较大。此外,GAS法只能分批间歇操作,在工业生产中的应用受到限制。
1.2.2.2 PCA法
PCA法也被称为ASES,是对GAS的改进,其流程装置如图3所示,PCA装置与GAS装置的主要区别在于,PCA采用一种特制的喷嘴,含有溶质的溶液通过喷嘴形成雾滴分散到超临界流体中,增强了超临界流体与溶液之间的扩散传质作用,导致微粒沉淀析出。

图3 PCA(ASES)流程装置图
PCA法的特点是通过喷嘴,加以较高的压力,可以使溶液充分雾化,增强了气液间的传质,从而得到更小的颗粒。
1.2.2.3 SEDS法
Hanna等综合了GAS和ASES的优点提出超临界流体增强溶液分散法(SEDS)。其流程装置如图4所示,将超临界流体与溶液通过位于结晶釜顶部的同轴喷嘴的同时加入结晶釜,在喷嘴中高速湍流的超临界流体将溶液带入结晶釜的同时,通过机械作用将溶液分散成更为细小的雾滴,同时超临界流体还可以将溶剂萃取并带走,极大地增强了溶质的过饱和度,从而沉析出更细小的颗粒,通常能达到纳米级别。

图4 SEDS流程装置图
SEDS的特点是采用同轴喷嘴,这个特制喷嘴由2个同轴通道构成,分别是气相通道和液相通道,利用SCF的化学性质和机械特性达到“增强喷雾”的效果,从而使溶液雾化后形成细小和混合均匀的液滴。SAS-EM是超临界流体微粒化技术的一个重要改进。在传统SAS法的基础上,在喷嘴出口处增加了一个超声振动器,利用超声波将溶液雾化成更小的液滴,增强了超临界相内的湍动和混合程度,进而提高了溶液与抗溶剂间的传质过程。
1.3 气体饱和溶液沉析法(PGSS)
PGSS法的原理是超临界流体在熔融状态的物料中的溶解度远高于熔融物料在超临界流体中的溶解度,将超临界流体与熔融物料混合后,通过喷嘴膨胀形成的气溶胶在热气流干燥后微粒沉析,其流程装置如图5所示。因为流体膨胀导致溶液冷却速度很快,所以可以形成分布均匀的微细颗粒。

图5 PGSS流程装置图
PGSS法分为2类:一类是熔融结晶形成大量固体微粒的PGSS过程,另一类是具有喷雾干燥机理的PGSS过程,前者适用于熔融的脂类、高分子物质,后者适用于含水或有机溶剂的体系。PGSS法还可用于低熔点、耐热微细颗粒的制备。
1.4 超临界抗溶剂雾化法(SAA)
超临界抗溶剂雾化法(SAA)以超临界流体增强溶液分散法(SEDS)和气体饱和溶液微粒形成法(PGSS)为基础,综合了两者的优点,其流程装置如图6所示。SAA与SEDS的不同之处在于增加了喷嘴后结晶釜压力P2的控制方式。当P2压力为大气压时即为PGSS,当P2压力达到超临界状态所需压力时则为SEDS。对于不同的物系可以通过改变压力降而采取不同的压力进行操作。SAA的特点是可以处理含水体系,并且由于引入了雾化干燥,可以较好地解决产品中的溶剂残留问题。
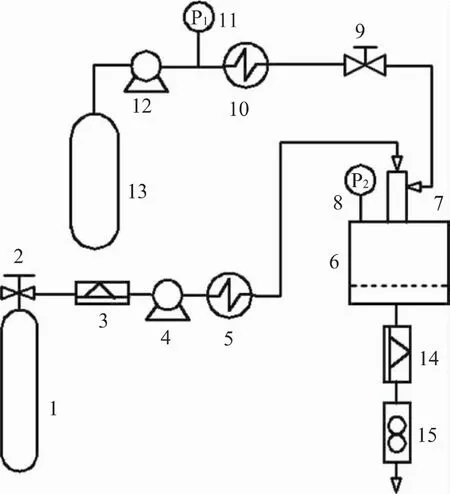
图6 SAA流程装置图
1.5 超临界流体注入法
超临界流体注入法的基本原理是活性物质溶解于超临界流体中,然后活性物质随着超临界流体进入到具有孔隙的基质载体中,进入到载体内部的一部分活性物质与载体之间在相互作用力(如范德华力、氢键)的作用下被吸附到载体上。另外,在系统泄压过程中,有部分溶解在超临界流体中的活性物质析出,沉积在载体的内部和表面。因此,为得到复合物中活性物质较高的负载量,通常需要溶质在超临界流体中具有较大的溶解度,或者溶质与载体之间具有很强的相互作用力。超临界流体注入法的流程装置如图7所示。在超临界注入法中,选择载体材料十分重要,合适的载体可以充分溶胀,以便其与药物充分接触,形成饱和物,从而防止药物的重结晶。

图7 超临界流体注入法流程装置图
1.6 其他超临界流体制粒新技术
近年来,在常规的超临界流体制粒技术的基础上衍生出一些新的方法,如超临界微乳液法、超临界水热合成法、超临界快速膨胀溶液接收法、溶胶—凝胶超临界干燥法等,这些新方法在高分子领域、纳米材料等领域有广阔的应用前景。
2 超临界流体制粒技术在抗生素微粉制备方面的应用
2.1 改变抗生素药物的粒度,提高生物利用度
对于溶解性能差的药物粒子,例如灰黄霉素,由于其生物利用度低,所以在临床给药剂量很高,而粒径大小是影响药物粒子溶解速度的关键因素,从而极大地影响了药物的生物利用度。
胡国勤等用RESS法制备了平均直径只有1μm左右的灰黄霉素微粒,且粒径分布相当窄。制备前后灰黄霉素的物理性质及结构没有明显变化。溶解实验表明,经RESS法获得的灰黄霉素溶解速率不仅快,而且在20 m in后浓度达到最高。
Li等利用SAA法成功制备出粒径小于3μm的水溶性头孢羟氨苄超细微粒,可以很好地应用于吸入粉雾剂系统,用其治疗肺部感染,药物可直接到达病灶,从而避免其他给药方式由于吸收不良和代谢作用而只有少量有效成分能到达肺部的弊端。
Tenorio等分别以N-甲基吡咯烷酮、二甲基亚砜、乙醇为溶剂,利用SAS过程制备出氨苄西林超细微粒。当使用N-甲基吡咯烷酮为溶剂时效果最好,并成功制备了平均粒径为(0.26±0.08)μm的氨苄西林超细微粒,而粒子的形状和聚合程度可以通过改变操作压力来控制,这种超细微粒有望制备成氨苄西林气雾剂。
蔡美强等在超临界辅助雾化法(SAA)中引入水力空化混合器,成功制备出罗红霉素超细微粒,大部分微粒形态呈球形,且通过改变操作参数可制得粒径在1~3μm的适于吸入式给药的气溶胶药物微粒和粒径小于1μm的超细微粒。这种微粒可到达肺部深处,直接进入病灶,既可提高药效,又能降低药物用量。
Chu等利用ASES法制备出粒径仅为0.1~0.2μm的头孢泊肟酯球形微粒,实验研究结果表明,CO2与头孢泊肟酯的质量比、溶剂的类型、头孢泊肟酯的浓度会影响药物的聚合程度,且经ASES法获得的头孢泊肟酯微粒的溶解速率明显快于头孢泊肟酯原料药的溶解速率。
2.2 制备抗生素药物复合微粒
药用复合微粒是指通过制剂技术将药物包裹在无毒、无污染、可生物降解的药用高分子聚合物中的一种药用微粒,具有提高药物在生物体内的稳定性、标靶性及药效的优点,是新型药物制剂的重点研究方向之一。
近年来,国内外均有关于采用超临界流体制粒技术制备抗生素—药用复合微粒的研究报道。
陈岚等以丙酮为溶剂,以乙基纤维素为包囊材料,以卡波谱为黏附材料,采用GAS法和SEDS法均得到粒径小于10μm的乙基纤维素—卡波谱/阿莫西林微囊,体外溶出实验表明,微囊具有明显的缓释效果。
Uzun等以甲醇为溶剂,采用SAS过程制备了聚乙烯吡咯烷酮/头孢呋辛酯(PVP/CFA)复合微粒,实验得到的复合微粒平均粒径在1.88~3.97μm之间。随着聚合物比率的增大,复合微粒的药物溶出速率也随之增大,当PVP:CFA=1:1时,复合微粒的药物溶出速率比未经处理的CFA释放速度慢10倍。
池胜采用RESS-流化床结合撞击流技术制备出阿莫西林/PEG微胶囊。制备出的微胶囊颗粒粒径分布均匀,且芯材表面有一层致密的包覆皮层,对内芯可以起到一定的保护作用,药物在释放过程中有良好的缓释效果,是一种有效的制备药物微胶囊的方法。
Sarkari用PCA法以CO2作抗溶剂得到平均粒径为1.04μm的球形灰黄霉素、0.5~2.5μm的聚L-乳酸的球形微粒和灰黄霉素与聚L-乳酸的共聚物,药物和生物可降解聚合物,共同沉析有利于开发控释药物或靶向药物应用研究。
3 超临界流体制粒技术制备抗生素药物微粒的优势
超临界流体的黏度较小,扩散系数大,具有可调节性以及较低的表面张力,无毒性,使得其成为制备抗生素药物微粒潜在的良好介质。超临界流体制粒技术操作条件温和,对药物活性影响小,非常适合制备具有生物活性的药物,同时也适合制备热敏性药物。对于抗生素微粒的制备,超临界流体制粒技术可以实现低温下制备微米甚至是纳米颗粒,特别对于一些制成肺部给药的抗生素,对粒径要求很高,而超临界流体制粒技术可以满足这一要求。采用超临界流体制备出的粉体粒径均匀、粒径分布窄,并具有操作简便、速度快、产率高、无溶剂残留或含量极低、满足药典要求、没有二次污染等优点。
另外,利用超临界流体还可以制备粒度分布均匀的抗生素药物超细微粒和复合微粒,提高药物的溶解度,增强其在生物体内的稳定性、标靶性,提高药物的生物活性及治疗药效。
4 结语
超临界流体制粒技术是近几十年来发展起来的新技术,不少学者在药物微粒制备方面有大量的研究。然而,在超临界流体制粒技术制备抗生素微粒方面的研究还远远不够,特别是一些新的技术,如超临界注入法、超临界微乳液法等。随着相关学科的发展和该项技术应用研究的进一步深入,超临界流体制粒技术用于抗生素微粒的制备必定会有广阔的应用前景。
[1]顾觉奋.抗生素[M].上海:上海科学技术出版社,2001
[2]Li S Z,Li XY,Cui Z F,et al.Appl ication of ul t raf i l t ration to improve the ext raction of antibiotics[J].Sep Puri f Technol,2004(34)
[3]陈岚,张岩,李保国,等.压力对超临界流体技术制备药物微粒的影响[J].上海理工大学学报,2004,26(3)
[4]乔培.超临界流体技术制备微细颗粒的方法及装置[J].医药工程设计,2010,31(1)
[5] Kayrak D,Akman U,Hor tacsu O.Micronization of iburpofen by RESS[J].J.supercrit.f luids,2003(26)
[6]池胜.超临界撞击流制备微胶囊的工艺参数研究[D]:[硕士学位论文].大连:大连理工大学,2011
[7]Tsutsumi A,Ikeda M,Chen W.A nano-coating process by the rapid expansion of supercritical suspensions in impinging-st ream reactors[J].Powder Technol,2003,138(3)
[8] Reverchon E,Marco I D.Mechanisms cont rol l ing supercritical antisolvent precipitate morphology[J].Chem Eng Technol,2011(169)
[9] Hanna M H,York P.Method and apparatus for the formation of par ticles[P].WO9501221,1995
[10] Yeo SD,Kiran E.Formation of polymer par ticles with supercritical f luids:A review[J].J.supercrit f luids,2005,34(3)
[11] Pemsel M,Schwab S,Scheurer A,et al.Advanced PGSS process for the encapsulation of the biopesticide cydia pomonel la granulovirus[J].J.supercrit.f luids,2010(53)
[12]王霞.PGSS技术制备布诺芬/脂复合微粒[D]:[硕士学位论文].厦门:厦门大学,2008
[13] Reverchon E,Antonacci A.Polymer micropar ticles production by supercritical assisted atomization[J].J.supercrit.f luids,2007,39(3)
[14] Kazarian S G,Mar tirosyan G G.Spect roscopy of polymer/drug formulations processed with supercritical f luids:in situ ATR-IR and Raman study of impregnation of ibuprofen into PVP[J].Int.J.Pharm.2002,232(1)
[15] Kikic I,Vecchione F.Supercritical impregnation of polymers[J].Cur r.Opin.Sol id State Mater,2003(7)
[16] Manna L,Banchero M,Sola D,et al.Impregnation of PVP micropar ticles with ketoprofen in the presence of supercritical CO2[J].J.supercrit.f luids,2007(42)
[17]胡国勤,陈琪,邓修.超临界溶液快速膨胀制备灰黄霉素超细微粒的表征与溶解性研究[J].中国抗生素杂志,2010,35(9)
[18]Li Z Y,Jiang J Z,Liu X W,et al.Experimental investigation on the micronization of aqueous cefadroxi l by supercritical f luid technology[J].J.supercrit.f luids,2009,48(2)
[19]Tenorio A,Gordi l lo M D,Pereyra C,et al.Control led submicro par ticle formation of ampici l l in by supercritical antisolvent precipitation[J].J.supercrit.f luids,2007,40(2)
[20]蔡美强,关怡新,姚善泾,等.水力空化混合强化超临界流体辅助雾化制备罗红霉素超细微粒[J].化工学报,2008,59(2)
[21]Chu J H,Li G H,Row K H,et al.Preparation of cefpodoxime proxeti l f ine par ticles using supercritical f luids[J].Int.J.Pharm.2009(369)
[22]陈岚,张岩,李保国,等.超临界流体技术试制阿莫西林缓释微粒[J].中国医药工业杂志,2005,36(2)
[23]Uzun I N,Sipahigi l O,Dincer S.Coprecipitation of cefuroxime axeti l-PVP composite micropar ticles by batch supercritical antisolvent process[J].J.supercrit.f luids,2011,55(3)
[24] Sarkari M,Dar rat I,Knutson B L.Generation of Micropar ticles Using CO2and CO2-Phi l ic Antisolvents[J].AIChE.J.2000,46(9)
