关于LAMP技术检测禽白血病病毒J亚群的特异性及灵敏性的分析
2013-08-25杨君照刘金尧王建玉
杨君照 徐 凯 白 玉 刘金尧 王建玉
(1.江苏省盐城市阜宁县东沟镇人民政府,盐城 224000;
2.江苏省盐城市农业委员会,盐城 224000;
3.山西省大同市畜禽管理所,大同 037000;
4.江苏省新沂市农业委员会,新沂 221400;
5.江苏省连云港市灌云县住建局,连云港 222000)
关于LAMP技术检测禽白血病病毒J亚群的特异性及灵敏性的分析
杨君照1徐 凯2白 玉3刘金尧4王建玉5
(1.江苏省盐城市阜宁县东沟镇人民政府,盐城 224000;
2.江苏省盐城市农业委员会,盐城 224000;
3.山西省大同市畜禽管理所,大同 037000;
4.江苏省新沂市农业委员会,新沂 221400;
5.江苏省连云港市灌云县住建局,连云港 222000)
环介导等温扩增LAMP是一门新兴的分子生物学检测技术,由于其具有特异性高、敏感性高、简单、快速、廉价、易检测等特点,受到了生物医学研究者的高度关注。本文旨在分析禽白血病病毒J亚群LAMP法检测体系的特异性,并比较LAMP法与常规PCR法在检测禽白血病病毒J亚群中的敏感性。结果显示,在禽白血病病毒J亚群病毒中,无交叉反应;而灵敏性分析结果显示,LAMP法在检测ALV-J过程中其敏感性胜于常规PCR。
环介导等温扩增 J亚群白血病 lk特异性 敏感性
禽白血病病毒 J 亚群(ALV-J)在我国及世界各国的禽病中影响越来越为广泛,并且在我国形成一种蔓延的趋势,它是一种以能诱导肉鸡产生骨髓细胞瘤病(ML)、肾瘤和其他多种肿瘤,死亡率为1%~2%,偶尔可高达20%的一种禽类疾病。而目前对此病的诊断方法主要是ELISA、PCR为主,但对实验的条件及其人员要求相对较高,而环介导等温扩增(LAMP)是由Notomi等人设计并用于鉴别病毒及其他病原体的一种新型检测方法。本项技术主要是利用4种不同的特异性引物识别靶基因的6个特定区域和一种具有链置换活性的DNA聚合酶,在等温条件进行扩增反应基因的扩增和产物的检测。其具有高效、灵敏、快速、方便等特点。本次实验就该项技术对于ALV-J的灵敏性及特异性做了相关的研究。
1 试验材料
1.1 材料
毒株:扬州大学秦爱建实验室ALV-J JSNT株,山东农业大学崔治中实验室ALV-JNX0101株,华南农业大学SCAU-0901,SCAU-CHN,RAV-1,RAV-2,ALV-A,ALV-B,ALV-E等10株。
1.2 主要仪器和设备
动物饲养设备,PCR仪,电泳仪,凝胶成像系统,离心机,水浴锅,细胞培养箱,二氧化碳培养箱。
1.3 主要试剂
引物合成,蛋白酶K、PCR试剂,RNA提取试剂盒,消化液,5×TBE电泳缓冲液/L,54 gTris碱,27.5 g硼酸,20 ml EDTA(0.5M、pH8.0),室温保存,使用时5倍稀释。50×TAE电泳缓冲液/L:242 gTris碱,57.1 ml冰乙酸,100 ml EDTA(0.5M、pH8.0),室温保存,使用时50倍稀释。LAMP试剂,限制性内切酶,胎牛血清,Bst大片段链置换酶,SYBR green I dye,反转录酶M-Mulv、Rnase Inhibitor,随机引物、DEPC处理水.
2 试验方法与步骤
2.1 病毒核酸的提取
使用RNA提取试剂盒进行提取。
2.2 样品制备
2.2.1 RNA反转录
50 ul体系(按照本实验室经典体系进行反转录,参数如下)
2.2.2 反转录步骤
将提取的病毒核酸溶于DEPC处理过的DDW中,70℃反应5 min;拿出后立即冰水浴,稍离心,依次加入RNA酶抑制剂,反转录酶及其Buffer、dNTP、42 ℃反应1 h;拿出后95℃反应以灭活反转录酶活性,4 ℃保存,用于LAMP及PCR检测。
2.3 引物设计及反应体系
2.3.1 引物设计
对于ALV-J通过专门的LAMP引物设计软件Primer Explorer V3软件(Eiken Chemical Co.Ltd.,Tokyo,Japan)的设计以及以及上海生物工程有限公司的合成。得到如下引物:
成果转化服务人才队伍建设方面存在的问题 科技成果转化往往需要资金和市场,转化需要包括技术研发、技术经纪、技术市场把握、与企业沟通谈判等在内的团队协同工作,从目前的情况分析来看,江苏师范大学要不断地加大比较熟悉市场且懂得相应技术的中介人才队伍的建设,从而推动学校专利成果转化。
2.3.2 反应体系
2.3.2.1 LAMP反应体系为25μl 1×ThermoPol buffer(New England BiolabsInc.,U SA),6mM Mg2+,0.8mM dNTPs,0.25μM外引物(F3和B3),1.0μM内引物(FIP和B IP),1μl模板DNA,8U Bst聚合酶(New England Biolabs),0.4M甜菜碱(Sigma-Aldrich Inc.,MO,USA),20 mM Tris-HCl,10mM KCl,10 mM(NH4)2SO4。反应条件:63℃恒温45min,然后85℃恒温5 min。
2.3.2.2 PCR反应体系为25 ul 10×扩增缓冲液2.5ul,1.5 ulM Mg2+,0.5 ul Taq DNA聚合酶,0.5 ul 模板DNA,引物各0.5 ul,2 ul MdNTP。

Method Primer name length Sequence(5’-3’)LAMP F3 19 GCAACCAGGGAACCTTTGG B3 20 GCTGACGAGACTAACCGATC FIP 38 AAGGGGAGGTGGCTGACTGTTTACATGGGCCGACCGTA BIP 40 ATCCCGTCCCCTATTTCCGAGGTTCCCAAGGTGGTGCAATT PCR H5 20 GGATGAGGTGACTAAGAAAG H7 20 GGAACCAAAGGTAACACACG
PCR反应循环参数:在95℃下5 min使得模板DNA变性,并在94℃下维持30 s。置于50℃下1 min,因为退火温度越高,所得产物的特异性越高,延伸反应72℃维持40 s并做30轮的循环扩增。最后一轮循环结束后,于72℃下保温10 min,使反应产物扩增充分,并且在16℃下保存。
2.4 特异性的试验
2.4.1 LAMP扩增特异性及产物的检测方法
用Dde Ⅰ内切酶确定LAMP扩增产物的特异性,酶切产物经过琼脂凝胶电泳检测:琼脂糖浓度为2%,50×TAE电泳缓冲液/L,以恒定电压120V电泳45 min,最后用紫外线灯检测扩增条带。
荧光检测:产物中加SYBR GreenI,肉眼观察颜色反应;呈绿色的为阳性反应,橙红色为阴性反应。在紫外光照射下呈绿色荧光的为阳性反应,黄色为阴性反应。
2.4.2 ALV-J病毒LAMP检测方法特异性
取ALV-J(JSNT、JNX0101、SCAU-0901、SCAU-CHN)、ALV-A、ALV-B、RAV-1、RAV-2、ALV-E1、ALV-E2为模板进行LAMP扩增,按照其体系进行检测,分析其特异性。
2.5 敏感性的试验
LAMP VS Conventional PCR
2.5.1 倍比稀释比较
用10-1-10-9稀释度的ALV-J病毒为模板分别进行LAMP、常规PCR,分析LAMP检测灵敏性。
2.5.2 用质粒载体克隆方式比较
为了比较LAMP及常规PCR检测反应的敏感性,将JSNT株中PCR扩增的545bp的特异性扩增片段进行纯化,然后克隆至pGEM-T载体中,重组质粒放入LB培养液中,37℃摇床过夜培养。重组质粒DNA采用QIAprep Spin Miniprep试剂盒提取(QIAGEN,CA,USA),进行序列验证,阳性质粒采用260 nm紫外分光光度计定量,然后倍比稀释用于两种方法的敏感性比较。
3 试验结果
试验结果有3种判定方法:①琼脂糖电泳后,用SYBR GreenI染色检测。②产物中加入Mg2+试剂,肉眼观测副产物焦磷酸镁沉淀,产物呈阳性的反应,则管内液体浑浊,离心或由白色沉淀集于管底,阴性反应则无此现象。③产物中加SYBR GreenI,肉眼观察颜色反应;呈绿色的为阳性反应,橙红色为阴性反应;在紫外光照射下呈绿色荧光的为阳性反应,黄色为阴性反应。
3.1 LAMP在ALV-J基因检测中的扩增特异性及产物检测
分别用琼脂糖凝胶电泳法、白色沉淀法和SYBR green I绿色荧光法检测LAMP 扩增产物。用Dde Ⅰ内切酶确定其特异性,如图2 B。LAMP扩增产物在凝胶电泳图谱上呈梯状(泳道1),经过内切酶消化,出现了200 bp,267 bp 或 314 bp三条泳带(泳道2)与理论值相符合,说明是特异性的扩增。SYBR green I 荧光检测中,一管为绿色(图1 B),另一管为桔黄色(图1 B),绿色表明结果为阳性,桔黄色为阴性。

图1 白色沉淀法和SYBR green Ⅰ绿色荧光法
图1A扩增产物中加入Mg2+试剂,左边管有产物焦磷酸镁沉淀,呈阳性反应,液体浑浊,离心或由白色沉淀集于管底,右侧阴性反应则无此现象。B中产物中加SYBR GreenI,肉眼观察颜色反应;呈绿色的为阳性反应,橙红色为阴性反应。在紫外光照射下呈绿色荧光的为阳性反应,黄色为阴性反应。
3.2 ALV-J病毒ALMP检测方法的特异性
以其他病毒为模板检测体系的特异性,实验结果如图2A。具体检测结果如附表;由此可知,ALV-J病毒LAMP检测法只扩增ALV-J病毒核酸而不扩增其他非目标核酸,因此其建立的LAMP具有良好的检测特异性。

图2 禽白血病J亚型病毒检测方法特异性
图2A以ALV-J(JSNT、JSNT、SCAU-0901、SCAU-CHN)、ALV-A、ALV-B、RAV-1、RAV-2、ALV-E1、ALV-E2为模板进行LAMP扩增,ALV-J(NX0101、JSNT、SCAU-0901、SCAUCHN)出现扩增,其他病毒未出现扩增。图2B扩增产物在凝胶电泳图谱上呈梯状(泳道1),经过内切酶消化,出现了200 bp,267 bp,or 314 bp三条泳带(泳道2)

表 ALV-J与其他病毒特异性检测结果
3.3 LAMP在ALV-J基因检测中的灵敏度的测试
以10-1~10-9稀释度的ALV-J病毒DNA为模板分别进行了LAMP、常规 PCR,分析LAMP检测灵敏性,结果如图3。LAMP可以检测到5个拷贝的核酸,如图3。但是,ALV-J病毒在realtime PCR法只能检测到102个拷贝的核酸。经过几次试验都得到了相似的结果。由此可见,所建立的ALV-J病毒LAMP检测法较常规 PCR灵敏性高。
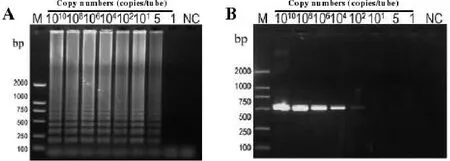
图3 LAMP及常规PCR的灵敏度的测试
图3 LAMP可以检测到5个拷贝的核酸,realtime PCR法能检测到102个拷贝的核酸
4 讨论及其分析
4.1 LAMP 特异性测试
LAMP之所以有很强的特异性,是因为四条特异性的引物可以识别靶基因当中的六个特异序列,从而使得LAMP扩增的高特异性。在LAMP产物检测的3种方法当中,就LAMP扩增产物在琼脂凝胶电泳图谱上之所以呈梯状,主要是由于扩增产物的左后产物为茎环DNA组成的混合物,也就是说其中有若干倍茎长度的类似花椰菜结构的茎环DNA。其次,DdeⅠ内切酶消化的这一结果表明了试验的结果与理论预期是一致的,证明了LAMP扩增产物的特异性。LAMP核酸扩增当中,由于焦磷酸根离子与反应液中的Mg2+相结合从而产生了焦磷酸镁白色沉淀,因此还可通过相关的浊度仪进行检测,实现它的定量和实时监测。如果LAMP有扩增产物,则向反应溶液中加入SYBR green I dye,SYBR green I就会与DNA相结合,可以当即用肉眼进行观察,反应溶液为绿色则为阳性;反应溶液为橘黄色则为阴性。3种方法中,以绿色荧光检测最为迅速,便捷,可靠,可以实现现场的快速检测的需求。
4.2 LAMP 灵敏度测试
在试验过程中,通过与普通PCR的比较,LAMP的高灵敏度,是由于扩增模板量可低至10拷贝或更少,而产物扩增指数达109~1010拷贝,因此其灵敏性相对较高。LAMP检测方法具有很高的灵敏性,检测极限相对较高,能够很大程度上的实现现场快速初检的需求。
4.3 综合评价
就此次实验而言,虽然LAMP的原理相对复杂,但是所建立的关于ALV-J病毒LAMP检测体系,是一项可以在等温条件下,具有快速、便捷、高效、灵敏的一项检测技术,用于现场的快速检测,无需复杂的仪器设备,对于人员要求也相对不高,是一个快速、便捷的新方法。当然,在本次试验中还存在一些不足之处,比如特异性试验中的毒株在实验过程中由于各方面原因还差一些亚群不能获得,造成了试验的欠缺。其次LAMP技术并未与RT-PRC进行对比。然后,LAMP在临床应用上还有待广泛应用。LAMP是一种新型的核酸扩增方法,在某些方面可能仍然存在一些不足,例如Nagamine曾报道DNA 模板在不预变性的条件下也能发生LAMP 扩增,但其机制尚不清楚,如果这种现象的原因得以阐明,将进一步简化LAMP 技术的操作程序。Maruyama曾报道不使用外引物也能产生特异性的阶梯状条带。此外,LAMP 扩增的产物不易分析,在数篇文献报道中LAMP 扩增的梯度性条带的带型存在差异。与此同时,引物设计难度大也是限制LAMP 技术推广的因素。但是,相信随着相关研究的不断深入,将会使LAMP技术得到更好的发展及完善,从而能更好的服务于社会。
[1] 李启明,马学军,周蕊,等.环介导逆转录等温扩增技术(RTLAMP)在丙型肝炎病毒基因检测中的应用[J].病毒学报,2006,22(5):334-338.
[2] 黄淑坚,龚中贵,陈秀玲,等.禽流感、新城疫、传染性支气管炎病毒多联RT2PCR诊断方法的建立[J].广东农业科学,2006,(10):62-65.
[3] 李启明,侯云德.逆转录环介导等温核酸扩增技术(RT2LAMP在H5N1禽流感病毒基因检测中的应用[J].病毒学报,2008,24(3):178-207.
[4] 殷 震,刘景华.动物病毒学 [M].北京:科学出版社,1997.
[5] 秦爱建,刘岳龙,周绮雯,等.J亚群禽白血病病毒的免疫荧光检测效果[J].中国预防兽医学报,2001,(3):214-216.
[6] 王建新,崔治中,张纪元,等.J亚群禽白血病病毒与禽网状内皮增生症病毒共感染对肉鸡生长和免疫功能的抑制作用[J].中国兽医学报,2003,23(3):211-213.
[7] 商营利, 刘思当, 丁宝君, 等. 鸡感染J亚群禽白血病病毒的免疫抑制机理[J]. 中国兽医学报, 2005, 25(6):573-577.
[8] BW卡尔尼克.禽病学[M].第9版.高 福,刘文军主译.北京:北京农业大学出版社,1991.
