吡咯烷二硫代氨基甲酸盐对喉癌Hep-2细胞增殖和凋亡的影响
2013-08-24曹雪秋
曹雪秋
(湖北民族学院附属民大医院耳鼻喉头颈外科,湖北 恩施 445000)
喉癌是头颈部肿瘤中的高发病,占全身恶性肿瘤的5.7%~7.6%,占耳鼻咽喉恶性肿瘤的7.9%~35%,也是呼吸道仅次于肺癌的第二位高发癌[1]。其发病可能与吸烟、饮酒、空气污染、病毒感染及激素水平等多种因素有关。核因子κB(nuclear factor kappaB,NF-κB)作为一种核转录因子广泛存在于多种真核细胞内,参与细胞的炎症反应和免疫应答,调控细胞增殖与凋亡,在肿瘤细胞的发生、发展中起着重要的作用[2-3]。吡咯 烷 二 硫 代 氨 基 甲 酸 盐 (ammonium pyrrolidinedithiocarbamate,PDTC)是一种可以通透细胞膜的 NF-κB活化抑制剂,可以在多种细胞中抑制NF-κB的激活[4]。本研究拟通过体外细胞实验来探讨PDTC对喉癌Hep-2细胞的凋亡和增殖的影响,为进一步发掘有效治疗喉癌的药物和阐明相关机制提供理论依据。
1 材料与方法
1.1 材料 喉癌Hep-2细胞购自中科院上海细胞所。1640培养基和胎牛血清(美国 Hyclone公司),PDTC(中国碧云天生物科技研究所),MTT试剂(中国碧云天生物科技研究所),Trizol(美国Invitrogen公司),RNA反转录试剂盒(宝生物工程大连有限公司),核酸染料(美国 Bio-Rad公司),p-IκB单克隆抗体、Bcl-xL单克隆抗体、XIAP单克隆抗体(美国Sigma公司),流式细胞仪(美国BD公司),CFX 96TM PCR仪(美国Bio-Rad公司),凝胶成像仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养 Hep-2细胞接种于50mL细胞培养瓶,用含有10%胎牛血清的1640培养基培养细胞。培养瓶置于37℃、5%CO2、饱和湿度的培养箱中。细胞贴壁生长后2d换液1次,细胞融合至80%左右时消化传代。
1.2.2 Hep-2细胞的分组及培养 取对数生长期细胞配制成浓度为5×104/mL的Hep-2细胞悬液,每孔加入200μL细胞悬液,将细胞接种于96孔板。细胞分为3个组:对照组、实验分为50、100μmol/L组。每组设3个复孔,置于37℃、5%CO2、饱和湿度的细胞培养箱内培养。细胞贴壁后实验组加入PDTC处理细胞,对照组加入磷酸盐缓冲液。各组分别培养24h后,每孔加入浓度为5mg/mL的 MTT 20μL继续培养4h,小心吸弃孔内液体,加入150μL二甲亚砜,酶标仪A490 nm测定各孔OD值。
1.2.3 Hep-2细胞凋亡的流式细胞术检测 50、100μmol/L组处理细胞24h后,0.125%的胰蛋白酶消化后离心,将细胞转入流式管,用结合缓冲液重悬细胞至5×105/mL,取195 μL,加入FITC标记的Annexin-V 5μL,室温避光反应约10 min,离心后用190μL结合缓冲液重悬细胞,再加入浓度为50 μg/mL的PI 10μL,避光反应5min后,加入200μL缓冲液,立即用FACScan进行流式细胞术定量检测。对照组不加任何试剂。
1.2.4 RT-PCR 检测 Bcl-xL 及 XIAP的 表达 对 照 组、50 μmol/L组,100μmol/L组的 Hep-2细胞接种于6孔板。处理细胞12h后,用Trizol法提取细胞总mRNA,逆转录试剂盒转为cDNA。引物采用Primer 5软件设计,引物由上海生工生物工程有限公司合成,Bcl-xL 引物上游序列:5′-GTG GCC GGC GTG GTT-3′,下游序列:5′-GAG GGT AGA GTG GAT GGT CAG TGT-3′;XIAP 引物上游序列:5′-TTT TTC CCC TGT CCC TTT GA-3′,下游序列:5′-ACA CAG GGC CAA ATC ACA TTA TAT AC-3′。RT-PCR反应条件为预变性95℃3 min;变性95℃10s;退火60℃30s;返回95℃10s,扩增39个循环;65~95℃,每0.5℃5s梯度递增;终止反应。采用荧光定量PCR分析软件Bio-Rad CFX manager分析结果。
1.2.5 p-IκB、Bcl-xL及 XIAP的蛋白表达的 Western-blot检测 3组细胞处理12h后,分别加入适量的RIPA细胞裂解液于冰上裂解细胞,提取总蛋白。按照碧云天公司BCA试剂盒进行蛋白定量。取50μg蛋白进行聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)分离,浓缩胶电压60V,分离胶电压80V。电泳结束后转膜至聚偏二氟乙烯膜。5%脱脂奶粉封闭后,加入一抗p-IκB、Bcl-xL及XIAP(抗体稀释度为1∶500),内参为 GAPDH(抗体稀释度为1∶500),置4℃冰箱内过夜,复温后用TBST洗膜,加入二抗为辣根过氧化物(horseradish peroxidase,HRP)标记的羊抗兔IgG(抗体稀释度为1∶1 000)孵育1.5h。电化学发光(electrochemiluminescence,ECL)试剂盒检测信号,凝胶成像仪采集图像,结果采用Quantity One软件进行条带灰度分析,实验重复3次。
1.2.6 统计学处理 采用SPSS11.5统计软件进行数据分析,计量资料以表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 PDTC对 Hep-2细胞的生长抑制作用 PDTC对50 μmol/L组和100μmol/L组的 Hep-2细胞生长抑制与对照组比较,差异有统计学意义,PDTC的浓度越大,抑制效果越明显(P<0.05),见表1。

表1 3组Hep-2细胞增殖的MTT法检测结果比较
2.2 PDTC对Hep-2细胞凋亡的影响 流式细胞术结果见图1。Hep-2细胞经 PDTC处理24h后,50μmol/L组和100 μmol/L组细胞凋亡率分别 为 (25.1±2.18)% 和 (35.4±2.62)%,与对照组(3.12±1.07)%比较,差异有统计学意义(P<0.05)。
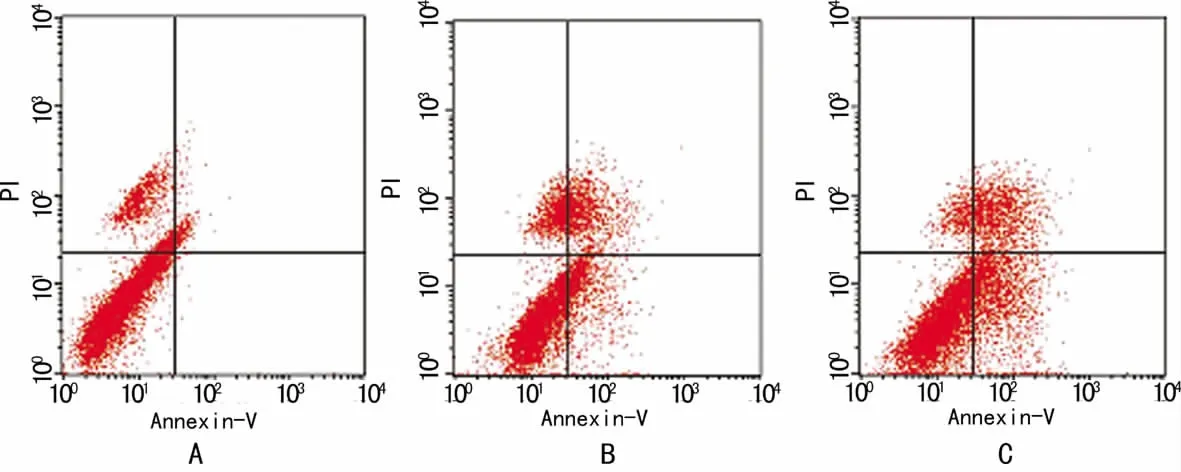
图1 3组Hep-2细胞凋亡的流式细胞术检测
表2 3组Hep-2细胞Bcl-xL及XIAP的mRNA表达水平比较
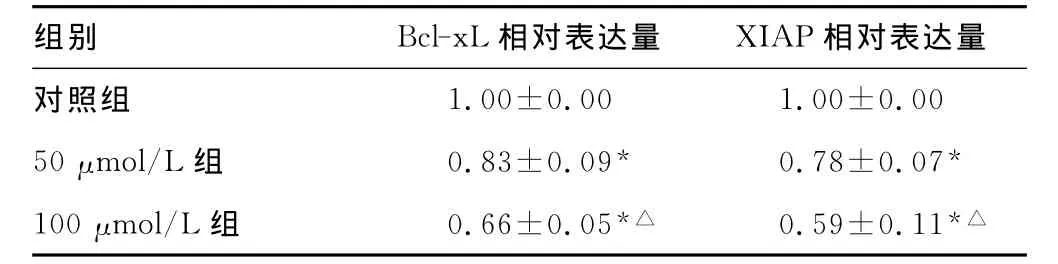
表2 3组Hep-2细胞Bcl-xL及XIAP的mRNA表达水平比较
*:P<0.05,与对照组比较;△:P<0.05,与50μmol/L组比较。
组别 Bcl-xL相对表达量 XIAP 1.00±0.00 1.00±0.00 50μmol/L组 0.83±0.09* 0.78±0.07*100μmol/L组 0.66±0.05*△ 0.59±0.11相对表达量对照组*△
2.3 PDTC对 Hep-2细胞的Bcl-xL及XIAP的 mRNA表达的影响 50μmol/L组和100μmol/L组Bcl-xL mRNA与XIAP mRNA表达比对照组低(P<0.05)。100μmol/L PDTC比50μmol/L PDTC作用更为明显(P<0.05),见表2。
2.4 PDTC对 Hep-2细胞的p-IκB、Bcl-xL及 XIAP的蛋白表达的影响 Western-blot结果见图2。50μmiol/L组和100 μmol/L组p-IκB、Bcl-xL与 XIAP蛋白表达比对照组低(P<0.05)。
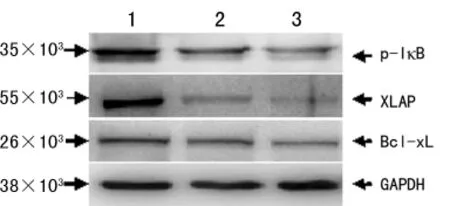
图2 3组 Hep-2细胞p-IκB、Bcl-xL与 XIAP蛋白的表达
3 讨 论
IKK/NF-κB信号通路被证实在多种肿瘤中异常激活,促进肿瘤细胞增殖、抗凋亡、转移侵袭、血管生成和炎症反应等[5]。经典的IKK/NF-κB信号通路途径[6]主要影响的是 NF-κB家族中的RELA和p50成员,无刺激信号时胞质中RelA:p50与抑制因子IκB结合而处于静止状态,当刺激信号出现时胞质中IκB激酶(IκB kinase complex,IKK)激活使与RelA:p50结合的IκB磷酸化激活而从三聚体脱落降解,RelA:p50二聚体则进入核内启动或增强相关靶基因转录。Hideshima等[7]通过IκB抑制剂阻断NF-κB信号通路,发现能够降低IGF-1H和IL-6的分泌,抑制多发性骨髓瘤细胞在体内外的生长和增殖。通过抑制肿瘤细胞增殖促进凋亡发生已经成为目前肿瘤的研究和治疗中重要的策略[8]。
PTDC是一种抗氧化剂,为NF-κB的特异性抑制剂,其功能一方面能够阻止NF-κB亚基p65的激活,另一方面可通过抑制IκB的降解而减少NF-κB的核转位,从而阻断IKK/NF-κB信号通路的激活[9]。Liu等[10]研究发现,PDTC能抑制卵巢癌细胞的增殖,减少促炎性细胞因子的分泌,促进凋亡的发生。但其对喉癌细胞的影响的研究还鲜有报道。本实验通过MTT实验显示随PDTC药物浓度的增加,喉癌细胞的增殖水平明显下降。RT-PCR及 Western-blot结果显示PDTC处理Hep-2细胞后,p-IκB表达水平降低,表明 PDTC 能够阻断IκB的活化。
Bcl-xL可阻断Bax对线粒体外膜的破坏而发挥抗凋亡的作用,还可干扰抑制Caspase-3和Caspase-8的活性、维持线粒体膜电位水平和控制活性氧的毒性而在细胞内发挥抗凋亡作用[11]。有研 究 显 示,Bcl-xL 在 喉 癌 中 存 在 高 表 达[12],Wang等[13]通过多基因联合RNAi技术沉默Bcl-xL基因后,Hoechst染色和电子显微镜观察喉癌Hep-2细胞的凋亡增加,增殖水平明显下降。NF-κB介导的抗凋亡作用实质上是依赖于增强凋亡抑制基因的转录实现的,最具代表性的基因如XIAP、cIAP1、Bcl-xL等能有效阻止细胞凋亡。XIAP不仅能抑制Caspase-3和Caspase-7还能抑制促凋亡蛋白JUN的激活[14]。XIAP在喉鳞状细胞癌中相对于正常组织明显升高,与喉癌的临床分期和病理学分期明显相关[15]。沉默p65基因能够明显抑制XIAP及cIAP1等蛋白的表达[14]。本实验发现,PDTC处理Hep-2细胞后,细胞凋亡率增加,XIAP mRNA和蛋白表达水平下降,表明通过抑制IκB的激活能够降低XIAP的表达。
综上所述,通过PDTC处理人喉癌Hep-2细胞后,细胞增殖水平明显受到抑制,流式细胞术显示细胞凋亡增加,RTPCR及 Western-blot结果显示细胞IκB磷酸化激活减少,BclxL、XIAP mRNA及蛋白表达水平降低。显示PDTC能够通过阻断IκB的活化,降低与抗凋亡相关基因Bcl-xL及XIAP的表达从而抑制增殖促进凋亡,喉癌细胞凋亡增加可能与NF-κB信号转导通路的阻断有关。针对NF-κB信号通路的治疗策略可能会给喉癌的治疗提供新的思路和治疗靶点。
[1] 吕茵,郑航,王全师,等.F-FDG PET/CT对喉癌的诊断价值[J].南方医科大学学报,2012,32(10):1486-1490.
[2] 苏剑东,吴灵飞.NF-κB与细胞凋亡[J].世界华人消化杂志,2007,15(12):1411-1416.
[3] 史艳晖,卢圣栋.转录因子NF-κB的研究现状及其应用前景[J].中国生物工程杂志,2007,27(4):110-114.
[4] 毛拓华,李竞,刘梦江,等.抑制NF-κB对糖尿病大鼠肾组织ICAM-1表达的影响[J].中国中西医结合肾病杂志,2009,10(8):688-691.
[5]Jost PJ,Ruland J.Aberrant NF-kappaB signaling in lymphoma:mechanisms,consequences,and therapeutic implications[J].Blood,2007,109(7):2700-2707.
[6] Didonato JA,Mercurio F,Karin M.NF-κB and the link between inflammation and cancer[J].Immunol Rev,2012,246(1):379-400.
[7] Hideshima T,Neri P,Tassone P,et al.MLN120B,a novel IkappaB kinase beta inhibitor,blocks multiple myeloma cell growth in vitro and in vivo[J].Clin Cancer Res,2006,12(19):5887-5894.
[8]Indran IR,Tufo G,Pervaiz S,et al.Recent advances in apoptosis,mitochondria and drug resistance in cancer cells[J].Biochim Biophys Acta,2011,1807(6):735-745.
[9] 杨季云,张思仲,郭红.肿瘤坏死因子α通过激活NF-κB信号通路加快肝细胞周期进程[J].生物化学与生物物理进展,2007,34(6):604-610.
[10]Liu GH,Wang SR,Wang B,et al.Inhibition of nuclear factor-kappaB by an antioxidant enhances paclitaxel sensitivity in ovarian carcinoma cell line[J].Int J Gynecol Cancer,2006,16(5):1777-1782.
[11]Akazawa Y,Cazanave S,Mott JL,et al.Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis[J].J Hepatol,2010,52(4):586-593.
[12]陈始明,王燕,肖伯奎,等.同时抑制 VEGF、hTERT和Bcl-xl表达对喉癌细胞生长增殖的影响[J].肿瘤防治研究,2009,36(12):991-995.
[13]Wang Y,Tao ZZ,Chen SM,et al.Application of combination of short hairpin RNA segments for silencing VEGF,TERT and Bcl-xl expression in laryngeal squamous carcinoma[J].Cancer Biol Ther,2008,7(6):896-901.
[14]Meng Z,Lou S,Tan J,et al.Nuclear factor-kappa B inhibition can enhance apoptosis of differentiated thyroid cancer cells induced by 131I[J].PLoS One,2012,7(3):e33597.
[15]Li X,Ma X,Lu X,et al.Expression of inhibitor of apoptosis protein XIAP in laryngeal carcinoma and its clinicopathological significance[J].Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2007,21(21):973-975.
