泛耐药铜绿假单胞菌的毒力基因检测和同源性分析
2013-08-23陈惠玲叶惠芬杨英为杨一言黄小媛杨银梅
陈惠玲,盛 慧,叶惠芬,杨英为,杨一言,黄小媛,杨银梅
铜绿假单胞菌是医院感染的重要病原菌,其致感染机制是通过Ⅲ型分泌系统(typeⅢsecretion system,T3SS),以其效应蛋白ExoU为主的毒力蛋白表达,可导致肺泡上皮细胞、巨噬细胞和成纤维细胞的凋亡,加重炎性反应,增高感染病死率[1]。携带毒力基因的泛耐药铜绿假单胞菌,给临床铜绿假单胞菌感染的治疗带来了极大挑战。因此,本研究对53株临床分离的泛耐药铜绿假单胞菌进行毒力基因exoU和exoS检测,并采用BOX-PCR指纹图谱分析技术对医院感染的泛耐药铜绿假单胞菌进行同源性分析,为医院感染的控制与管理提供基因分型的病原学资料,为临床抗感染治疗提供依据。
材料与方法
一、材料
(一)菌株来源及分布 53株泛耐药铜绿假单胞菌分离自2008年9月—2012年6月广州市第一民医院医院感染患者的各种临床标本,剔除同一患者相同部位在1周内检出的重复菌株。其中纤维支气管镜吸痰标本42株,伤口分泌物和中段尿标本各3株,静脉血标本2株,腹水、脓液和胆汁各1株。菌株主要分布于重症监护病房27株,呼吸内科11株,综合病科7株,急诊留观病区和脑系外科各2株,血液内科、烧伤外科、胃肠外科和鹤洞分院内科各1株。
(二)仪器与试剂 VITEK2系统及API20E试剂均为法国生物梅里埃公司产品;PCR仪为美国PE公司产品;电泳仪为美国BIO-RAD公司产品;成像系统为英国UVI凝胶成像系统;引物由上海英骏生物技术有限公司合成;Premix Taq酶(Code No.:D334A)体系及 DNA Marker DL2000购自大连宝生物工程有限公司。
二、方法
(一)细菌鉴定及药物敏感试验 采用常规方法分离细菌,用API 20NE或法国生物梅里埃公司VITEK2系统进行菌种鉴定且进行药物敏感试验,结果参照CLSI 2009年版标准判读[2]。质控菌株为大肠埃希菌 ATCC 25922、铜绿假单胞菌 ATCC 27853。
(二)统计学处理 数据采用WHONET5.6软件进行统计分析。
(三)细菌DNA的提取 采用煮沸法提取细菌总DNA,挑取一定量纯培养菌落加入含适量蒸馏水的 EP管中,混匀后加热煮沸,10 000 r/min冷冻离心2 min。另取1.5 mL的EP管,将离心后的上清液吸入新的EP管中,上清液即为细菌总DNA溶液,保存于-20℃冰箱中备用。
(四)PCR检测 毒力基因exoS和exoU采用PCR法检测,Premix Taq酶体系25μL,上下游引物各10 pmol,模板DNA4μL,用ddH2O补足至50μL。循环参数为,94℃预变性5 min,94℃变性30 s,62℃退火30 s,72 ℃延伸1 min,共35个循环,最后于72℃延伸10 min。取8μL PCR产物在2%琼脂糖凝胶进行电泳分析,采用凝胶成像系统观察并记录结果。毒力基因引物序列和目的产物长度见表1。
(五)BOX-PCR检测携带相关毒力基因菌株同源性 BOX-PCR引物BoxAR1序列为5′-CTACGGCAAGGCGACGCTGACG-3′[3]。BOX-PCR 反应体系总体积为25μL,包括 Premix Taq 12.5μL、DNA模板1μL、引物1μL、灭菌蒸馏水补足至25μL。反应条件:94℃预变性3 min,94℃变性45 s,50℃退火45 s,72 ℃延伸1 min,共35个循环,最后于72℃延伸7 min。取8μL PCR产物,加2μL溴酚蓝于80V电压,2%琼脂糖凝胶进行电泳1 h后,0.5 mg/L溴乙锭溶液染色成像,采用凝胶成像系统观察并记录结果。应用Quantity one软件中的非加权配对算数平均法(UPGMA)构建聚类分析图,把相似度大于80%菌株划分为同一个基因型,代表同一克隆株,相似度小于80%菌株为不同的基因型,代表不同的克隆株。
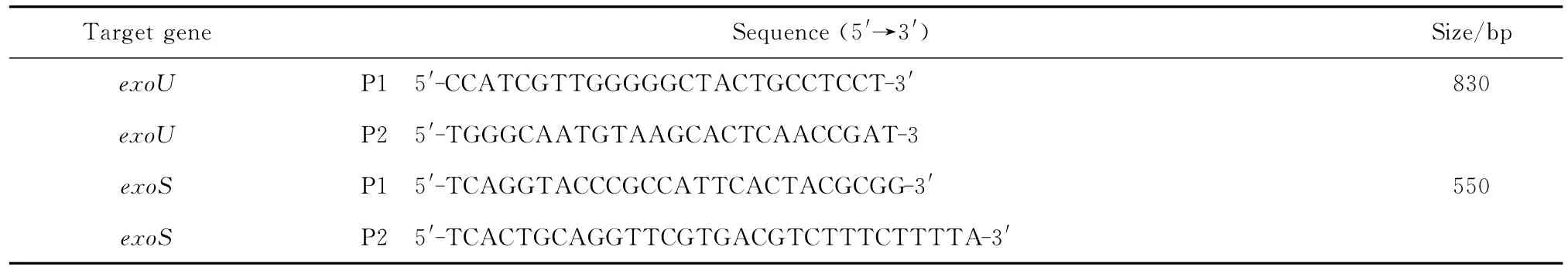
表1 检测铜绿假单胞菌毒力基因exo U和exo S的引物Table 1 Sequence of the primers used for PCR amplification of virulence genes exoUand exoSin Pseudomonas aeruginosa
结 果
一、药敏试验
53株铜绿假单胞菌对抗菌药物阿米卡星、头孢他啶、头孢曲松、环丙沙星、庆大霉素、亚胺培南、妥布霉素、头孢吡肟、左氧氟沙星、甲氧苄啶-磺胺甲口恶唑、哌拉西林-他唑巴坦、氨曲南均耐药。
二、菌株毒力基因exoS和exoU检测
电泳结果显示,53株泛耐药铜绿假单胞菌中,41株菌毒力基因exo S阳性,11株菌毒力基因exo U阳性。根据检测结果统计,其中40株为exo S+/exo U-表型,占75.5%;10株为exo U+/exo S-表型,占18.9%;1株为exo S+/exo U+表型,占1.9%;2株为exo S-/exo U-表型,占3.8%。exo S+/exo U-和exo U+/exo S-型主要分布在重症监护病房,分别为16株(16/40,40%)和8株(8/10,80%)。
三、携带相关毒力基因菌株同源性比较
部分BOX-PCR扩增产物电泳图谱见图1。BOX-PCR和聚类图软件分析显示,11株exoU+的菌株可划分为7个基因型,分别命名为U1~U7,41株exoS+的菌株可划分为24个基因型,分别命名为S1~S24。其中主要的基因型有U7、S12、S14、S22和S24型,见表2。U7型克隆3株,来源于2个不同的科室;S12和S14型克隆各3株,S22型克隆4株,均分别来源于3个不同的科室;S24型克隆4株,来源于呼吸内科,其余均为独立的基因型。
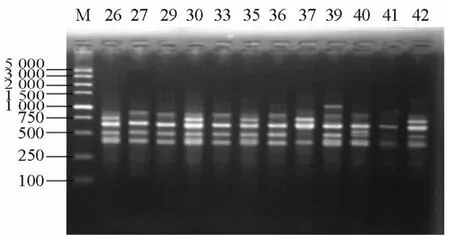
图1 泛耐药铜绿假单胞菌部分扩增产物电泳图Figure 1 Electrophoretic result of BOX-PCR in some pandrug-resistant Pseudomonas aeruginose strains
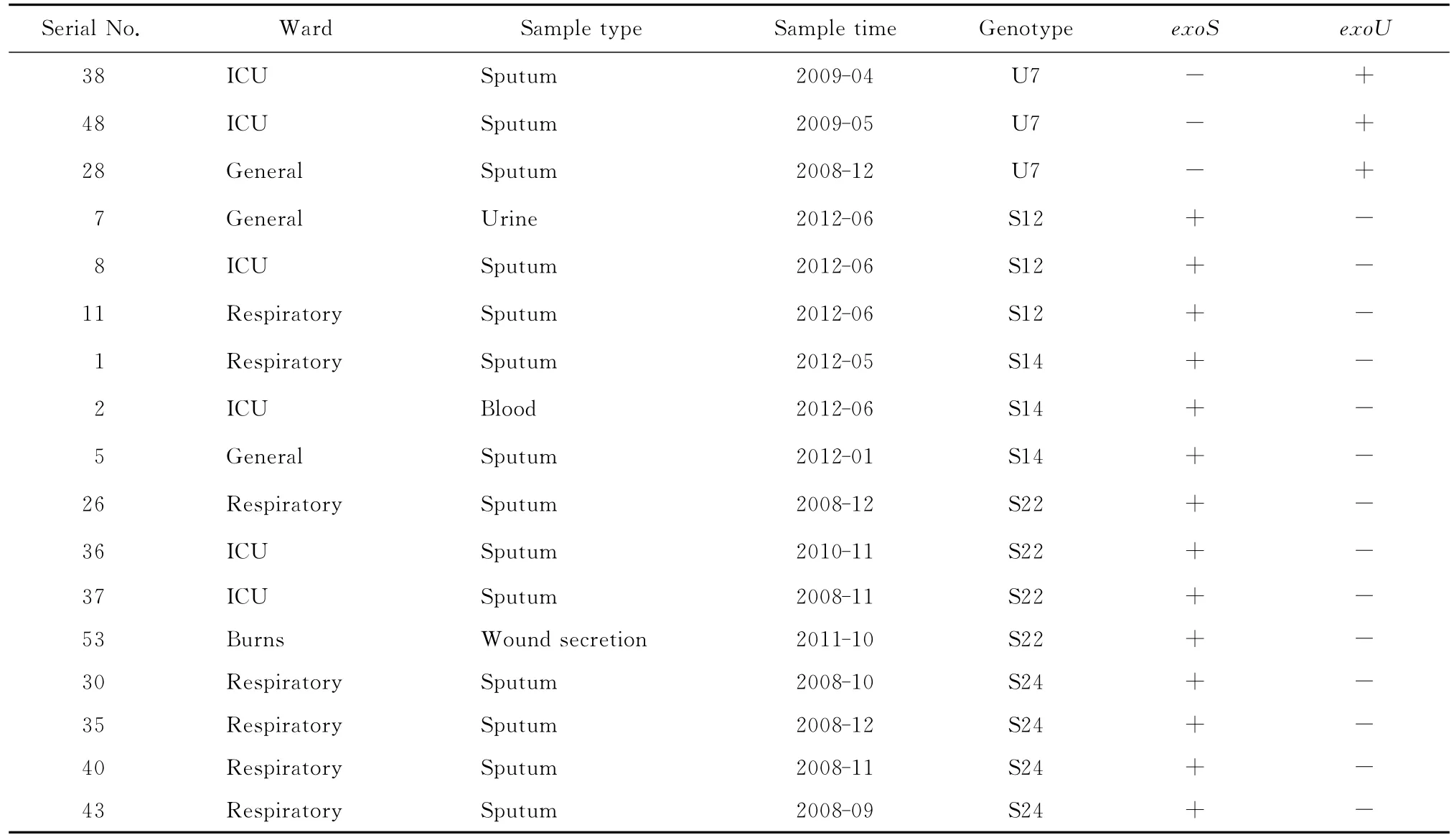
表2 泛耐药铜绿假单胞菌BOX-PCR主要基因型的科室及毒力基因分布Table 2 Distribution of the BOX-PCR-based virulence genotypes of pandrug-resistant Pseudomonas aeruginosain different wards
讨 论
铜绿假单胞菌是医院感染的重要病原菌,常呈多重耐药或泛耐药,治疗棘手,病死率高,可造成一定程度的医院感染流行[4-5],因此泛耐药铜绿假单胞菌为医院感染的主要监控对象。自1996年我国台湾地区分离到第1株泛耐药铜绿假单胞菌以来,世界上多个地区陆续有泛耐药铜绿假单胞菌的报道[5],我院3年多分离到53株泛耐药铜绿假单胞菌,主要分布在重症监护病房和呼吸内科,与这2个科室常年收治大量需机械通气的危重患者,且大部分患者有严重的基础疾病,免疫功能低下,频繁使用留置导管等侵袭性操作有关。
T3SS是铜绿假单胞菌致病性的重要毒力系统,其中exoS和exoU的临床意义尤为重要,Hauser等[6]研究显示,exoU+为细胞毒型基因,表达蛋白ExoU引起细胞坏死、凋亡,危害最大;exo S+为侵袭型基因,表达蛋白exoS能抑制宿主细胞吞噬作用、破坏肌动蛋白细胞骨架重排、导致细胞凋亡和抑制细胞分裂等,感染相对较轻;exoU+基因型的铜绿假单胞菌毒力更强,感染后症状更严重,患者病死率更高;T3SS阳性铜绿假单胞菌常以exo S+/exo U-和exo U+/exo S-基因型存在。本研究结果显示,53株泛耐药铜绿假单胞菌中,exo S+/exo U-基因型菌40株,占75.5%;exo U+/exo S-基因型菌10株,占18.9%,与卓超等[7]报道相似。另有1株为exo S+/exo U+表型,2株为exo S-/exo U-表型。携带毒力基因的铜绿假单胞菌主要分布在重症监护病房,以exo S+/exo U-和exo U+/exo S-基因型为主,且在重症监护病房exo U+/exo S-基因型菌株的分离株为8株(8/10),明显高于分离率为40%(16/40)的exo S+/exo U-基因型。因此,对于携带毒力基因的泛耐药铜绿假单胞菌,更应加强监控,防止医院感染暴发流行。
BOX插入因子为细菌基因组重复序列,大小为154 bp,由保守性不同的box A、box B和boxC等亚单位组成,其中只有box A存在细菌菌株、种、属水平的分布差异及进化过程中表现出多拷贝和高保守性,BOX-PCR技术则根据box A亚单位设计引物,使重复序列之间的不同基因区域得以选择性扩增,得到大小不等的DNA扩增片段,最后经琼脂糖凝胶电泳检测其多态性[3,8]。
BOX-PCR结果显示,exoU+菌株中,3株U7型克隆株来源于2个不同的科室,结合临床资料,3株菌分离的时间相差较远,可排除该克隆株的院内暴发流行。exoS+菌株中,4株S24型克隆株均来源于呼吸内科,虽是同年不同月份分离,仍提示S24型克隆株在呼吸内科存在流行。因此,应严格进行消毒隔离,以避免该克隆株在科室,甚至医院发生暴发流行。S12、S14型克隆各3株,S22型克隆4株,均来源于3个不同科室,且S14和S22型克隆株分离的时间相隔较远,故不存在这2型克隆株的院内暴发流行,而S12型克隆株在同1个月发现,说明其在医院内存在小规模的流行。抗菌药物的大量使用是导致泛耐药铜绿假单胞菌形成的主要原因,机械通气等频繁应用的侵袭性治疗手段容易因消毒不严格而导致泛耐药铜绿假单胞菌的传播,入住重症监护病房时间过长患者因病情严重,需接受更多的抗菌药物及侵袭性治疗措施,也易受泛耐药铜绿假单胞菌感染[5,9]。3株S12型克隆株分别来源于重症监护病房、综合病科和呼吸内科,提示这些科室应加强医院感染的控制,合理应用抗菌药物,隔离感染的患者,加强医护人员手卫生和其他消毒隔离措施,并用BOX-PCR技术对泛耐药铜绿假单胞菌感染进行实时监测,以防止暴发流行。
[1] Hauser AR.The Type III secretion System of Pseudomonas aeruginosa:infection by injection[J].Nat Rev Microbiol,2009,7(9):654-665.
[2] Clinical and Laboratory Standards Institute.Performance standards for Antimicrobial Susceptibility Testing[S].19th Informational Supplement,2009,M100-S19.
[3] Coenye T,Spilker T,Martin A,et al.Comparative assessment of genotyping methods for epidemiologic study of Burkholderia cepacia genomovar III[J].J Clin Microbiol,2002,40(9):3300-3307.
[4] 赵祝香,陈惠玲,魏树全,等.多药耐药铜绿假单胞菌耐药性及相关耐药基因分析[J].中国实验诊断学,2011,16(17):1159-1162.
[5] 魏树全,赵子文,钟维农,等.泛耐药铜绿假单胞菌肺炎危险因素的病例对照研究[J].中华医院感染学杂志,2009,19(6):673-676.
[6] Hauser AR,Engel JN.Pseudomonas aeruginosainduces type-Ⅲ-secretion-mediated apoptosis of macrophages and epithelial cells[J].Infect Immune,1999,67(10):5530-5537.
[7] 卓超,王露霞,肖书念,等.铜绿假单胞菌Ⅲ型分泌系统相关毒力基因的临床意义[J].中华烧伤杂志,2010,26(5):354-359.
[8] Versalovic J,Koeuth T,Lupski JR,et al.Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes[J].Nucleic Acids Res,1991,19(24):6823-6831.
[9] 杨亚敏,李强,阚志超,等.泛耐药菌预防与治疗研究进展[J].中华医院感染学杂志,2010,20(7):1042-1044.
