水合硅铝酸钠钙对生长肥育猪生长性能、养分表观消化率及抗氧化能力的影响
2013-08-22赵珩伊毛湘冰黄志清韩国全陈代文
赵珩伊 余 冰 毛湘冰 何 军 郑 萍 黄志清 韩国全 虞 洁 陈代文
(四川农业大学动物营养研究所,动物抗病营养农业部重点实验室,雅安625014)
饲料中的霉菌毒素污染是困扰全球饲料生产厂家的一个重大问题。据调查显示,世界上至少有25%的谷物受到霉菌毒素污染[1]。在我国,饲料和原料霉菌毒素超标的比例高达60%~70%[2]。动物的霉菌毒素中毒会降低其生长性能,抑制免疫机制,影响机体的健康,进而带来巨大的经济损失。因此,人们尝试用多种方法(如化学法、物理分离法、放射法和热失活法)来消除饲料霉菌毒素的毒性,但这些方法均难在实际生产中应用。而饲粮中添加霉菌毒素吸附剂,如水合硅铝酸钠钙(hydrated sodium calcium aluminosilicates,HSCAS),是降低霉菌毒素危害的有效手段[3]。目前,以HSCAS为主要成分的霉菌毒素吸附剂作为美国食品药品监督管理局(FDA)首次批准的吸附剂产品,被最先用于饲料行业当中。HSCAS之所以可以吸附霉菌毒素,主要源于其是一种层状硅铝酸盐,利用其四面体-八面体-四面体层间多空结构与表面形成的离子极性,强吸附同样具有离子极性的霉菌毒素。但是,HSCAS是一种缺乏正电荷的层状硅铝酸盐,有吸附富余正电荷或阳离子化合物的潜在可能。已有关于绵羊和雏鸡的研究均表明,在HSCAS高效吸附饲粮中霉菌毒素的同时,也会对某些维生素和矿物元素进行吸附[4-5]。目前,对 HSCAS的研究主要集中于其对饲料中霉菌毒素(特别是黄曲霉毒素)的吸附作用,但未见在正常饲粮(未添加霉菌毒素)中添加HSCAS对猪的安全性研究。因此,本试验以生长育肥猪为研究对象,旨在研究在饲粮中添加不同水平的HSCAS对生长育肥猪上生长性能、养分表观消化率及抗氧化能力的影响。
1 材料与方法
1.1 试验材料
HSCAS购于美国密尔白有限公司,有效成分含量95%以上。推荐用量为每吨饲粮中添加2.5kg。
1.2 试验动物及试验设计
本试验采用单因子试验设计,选用(48.0±10.0)kg的健康“杜×长×大”生长猪45头,按体重相近、各处理公母比例一致原则,随机分为3个处理,每个处理5个重复,每个重复3头猪。对照组饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加0.25%和2.50%HSCAS的饲粮。试验分为48~80kg(前期)和81~110kg(后期)2阶段进行,试验期为70d,至猪体重达110kg左右结束。
1.3 试验饲粮
试验饲粮参照NRC(1998)猪营养需要配制,基础饲粮为玉米-豆粕型,按试验设计分别以相应剂量的HSCAS替换配方中的统糠配成试验饲粮。基础饲粮组成及营养水平见表1。
1.4 饲养管理
试验在四川农业大学动物营养研究所教学科研试验基地进行。试验期间猪舍温度控制在25℃左右,自由采食和饮水,每日饲喂3次(08:00、12:00、18:00),少喂勤添,添加量以料槽内略有余料为准。保持圈舍通风、卫生、干燥,每天结算余料,并做好采食量记录。
1.5 样品采集与处理
1.5.1 饲料样品的采集与处理
各处理饲料混合均匀后,多处均匀取样。将同一处理的饲料再混合,粉碎后过40目筛,-20℃保存。
1.5.2 粪便样品的采集与处理
于试验第38天和第66天开始,连续4d收集新鲜粪样,准确称重,按每100g粪样滴加10mL 10%的硫酸,另加几滴甲苯防腐,混匀置于-20℃冰箱保存。每期试验结束后,将各处理4d的粪样混匀,按10%的比例取样,在65℃的条件下烘干,回潮24h,粉碎过40目筛,用样品袋密封保存于-20℃待测。
1.5.3 血液样品的采集
于试验的第42天和第70天,各重复选取1头接近平均体重的猪进行前腔静脉采血20mL,低温下静置30min,3 000r/min离心15min,制备血清,于-20℃保存备用。
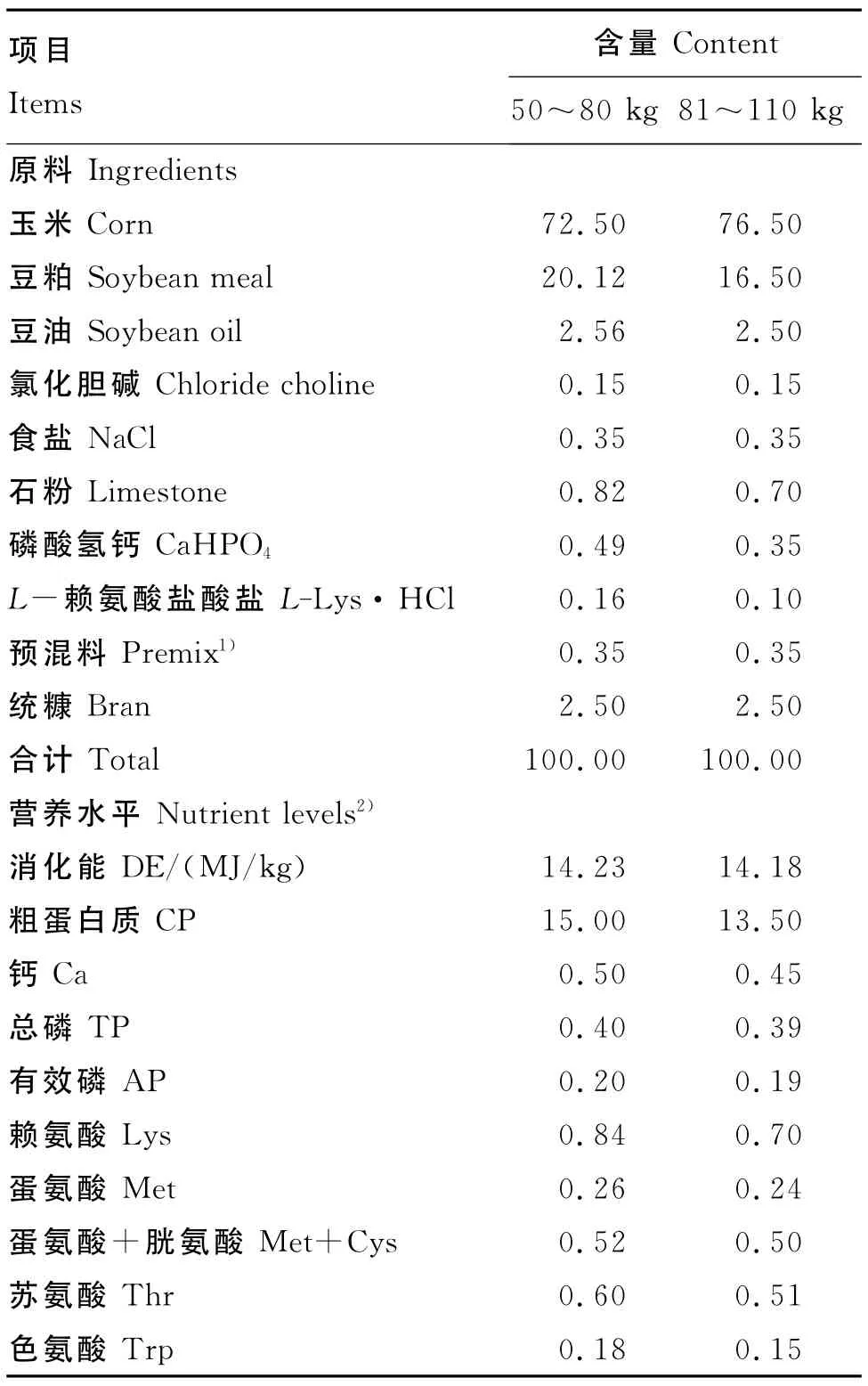
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
1.6 测定指标及方法
1.6.1 生长性能
以重复为单位对初始及试验第42天和第70天猪只进行空腹称重,以重复为单位记录耗料量,计算每阶段及全期平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.6.2 血清尿素氮(urea nitrogen,UN)
血清UN含量采用脲酶法测定[6],试剂盒购于南京建成生物工程研究所。
1.6.3 养分表观消化率
采用4mol/L盐酸不溶灰分内源指示剂法测定养分表观消化率。按照国际官方分析化学家协会(AOAC)的方法测定饲料样品和粪样中粗蛋白质(CP)、粗灰分(Ash)、能量、钙(Ca)和磷(P)的含量,根据食入养分量和排出养分量计算各养分表观消化率。
养分表观消化率(%)=100-[100×(b×c)/(a×d)]。
式中:a为饲料中某养分含量;c为饲料中盐酸不溶灰分含量;b为粪样中某养分含量;d为粪样中盐酸不溶灰分含量。
1.6.4 抗氧化指标的测定
总 抗 氧 化 能 力 (total anti-oxidation capability,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量分别采用比色法、亚硝酸盐法和硫代巴比妥酸(TBA)法[7]进行测定,试剂盒均购于南京建成生物工程研究所。
1.7 数据处理
试验数据采用Excel 2007进行整理,采用SAS 8.2软件的ANOVA程序进行方差分析,结果以平均值±标准差表示,差异显著时进行Duncan氏法多重比较,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 HSCAS对生长育肥猪生长性能和和血清UN含量的影响
由表2可知,与对照组相比,0.25%HSCAS添加组对猪各阶段的ADFI、ADG、F/G和血清UN含量均无显著影响(P>0.05),但2.50%HSCAS添加组显著提高了后期和全期的F/G(P<0.05),前期和后期血清UN含量分别显著提高了17.06%和19.46%(P<0.05)。
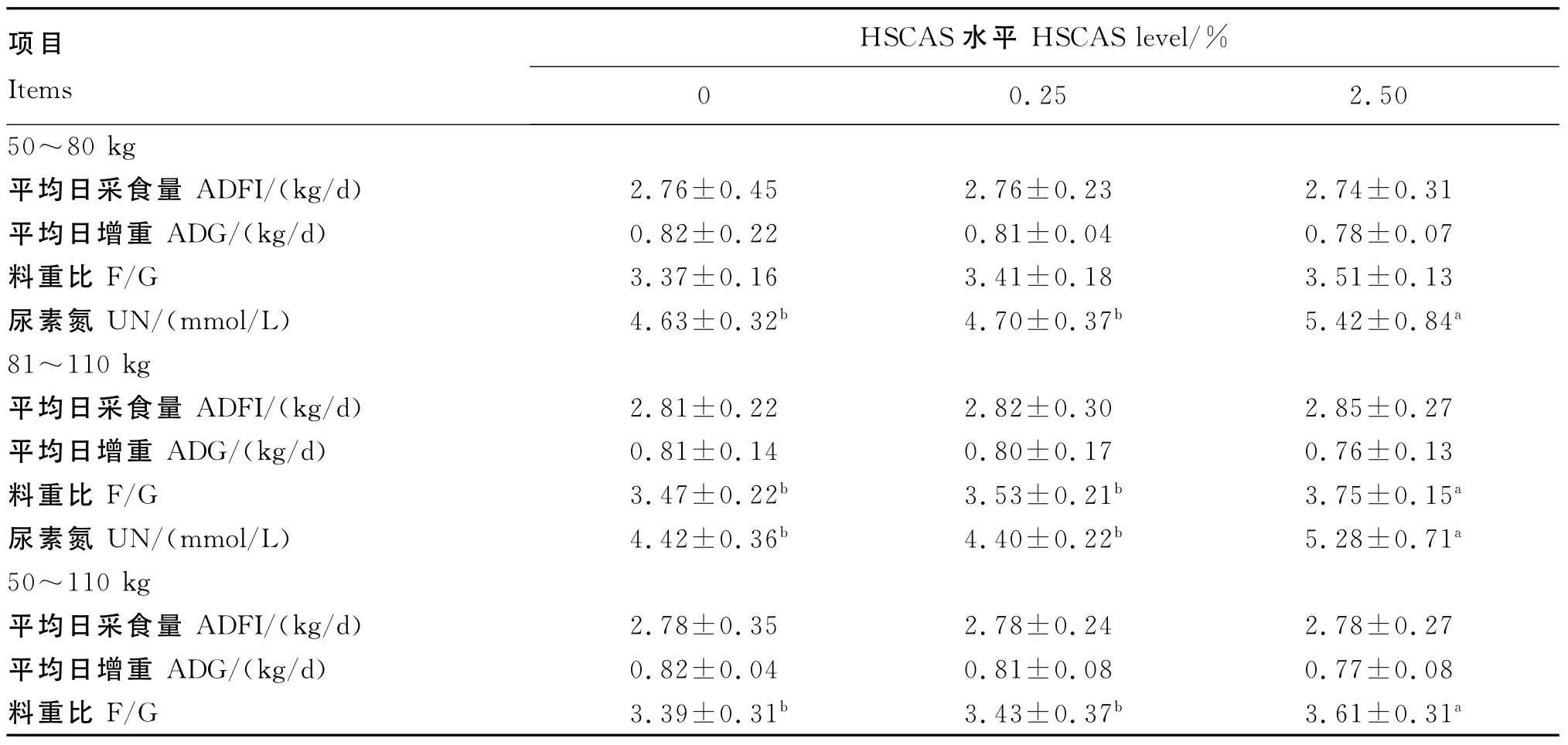
表2 HSCAS对生长育肥猪生长性能和血清UN含量的影响Table 2 Effects of HSCAS on growth performance and serum UN content of growing-finishing pigs
2.2 HSCAS对生长育肥猪养分表观消化率的影响
由表3可知,在试验前期,各处理CP、能量、Ca和P的表观消化率均无显著差异(P>0.05);与对照组相比,0.25%HSCAS添加组Ash的表观消化率无显著差异(P>0.05),但2.50%HSCAS添加组Ash的表观消化率显著降低了29.57%(P<0.05)。 在 试 验 后 期,0.25% 和 2.50%HSCAS添加组CP的表观消化率分别比对照组显著降低了3.16%和6.23%(P<0.05),能量的表观消化率分别比对照组显著降低了1.53%和1.55%(P<0.05);Ash的表观消化率与第1阶段规律一致。各阶段不同处理猪的Ca、P表观消化率均无显著差异(P>0.05)。
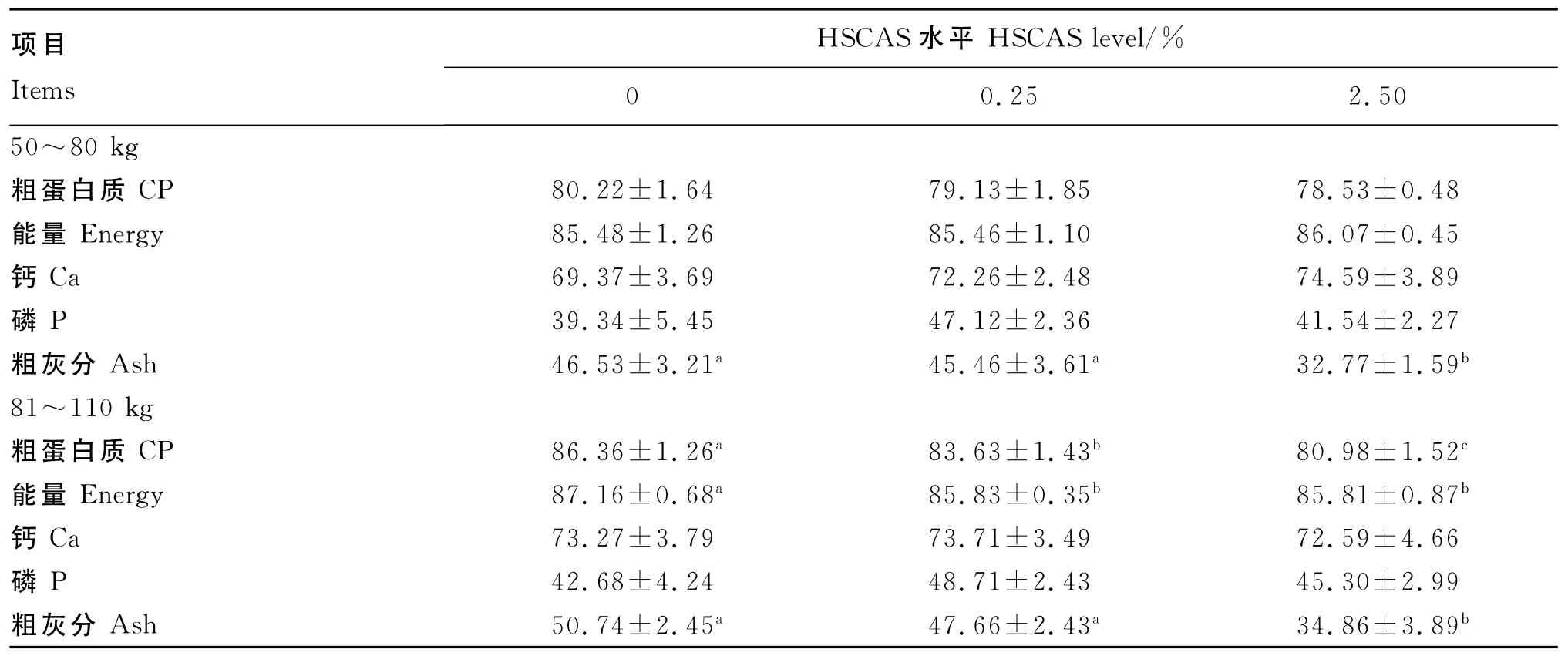
表3 HSCAS对生长育肥猪养分表观消化率的影响Table 3 Effects of HSCAS on nutrient apparent digestibility of growing-finishing pigs
2.3 HSCAS对生长育肥猪抗氧化能力的影响
由表4可知,随着HSCAS添加水平的增加,试验前期血清T-AOC和SOD活性均有所下降(P>0.05),MDA 含量有所升高(P>0.05)。试验后期呈相同规律,且2.50%HSCAS添加组血清MDA含量比0.25%HSCAS添加组显著提高了55.85%(P<0.05),血清 T-AOC分别比对照组和0.25%HSCAS添加组显著降低了30.73%和26.11%(P<0.05),SOD活性分别比对照组和0.25%HSCAS添加组降低了12.78%(P<0.05)和7.27%(P>0.05)。

表4 HSCAS对生长育肥猪抗氧化能力的影响Table 4 Effects of HSCAS on antioxidant ability of growing-finishing pigs
3 讨 论
3.1 HSCAS对生长育肥猪生长性能的影响
本试验中,与对照组相比,饲粮中添加0.25%HSCAS对生长育肥猪生长性能无显著影响,但当饲粮中添加2.50%HSCAS时,生长育肥猪F/G显著提高。徐军等[8]发现,通过在肉仔鸡饲粮中添加3和5g/kg的蒙脱石(主要成分为HSCAS)有提高鸡的ADFI和ADG的趋势,但对F/G无影响;Gowda等[9]指出,在绵羊饲粮中添加5g/kg的HSCAS对其F/G无显著影响;Ledoux等[10]的研究也发现,在肉仔鸡饲粮中添加1g/kg的HSCAS未影响其生长性能。本试验结果与以上结果不完全一致,这可能主要源于饲粮中吸附剂添加剂量的差异。另外,饲粮中添加2.50%HSCAS导致生长育肥猪生长性能下降,可能是源于过量的HSCAS吸附了饲料中的营养物质,降低了饲料的营养价值和利用率,从而抑制了猪的生长。
UN是蛋白质代谢的主要终末产物,可以在一定程度上反映动物体内蛋白质的代谢状况和氨基酸的平衡状况,氨基酸平衡可降低血清UN含量,提高氮在体内的沉积,饲料中蛋白质利用率提高[11-13]。Abdel-Wahhab等[13]研 究 表 明,在 大 鼠饲粮中添加5g/kg的蒙脱石会显著升高大鼠血清UN含量。而Georgievskii等[14]研究表明,在公猪饲粮中添加3g/kg的HSCAS对其血清UN含量并无显著影响。本试验中,饲粮中添加0.25%HSCAS对生长育肥猪血清UN含量无显著影响,但当HSCAS添加剂量达到2.50%时,生长育肥猪血清UN含量显著升高。以上研究间均存在不同程度的差异,其原因可能与HSCAS添加剂量和试验动物的差异有关。而在本试验中,饲粮中添加2.50%HSCAS显著提高了生长育肥猪的血清UN含量,表明其对饲料中蛋白质的利用率降低,这也可能是饲粮中添加2.50%HSCAS影响生长育肥猪生长性能的原因之一。
3.2 HSCAS对生长育肥猪养分表观消化率的影响
Edwards[15]和Schell等[16]的研究发现,在雏鸡饲粮中添加1%的沸石会显著降低植酸磷在体内的沉积。但 Chestnut等[4]与 Chung等[17]研 究 表明,在绵羊或雏鸡饲粮中添加1%或2%HSCAS时,不会影响其对Ca、P的利用率。本试验发现,在生长育肥猪饲粮中添加0.25%和2.50%HSCAS对其Ca、P的表观消化率无显著影响。上述研究对于饲粮中添加HSCAS影响动物Ca和P的利用率结果之间存在较大的差异,其可能源于HSCAS来源的差异和试验动物种类不同。
本试验的结果也显示,当HSCAS添加剂量达到2.50%时,生长育肥猪对Ash的表观消化率显著 降 低。Chestnut 等[4]、Chung 等[5]与 Gowda等[18]研究均报道,饲粮中添加 HSCAS会削弱动物(如肉鸡、绵羊和奶牛等)对锌的吸收;Gowda等[19]还指出,在羔羊饲粮中添加5g/kg HSCAS会降低机体对微量元素(铜、锌、铁、锰)的吸收。由此可推测,本试验中生长育肥猪对Ash吸收率的下降可能源于其对铜、锌等微量元素消化率下降。另外,本试验中饲粮中添加HSCAS显著降低了生长育肥猪后期CP和能量的表观消化率,且随添加剂量的增加而逐渐降低。这一结果在一定程度反映出饲粮中添加HSCAS影响了生长育肥猪对饲料营养成分的利用率,且与试验中生长育肥猪生长性能和血清UN含量的变化规律基本一致。
3.3 HSCAS对生长育肥猪抗氧化能力的影响
T-AOC是衡量机体抗氧化系统功能状况的综合指标,它的大小可以反映机体抗氧化酶系统(SOD、谷胱甘肽过氧化物酶和过氧化氢酶等)和非酶系统(谷胱甘肽、维生素E、半胱氨酸和葡萄糖等)对外来刺激的代偿能力以及机体自由基代谢的状态[20]。血液中SOD活性和MDA含量是反映机体抗氧化能力的重要指标[21-22]。
目前,对于HSCAS影响动物机体抗氧化能力的研究多集中于饲喂霉菌毒素污染饲料的动物模型中。Che等[23]研究发现,在受霉菌毒素污染的饲粮中添加0.2%HSCAS不能改善由霉菌毒素引起的雏鸡肝脏SOD活性降低以及髓过氧化物歧化酶(MPO)活性升高;而 Gowda等[19]报道,在含黄曲霉毒素的饲粮中添加0.5%HSCAS可以改善肉鸡的抗氧化能力;Abbes等[24]在含玉米赤霉烯酮的小鼠饲粮中添加0.50%HSCAS也取得了相同的效果。在本试验中,生长育肥猪饲粮中添加0.25%HSCAS对其抗氧化能力无显著影响,但HSCAS添加水平达到2.50%时,试验后期生长育肥猪的抗氧化能力显著降低,即T-AOC和SOD活性均显著降低,MDA含量显著升高。这表明长时间饲喂生长育肥猪添加较高剂量HSCAS的正常饲粮会降低机体的抗氧化能力。已有的研究表明,饲粮中铜、锌、锰的水平及利用率均会影响机体的抗氧化能力[25-27]。本研究也发现,饲粮添加较高剂量HSCAS会显著降低生长育肥猪Ash的表观消化率,而Ca、P的表观消化率无显著影响,这表明饲粮添加较高剂量HSCAS可能吸附饲粮中铜、锌、锰等微量元素,引起其利用率下降,这可能是饲粮中较高剂量HSCAS添加导致生长育肥猪抗氧化能力降低的重要原因。另外,由于饲粮中较高剂量HSCAS添加而引起的微量营养物质吸附,也可能会导致肝脏等器官的损伤,这也可能是其影响机体抗氧化能力的原因。
4 结 论
① 饲粮中添加0.25%HSCAS不会影响生长育肥猪的生长性能、机体抗氧化能力和血清UN含量,但降低CP和能量的表观消化率。
② 饲粮中添加2.50%HSCAS会显著降低生长育肥猪的生长性能、养分表观消化率和机体抗氧化能力。
[1] BULLERMAN L B.Occurrence of fusarium and fumonisins on food grains and in foods[J].Advance in Experimental Medicine and Biology,1996,392:27-38.
[2] 王若军,苗朝华,张振雄,等.中国饲料及饲料原料受霉菌毒素污染的调查报告[J].饲料工业,2003,24(7):53-54.
[3] PHILLIPS T D,KUBENA L F,HARVEY R B,et al.Hydrated sodium calcium alumiosilicate:a high-affinity sorbent for aflatoxin[J].Poultry Science,1988,67(2):243-247.
[4] CHESTNUT A B,ANDERSON P D,COCHRAN M A,et al.Effects of hydrated sodium calcium aluminosilicate on fescue toxicosis and mineral absorption[J].Journal of Animal Science,1992,70(9):2838-2846.
[5] CHUNG T K,ERDMAN J W,BAKER D H.Hydrated sodium calcium aluminosilicate:effects on zinc,manganese,vitamin A,and riboflavin utilization[J].Poultry Science,1990,69(8):1364-1370.
[6] 蔡传江,王立贤,赵克斌,等.降低日粮赖氨酸净能比对育肥猪生产性能及肉品质的影响[J].动物营养学报,2010,22(4):856-862.
[7] 李士泽,李玲,高福久,等.谷氨酰胺和L-肉碱对低温下肉羊抗氧化性能的影响[J].营养饲料,2012,48(7):43-46.
[8] 徐军,孙福先,武德义,等.不同剂量蒙脱石对肉鸡早期生产性能的影响[J].黑龙江畜牧兽医,2010,17(9):146-147.
[9] GOWDA N K S,SUGANTHI R U,MALATHI V,et al.Utilization of dietary minerals and blood biochemical values in lambs fed hydrated sodium calcium alumino silicate sorbent material at supplementary level[J].Small Ruminant Research,2007,69(1):17-22.
[10] LEDOUX D R,ROTTINGHAUS G E,BERMUDEZ A J,et al.Efficacy of hydrated sodium calcium alumino silicate to ameliorate the toxic effects of aflatoxin in broiler chichs[J].Poultry Science,1998,78(2):204-210.
[11] 管武太,李德发.血浆蛋白粉改善断奶仔猪生产性能的机理[J].北京农业大学学报,1994,20(4):451-456.
[12] HEITZMAN R J,CHAN K H.Alteration in weight gain and levels of plasma metabolites,proteins,insulin and free fatty acids following implantation of an anabolic steroid in heifers[J].The British Veterinary Journal,1974,130(6):532-537.
[13] ABDEL-WAHHAB M A,NADA S A,KHALIL F A.Physiological and toxicological responses in rats fed aflatoxin-contaminated diet with or without sorbent materials[J].Animal Feed Science and Technology,2002,97(3):209-219.
[14] GEORGIEVSKII V I,ANNEKOV B N.Mineral nutrition of animals[M].Moscow:Kolos publisher,1981.
[15] EDWARDS H M.Effect of dietary calcium,phosphorus,chloride and zeolite on the development of tibial dyschondroplasia[J].Poultry Science,1998,67(10):1436-1446.
[16] SCHELL T C,LINDEMANN M D,KORNEGAY E T,et al.Effects of feeding aflatoxin contaminated diets with and without clay to weanling and growing pigs on performance,liver function and mineral metabolism[J].Journal of Animal Science,1993,71:1209-1218.
[17] CHUNG T K,BAKER D H.Phosphorus utilization in chicks fed hydrated sodium calcium aluminosilicate[J].Journal of Animal Science,1990,68(7):1992-1998.
[18] GOWDA N K S,PRASAD C S.Macro-and micro-nutrient utilization and milk production in crossbred dairy cows fed finger millet and rice straw as dry roughage source[J].Asian-Australasian Journal of Animal Science,2005,18(1):48-53.
[19] GOWDA N K,LEDOUX D R,ROTTINGHAUS G E,et al.Efficacy of turmeric(Curcuma longa),containing a known level of curcumin,and a hydrated sodium calcium aluminosilicate to ameliorate the adverse effects of aflatoxin in broiler chicks[J].Poultry Science,2008,87(6):1125-1130.
[20] 朱莎,张爱婷,代腊,等.饲料铅污染对蛋鸡生产性能、蛋品质以及抗氧化性能的影响[J].动物营养学报,2012,24(3):534-542.
[21] 高建中,黄克和.动物硒量的研究进展[J].畜牧与兽医,2004,36(7):39-41.
[22] MO J,FAN J,GUO Z,et al.A new hypothesis about the relationship between free radical reactions and hemorheological properties in vivo[J].Medical Hypotheses,1993,41:516-520.
[23] CHE Z Q,LIU Y L,WANG H R,et al.The protective effects of different mycotoxin adsorbents against blood and liver pathological changes induced by moldcontaminated feed in broilers[J].Asian-Australasian Journal of Animal Science,2011,24(2):250-257.
[24] ABBES S,OUANES Z,SALAH-ABBES J,et al.The protective effect of hydrated sodium calcium aluminosilicate against haematological,biochemical and pathological changes induced by zearalenone in mice[J].Toxcin,2006,47(5):567-574.
[25] 凌庆枝.超氧化物歧化酶的功能、性质及临床意义[J].生物学通报,1997,32(12):15-16.
[26] 田春美,钟秋平.超氧化物歧化酶的现状研究进展[J].中国热带医学,2006,6(8):1730-1732.
[27] TANG C Z,LIU J P,WEN W Y.Effects of zinc-deficient ration on biochemical and physiological indices and Zn,Cu content of tissues in pigs[J].Chinese Journal of Veterinary Science,1998,27(1):49-55.
