胰岛素对奶牛乳腺上皮细胞酪蛋白合成调节机理的研究
2013-08-22庞学燕王洪荣
田 青 季 昀 庞学燕 王洪荣
(扬州大学动物科学与技术学院,扬州225009)
随着人们生活水平的提高,牛奶已经成为一种饮食中不可或缺的营养丰富的食品。为消费者提供安全优质的奶制品,首先要有安全优质的原料奶,但目前我国的原料奶中乳脂肪和乳蛋白含量普遍低于发达国家10%左右,而我国人均牛奶占有量仅是世界平均水平的1/4[1],因此,提高牛奶产量和改善乳品质迫在眉睫。乳中90%以上的蛋白质是在乳腺中由氨基酸从头合成的,其中酪蛋白约占乳中粗蛋白质总量的80%,它的组成成分(α-酪蛋白、β-酪蛋白、κ-酪蛋白、γ-酪蛋白)对乳品品质有很大的影响。胰岛素(INS)作为机体内唯一降低血糖和唯一同时促进糖原、脂肪、蛋白质合成的激素,对于奶牛乳腺上皮细胞乳蛋白合成的作用也显得异常重要。对于INS的研究前人已经取得了一定的成果,但多以体内研究为主。在调节蛋白质代谢方面,体内研究表明,泌乳早期灌注INS可以增加牛奶产量、牛奶蛋白质总量和酪蛋白含量,与生长激素同时作用效果更好[2],另外,同时补充乳蛋白合成前体物氨基酸时,INS可以显著增加血流量,增加细胞对氨基酸的摄取[3-5],进而促进蛋白质的合成;体外研究表明,INS可以和催乳素(PRL)、生长激素一样直接影响细胞的增殖和激素的分泌,且这种作用与浓度有关[6-7]。INS还可以促进营养重分配,抑制蛋白质的分解,因而有利于生长,糖皮质激素的存在可以促进这种作用,生长激素的促蛋白质合成作用,必须有INS的存在才能表现出来[8-9]。在作用机理方面,就目前研究进展来看,一是血流量调控,二是经过磷脂酰肌醇-3-激酶-雷帕霉素靶蛋白(PI3K-mTOR)信号通路发挥作用[10]。由此可见,INS对哺乳动物生长、泌乳和乳蛋白的合成均具有一定作用,因此,阐明INS对奶牛乳腺上皮细胞乳蛋白合成的作用机理就显得很有必要。
为了了解INS对奶牛乳蛋白合成的影响的作用机理,本研究以奶牛乳腺上皮细胞为模型,研究不同浓度INS对奶牛乳腺上皮细胞中αs1-酪蛋白(CSN1S1)基因、雷帕霉素靶蛋白(mTOR)信号通路及Janus激酶-信号传导和转录活化因子(JAKSTAT)信号通路中相关基因表达的影响,进而得到INS使用的最佳浓度并阐明外源INS对乳蛋白合成的影响及其在奶牛乳腺上皮细胞中促进乳蛋白基因表达的作用机理。研究结果对进一步通过信号通路中关键控制点来调控乳蛋白基因表达及奶牛乳腺乳蛋白的合成的研究有一定的学术意义,同时为在生产中提高奶牛产奶量和改善乳品质提供理论依据。
1 材料与方法
1.1 材料
试剂:INS、PRL、氢化可的松(HYD)(Sigma,美国);DMEM/F12、双抗、胎牛血清(FBS)、表皮生长因子(EGF)、胰岛素-转铁蛋白-硒(ITS)、磷酸盐缓冲液(PBS)、两性霉素B(Gibco,美国)。
仪器:倒置荧光显微镜(Leica,德国)、二氧化碳 培 养 箱 (Thermo,美 国)、Image Quant Capture 3000凝胶成像系统(GE,美国)、Eppendorf Thermal Cycler PCR 仪(Eppendorf,德 国)、海 尔 DW-86L388-86℃超低温冰箱(海尔集团)、Eppendorf移液器(Eppendorf,德国)、LDZX-50KBS型立式压力蒸汽灭菌器(上海申安医疗器械厂)、DYCP-31C型琼脂糖水平电泳仪(槽)(北京六一仪器厂)、SW-CJ-1D型单人双面净化工作台(苏州净化设备有限公司)、DK-8B型电热恒温水槽(上海精宏实验设备有限公司)、Eppendorf Centrifuge 5415R冷冻离心机(Eppendorf,德国)、NanoDrop ND-1000浓度测定仪(GE,美国)、ABI7500荧光定量PCR仪(Applied Biosystems,美国)。
奶牛乳腺组织:来源于扬州大学农牧场健康的泌乳期的中国荷斯坦奶牛。
1.2 方法
1.2.1 奶牛乳腺细胞的原代培养
选择健康的泌乳期奶牛,采用无菌操作方法[11]进行活体采样,即将奶牛乳房的毛剔去,75%的酒精清洗消毒后,用无菌的手术剪在乳房底部至乳头连线的中部做一个2cm大的切口,切取5g左右的乳腺实质组织,移入含FBS(10%)、青霉素(300IU/mL)、链 霉 素 (300IU/mL)的 DMEM/F12培养基中,置于冰盒带回实验室,用PBS(含100IU/mL青霉素、100IU/mL链霉素)清洗3遍,洗去乳汁和血污之后,去除脂肪和结缔组织,采用酶消化法[12]处理余下的乳腺腺泡,将细胞接种到25cm2培养瓶,置于37℃、5%CO2、饱和湿度的CO2培养箱中培养。
1.2.2 细胞的纯化与传代
根据成纤维细胞与上皮细胞对胰蛋白酶耐受时间的不同及2种细胞贴壁速度的差异,采用胰蛋白酶差时消化法及差速贴壁分离法对奶牛乳腺上皮细胞进行纯化[12]。待细胞长满90%以后,用0.25%胰酶消化、传代并冻存。对细胞中角蛋白-18进行鉴定后,用实时荧光定量PCR方法检测奶牛乳腺上皮细胞中CSN1S1基因及mTOR和JAK-STAT信号通路中相关基因表达量。
1.3 试验设计
采用单因素试验设计,选用4代的细胞,于复苏后等密度接种于6孔板,待细胞长满70%~80%时,先用无血清无激素含有双抗和两性霉素的DMEM/F12培养基过渡16h以上,然后分别用含有0(对照组)、2.5、25.0、250.0、5 000.0ng/mL INS的生长培养液培养细胞24h,收获细胞,提取RNA,测定浓度,制备实时荧光定量PCR反应液,用于相关基因的检测。各基因表达量用2-ΔΔCt值表示。
1.4 相关基因引物设计
以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用Primer 3软件进行引物设计,引物信息见表1。
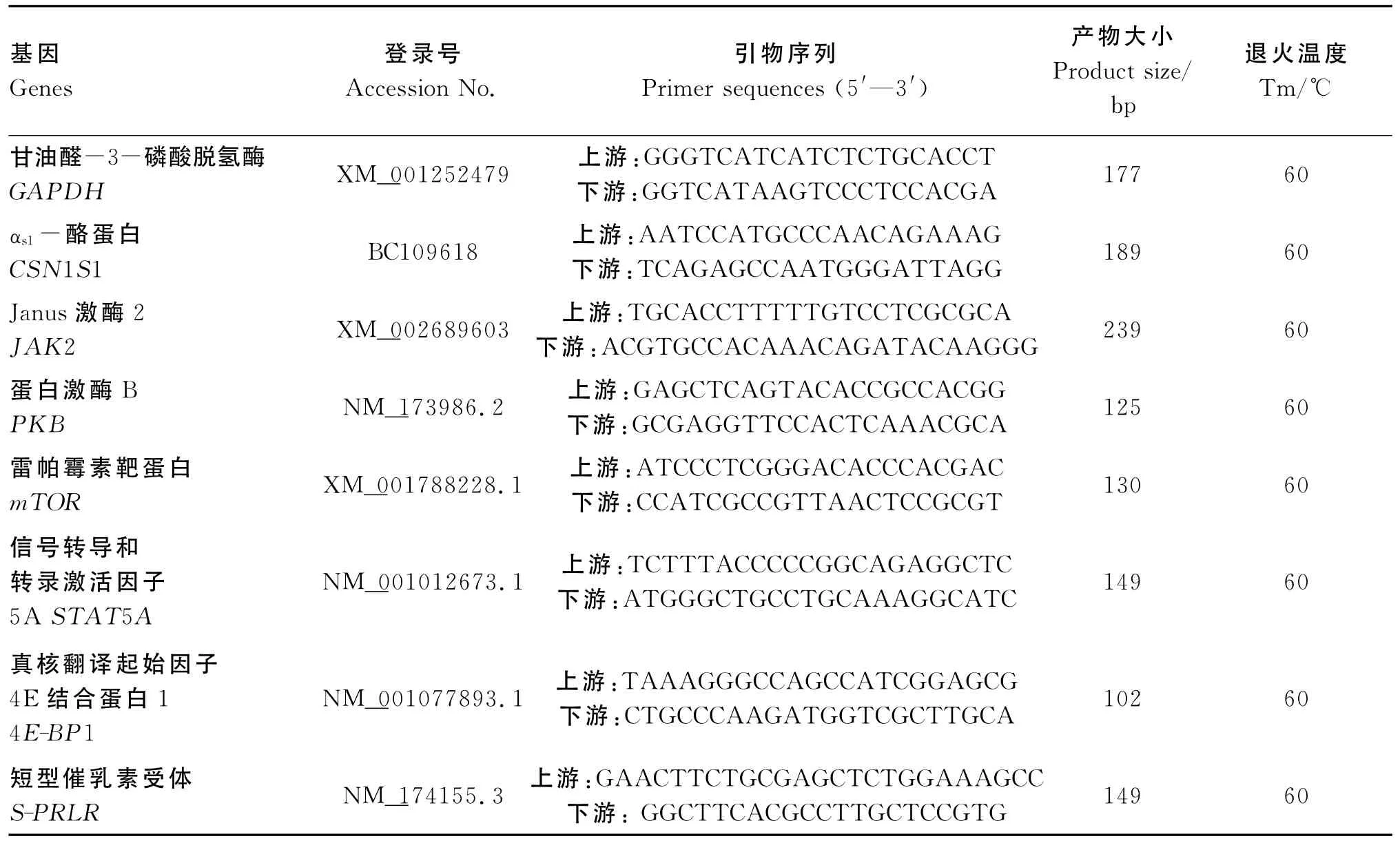
表1 引物信息Table 1 Information of primers
1.5 数据统计
所有原始数据先用Excel 2003进行整理,用SAS 9.1中ANOVA进行显著性分析,Tukey法进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。数据统计的最终结果用平均值±标准误表示。
2 结 果
2.1 INS对奶牛乳腺上皮细胞CSN1S1基因表达量的影响
由表2可知,与0ng/mL组(对照)相比,添加INS能够促进奶牛乳腺上皮细胞CSN1S1基因的表达,各INS组CSN1S1基因表达量均高于0ng/mL组,其中25.0ng/mL INS作用效果最好,极显著高于0ng/mL组(P<0.01)。
2.2 INS对奶牛乳腺上皮细胞mTOR信号通路相关基因表达量的影响
由表3可知,与0ng/mL组相比,添加2.5、25.0和250.0ng/mL INS显 著 或 极 显 著 提 高PKB基因表达量(P<0.05或P<0.01);INS能提高S-PRLR基因表达量,其中25.0和250.0ng/mL组极显著高于0ng/mL组(P<0.01),5 000.0 ng/mL组显著高于0ng/mL组(P<0.05);从mTOR基因表达量来看,2.5和25.0ng/mL组极显著高于0ng/mL组(P<0.01),250ng/mL组也高于0ng/mL组,但差异不显著(P>0.05),5 000.0 ng/mL组极显著低于0ng/mL组(P<0.01);对于4E-BP1基因表达量而言,2.5和25.0ng/mL组极显 著 高 于 0ng/mL 组 (P<0.01),250.0 和5 000.0ng/mL组也高于0ng/mL组,但差异不显著(P>0.05),且随着浓度的增加表达量呈下降趋势。以上数据显示,INS能够通过mTOR信号通路来调节CSN1S1基因的表达,但是INS的浓度过大反而不利于这些基因的表达。
2.3 INS对奶牛乳腺上皮细胞JAK-STAT信号通路相关基因表达量的影响
由表4可知,与0ng/mL组相比,INS可增加奶牛乳腺上皮细胞JAK-STAT信号通路中JAK2和STAT5 A基因表达量。对JAK2基因表达量而言,2.5ng/mL组显著高于0ng/mL组(P<0.05),25.0 和 250.0ng/mL组则极显著高于0ng/mL组(P<0.01),而5 000.0ng/mL组高于0ng/mL 组,但差异不显著(P>0.05);对于STAT5A基因表达量而言,2.5、25.0和250.0ng/mL组均极显著高于0ng/mL组(P<0.01),而5 000.0ng/mL组低于0ng/mL组,但差异不显著(P>0.05)。

表2 INS对奶牛乳腺上皮细胞CSN1S1基因表达量的影响Table 2 Effects of INS on expression level of CSN1S1gene in bovine mammary epithelial cells
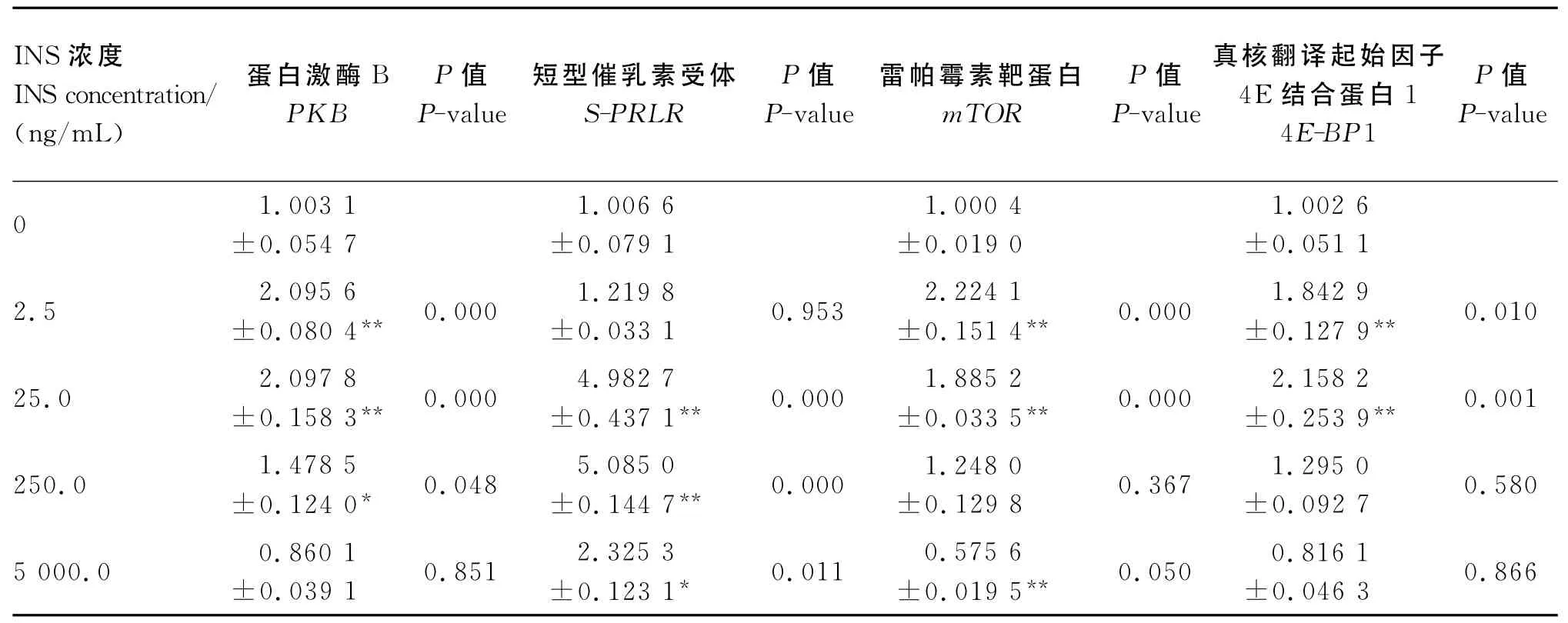
表3 INS对奶牛乳腺上皮细胞mTOR信号通路相关基因表达量的影响Table 3 Effects of INS on expression levels of mTOR signal pathway related genes in bovine mammary epithelial cells
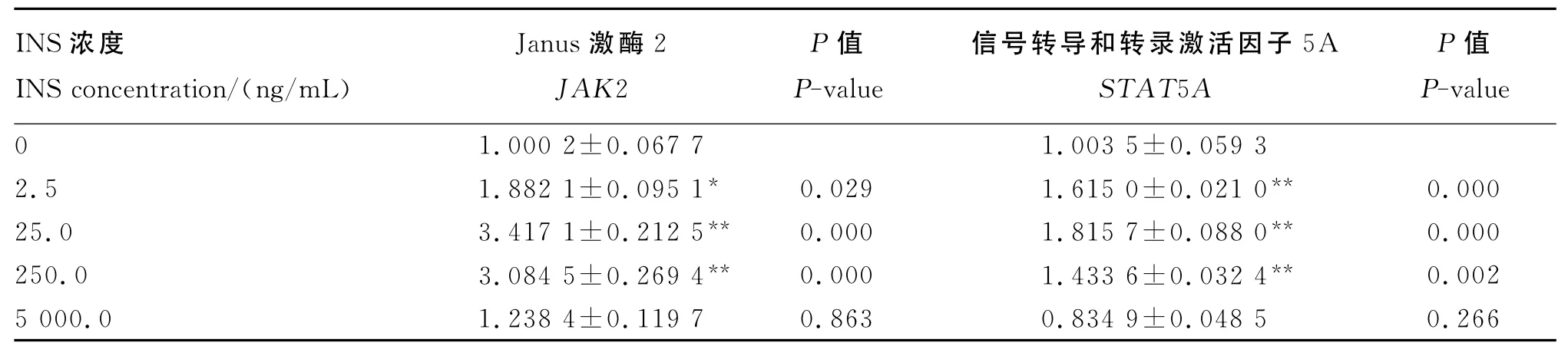
表4 INS对奶牛乳腺上皮细胞JAK-STAT信号通路相关基因表达量的影响Table 4 Effects of INS on expression levels of JAK-STAT signal pathway related genes in bovine mammary epithelial cells
2.4 INS浓度与各基因表达量间的相关性分析
由表5、表6和表7可知,当INS浓度在0~5 000.0ng/mL时,JAK2与S-PRLR 基因表达量间呈显著正相关(P<0.05),与CSN1S1(P=0.061)和STAT5 A(P=0.090)基因表达量间有呈显著正相关的趋势;S-PRLR与CSN1S1基因表达量间有呈显著正相关的趋势(P=0.098);STAT5 A与mTOR、4E-BP1基因表达量间呈显著或极显著正相关(P<0.05或P<0.01);INS浓度与其他基因表达量间无显著相关(P>0.05)。
当INS浓度在0~25.0ng/mL时,S-PRLR与CSN1S1基因表达量间、INS浓度与S-PRLR、CSN1S1基因表达量间及4E-BP1与STAT5 A基因表达量间呈显著的正相关(P<0.05)。
当INS浓度在25.0~5 000.0ng/mL时,INS浓度与JAK2基因表达量间呈显著负相关(P<0.05),与S-PRLR基因表达量间有呈负相关的趋势(P=0.073),4E-BP1与CSN1S1基因表达量间、PKB与mTOR基因表达量间呈显著正相关(P<0.05)。

表5 INS浓度(0~5 000.0ng/mL)与各基因表达量间的相关性分析Table 5 Correlative analysis of INS concentration(0to 5 000.0ng/mL)and gene expression levels
3 讨 论
3.1 INS对奶牛乳腺上皮细胞mTOR信号通路的影响
mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,mTOR信号通路由于处于生长调节的中心环节而倍受关注[14]。mTOR是细胞内多种重要信号传导通路的调控蛋白,调控着细胞内蛋白质的翻译起始、转录、蛋白合成及降解功能,进而调节细胞的生长、增殖和凋亡等重要环节[15-19]。在哺乳动物细胞中,INS是通过磷脂酰肌醇-3-激酶-蛋白激酶B-雷帕霉素靶蛋白(PI3K-PKB-mTOR)信号通路[20-22]与其受体结合而激活PKB,活化的PKB可以直接磷酸化 mTOR[23],而PKB能够控制细胞的生长和增殖。INS还是一个重要的中间代谢的调节因子,它的作用具有双向性,既可以通过激活mTOR下游的转录因子和通过真核细胞翻译启动因子2(eIF2)的作用去除PKB的调节抑制作用而调控蛋白质的合成,也可以通过诱导转录机制的生物合成而促进蛋白质的合成[24]。研究表明,泌乳激素单独添加效果不明显[25],与氨基酸同时添加能进一步增强乳蛋白的合成,营养素和激素可以通过mTOR信号路径来调控乳蛋白的合成和转运[26-29]。INS首先激活INS亚基受体从而促进乳腺上皮细胞泌乳的生物合成[30],然后通过改变4E-BP1、转译抑制因子和核糖体蛋白p70S6激酶1(P70S6K1)的磷酸化状态使mTOR信号、氨基酸供应、细胞能量状态和激素信号级联融合而调节蛋白质的合成,还可以通过增加乳腺血浆流速来起作用[27-28]。研究表明,在 HYD和PRL这2种激素同时存在的条件下,INS可以促进乳蛋白相关基因的表达和乳蛋白的合成,在缺乏PRL的条件下,INS对乳蛋白相关基因的表达也起着很关键的作用[31-32]。
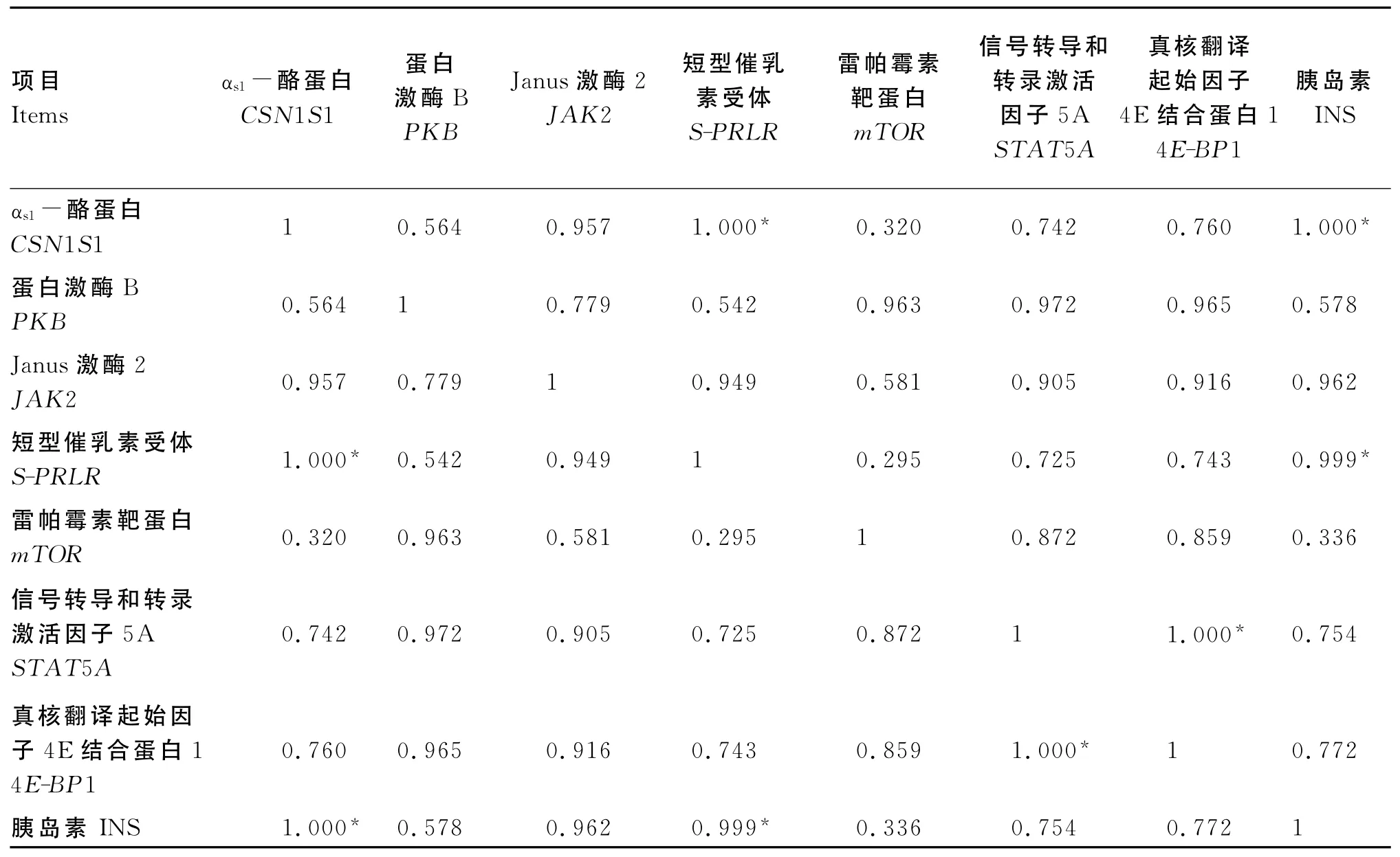
表6 INS浓度(0~25.0ng/mL)与各基因表达量间的相关性分析Table 6 Correlative analysis of INS concentration(0to 25.0ng/mL)and gene expression levels
本试验结果表明,与0ng/mL组相比,添加2.5、25.0 和 250.0ng/mL INS能 够 显 著 提 高PKB基因表达量;从mTOR基因表达量来看,2.5和25.0ng/mL组极显著高于0ng/mL组,250.0ng/mL组也高于0ng/mL组,但差异不显著,5 000.0ng/mL组极显著低于0ng/mL组。这与前人的研究结果一致,也进一步证实了INS是通过增加激素受体表达,增加mTOR信号通路中正向调节基因表达的,促进CSN1S1基因表达进而促进乳蛋白合成,但高浓度的INS(>5 000.0ng/mL)反而对乳蛋白合成不利。本试验还发现25.0和250.0ng/mL组S-PRLR基因表达量极显著高于0ng/mL组,5 000.0ng/mL 组 则 显 著 高 于0ng/mL组,这说明INS不但对自身受体起作用,同时还能影响S-PRLR基因表达,进而影响乳蛋白的合成。
P70S6K1和4E-BP1是mTOR的2个直接下游靶蛋白,都是细胞蛋白质生物合成的关键因子。在细胞内,4E-BP1被mTOR磷酸化后,降低了与真核翻译起始因子4E(eIF4E)的亲和力,使eIF4E形成更多的eIF4F复合物,启动胞内mRNA的翻译[33]。mTOR的活性被抑制,使4E-BP1磷酸化减少,使其与eIF4E的亲和力增加,从而阻断mRNA翻译起始复合物的形成,进而阻断细胞的增殖[34]。有研究表明,INS能够减少4E-BP1含量并增加磷酸化4E-BP1含量来调节转录[35-37]。本试验研究表明,对于mTOR下游4E-BP1基因表达量,2.5和 25.0ng/mL 组 极 显 著 高 于 0ng/mL组,250.0和5 000.0ng/mL组也高于0ng/mL组,但差异不显著,且随着INS浓度的增加表达量呈下降趋势。分析其原因,一方面可能是基因4E-BP1高的表达量为有更多的4E-BP1进入磷酸化状态奠定了物质基础,另一方面可能是已经有足够的促进CSN1S1基因表达的4E-BP1进入到磷酸化状态而将4E-BP1富余下来,可用于进一步促进乳蛋白相关基因的表达,进而促进乳蛋白的合成,这与整体试验结果相吻合。
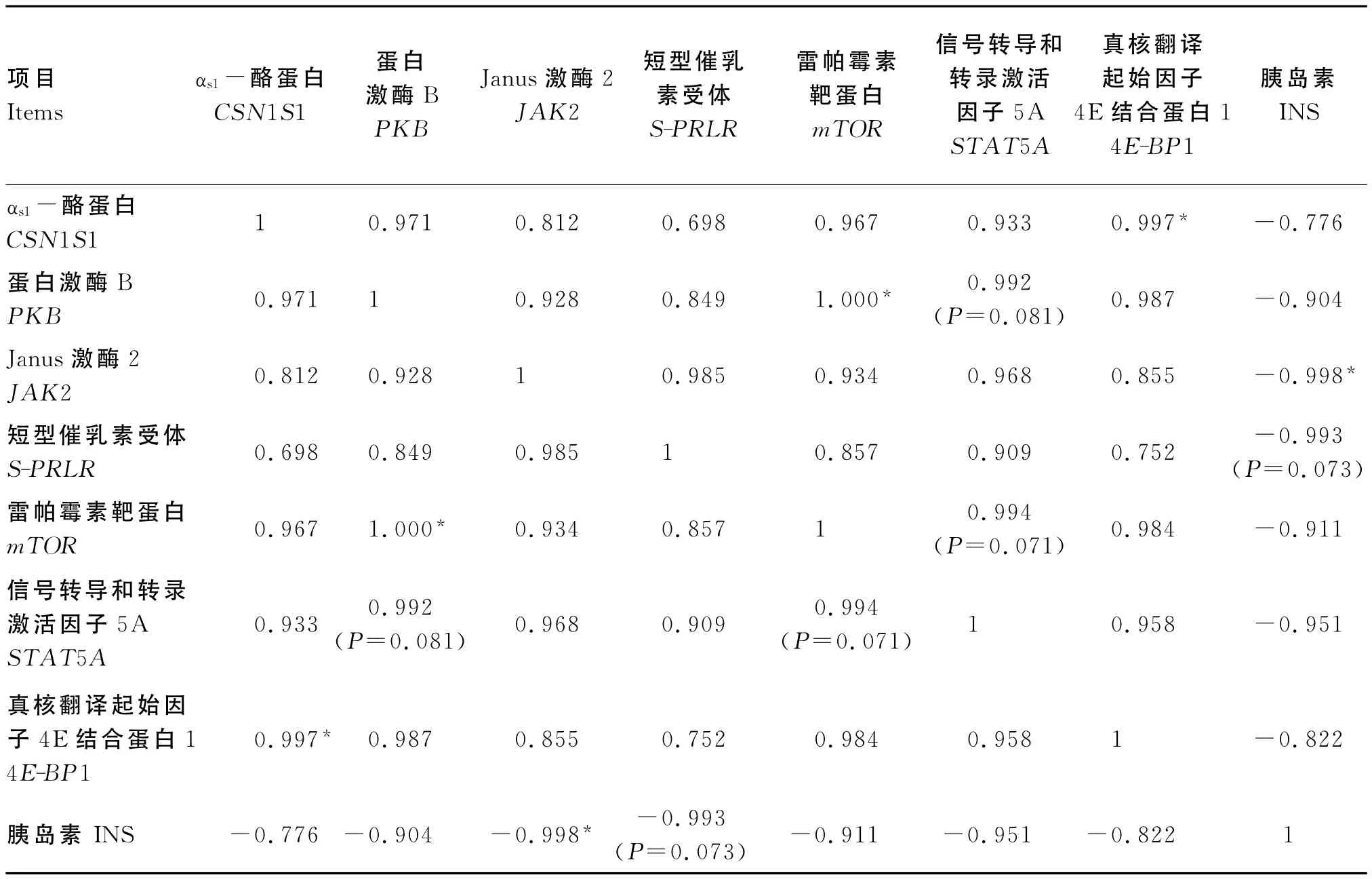
表7 INS浓度(25.0~5 000.0ng/mL)与各基因表达量间的相关性分析Table 7 Correlative analysis of INS concentration(25.0to 5 000.0ng/mL)and gene expression levels
INS不仅仅是乳蛋白基因表达所必需的,还在多个层面诱导奶牛乳腺上皮细胞乳蛋白合成。研究表明,乳蛋白基因的表达需要INS、PRL和HYD,在164个对INS敏感的基因中,其中18个随着氨基酸的摄取和代谢在转录和后转录水平与乳蛋白的合成密切相关[38]。单独添加INS能够同时促进乳蛋白和非乳蛋白的合成,但PRL单独添加效果不明显,二者同时添加则具有协同作用,能进一步促进乳蛋白的合成[39]。也有研究表明,在皮质醇和PRL存在的情况下,INS在乳蛋白合成中有潜在作用,INS刺激了直接参与蛋白质合成的28个基因的表达,其中包括4种酪蛋白基因[40]。本试验研究结果表明,与0ng/mL组相比,添加INS能够促进奶牛乳腺上皮细胞CSN1S1基因的表达,各INS组CSN1S1基因表达量均高于0ng/mL,其中25.0ng/mL INS作用效果最好,极显著高于其他各组,这与前人研究结果一致。
3.2 INS对奶牛乳腺上皮细胞JAK-STAT信号通路的影响
JAK是一类非受体酪氨酸激酶家族,其中JAK2是哺乳动物JAKs家族中已发现的4个成员之一[41]。STAT5A是在哺乳动物中发现的JAKs的7种STAT底物之一,它在乳腺细胞增殖、分化和泌乳方面起着主要作用[42]。
激素可以和细胞膜上的激素受体结合形成复合物,激活胞内JAK2,使激素受体上的酪氨酸残基磷酸化,2个STATs蛋白通过各自磷酸化的酪氨酸和对方的含Src同源区2(SH2)功能域结合,形成STATs二聚体进入核内从而激活基因的转录,此路径称为JAK-STAT信号通路[43]。有关激素与JAK-STAT信号通路的研究主要集中在一些疾病研究中,涉及到的激素主要有生长激素、PRL、雌激素等,它们的作用都是通过此途径来发挥的[44-45],关于INS的研究并不多见。本试验研究结果表明,与0ng/mL组相比,INS可以显著增加奶牛乳腺上皮细胞JAK-STAT信号通路中JAK2和STAT5 A基因表达量,其中2.5ng/mL组显著增加了JAK2基因表达量,25.0和250.0ng/mL组则极显著增加了JAK2基因表达量,而5 000.0ng/mL组则差异不显著,但高于0ng/mL组;另 外,与 0ng/mL 组 相 比,2.5、25.0 和250.0ng/mL组极显著增加了STAT5 A基因表达量,而5 000ng/mL组则差异不显著,且低于0ng/mL组。这与前人研究结果一致,也进一步证实了JAK-STAT信号通路在奶牛乳蛋白合成中的作用,说明INS在调节mTOR信号通路的同时也调节着JAK-STAT信号通路,也是通过促进JAKSTAT信号通路中正向调节基因的表达来促进奶牛乳腺上皮细胞CSN1S1基因的表达,进而促进奶牛乳腺乳蛋白的合成,但是高浓度的INS(>5 000.0ng/mL)可能对奶牛乳腺乳蛋白的合成不利。
通过本试验的相关性分析表明,当INS浓度在0~25.0ng/mL时,S-PRLR 与CSN1S1基因表达量、INS浓度与S-PRLR、CSN1S1基因表达量及4E-BP1与STAT5 A基因表达量间呈显著正相关;当INS浓度在25.0~5 000.0ng/mL时,INS浓度与JAK2基因表达量间呈显著负相关,与S-PRLR基因表达量间呈负相关的趋势,4E-BP1与CSN1S1基因表达量、PKB与mTOR、STAT5 A基因表达量间呈显著正相关;当INS浓度在0~5 000.0ng/mL时,INS浓度与各基因表达量不相关,JAK2与S-PRLR基因表达量间呈显著正相关,与CSN1S1和STAT5 A基因表达量间有呈显著正相关的趋势;S-PRLR与CSN1S1基因表达量间有呈显著正相关的趋势;STAT5 A与mTOR、4E-BP1基因表达量间呈显著和极显著正相关,这一结果与前面的试验结果完全一致,也进一步证实了0~25.0ng/mL的INS可以促进信号通路中各正向调节基因的表达,而INS浓度在25.0~5 000.0ng/mL时,INS的促基因表达作用逐渐减弱,甚至抑制2条主要信号通路中各基因的表达,进而使CSN1S1基因表达量逐渐减少;这一结果也证实了INS主要是通过mTOR和JAK-STAT 2条信号通路来调节乳蛋白相关基因表达的,这可能进一步影响乳蛋白的合成。
4 结 论
①INS可以促进奶牛乳腺上皮细胞CSN1S1基因的表达。
②INS促进乳蛋白合成的作用机理可能是通过同时作用于mTOR和JAK-STAT 2条信号通路来调节乳蛋白相关基因表达进而促进乳蛋白合成的;另一方面,INS还可能通过影响PRL受体的作用而影响乳蛋白的合成。
③INS对乳蛋白合成的调控有一定的剂量依赖关系,低浓度时随着INS浓度的增加呈正向调控的关系,总体看来,添加25.0ng/mL INS时作用效果最好,但高浓度(>5 000.0ng/mL)的INS对奶牛乳腺乳蛋白的合成反而不利。
[1] 王加启.牛奶乳脂肪和乳蛋白的合成与调控机理[J].饲料与畜牧,2011(2):8-14.
[2] MOLENTO C F M,BLOCK E,CUE R I,et al.Effects of insulin,recombinant bovine somatotropin and their interaction on insulin-like growth factor-Ⅰ secretion and milk protein production in dairy cows[J].Journal of Dairy Science.2002,85(4):738-747.
[3] METCALF J A,SUTTON J D,COCKBURN J E,et al.The influence of insulin and amino acid supply on amino acid uptake by the lactating bovine mammary gland[J].Journal of Dairy Science,1991,74(10):3412-3420.
[4] CHEW B P,EISENMAN J R,TANAKA T S.Arginine infusion stimulates prolactin,growth hormone,insulin,and subsequent lactation in pregnant dairy cows[J].Journal of Dairy Science,1984,67(11):2507-2518.
[5] MACKLE T R,DWYER D A,INGVARTSEN K L,et al.Effects of insulin and amino acids on milk protein concentration and yield from dairy cows[J].Journal of Dairy Science,1999,82(7):1512-1524.
[6] CHOI K M,BARASH I,RHOADS A E.Insulin and prolactin synergistically stimulateβ-casein messenger ribonucleic acid translation by cytoplasmic polyadenylation[J].Molecular Endocrinology,2004,18(7):1670-1686.
[7] BOSSAERT P,COCK H D,LEROY J L M R,et al.Immunohistochemical visualization of insulin receptors in formalin-fixed bovine ovaries post mortem and in granulosa cells collected in vivo[J].Theriogenology,2010,73(9):1210-1219.
[8] LANNA D P D,BAUMAN D E.Effect of somatotropin,insulin and glucocorticoid on lipolysis in chronic cultures of adipose tissue from lactating cows[J].Journal of Dairy Science,1999,82(1):60-68.
[9] MENZIES K K,LEE H J,LEFÈVRE C,et al.Insulin,a key regulator of hormone responsive milk protein synthesis during lactogenesis in murine mammary explants[J].Funct Integr Genomics,2010,10(1):87-95.
[10] AKERS R M.Major advances associated with hormone and growth factor regulation of mammary growth and lactation in dairy cows[J].Journal of Dairy Science,2006,89:1222-1234.
[11] HARVATINE K J,BAUMAN D E.SREBP1and thyroid hormone responsive spot14(s14)are involved in the regulation of bovine mammary lipid synthesis during diet-induced milk fat depression and treatment with CLA[J].The Journal of Nurition,2006,136:2468-2474.
[12] 徐柏林,王梦芝,张兴夫,等.精氨酸水平对奶牛乳腺上皮细胞体外生长及κ-酪蛋白基因表达的影响[J].动物营养学报,2012,24(5):852-858.
[13] ZHOU Y,AKERS R M,JIANG H.Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J].Journal of Dairy science,2008,91:100-108.
[14] 綦松智,吴登俊,张中显.mTOR对信号通路调控的研究进展[J].中国畜牧杂志,2010,46(1):57-60.
[15] 张萌,吴峻,王玮,等.AMPK经过mTOR途径对大鼠血管平滑肌细胞增殖的影响[J].山东大学学报:医学版,2010,48(6):17-21.
[16] JOANNA Z,BARBARA G,TOMASZ M,et al.IGF-Ⅰ,EGF,and sex steroids regulate autophagy in bovine mammary epithelial cells via the mTOR pathway[J].European Journal of Cell Biology,2009,88:117-130.
[17] ACCORSI P A,PACIONI B,PEZZI C,et al.Role of prolactin,growth hormone and insulin-like growth factor 1in mammary gland involution in the dairy cow[J].Journal of Dairy science,2002,85(3):507-513.
[18] PLATH-GABLER A,GABLER C,SINOWATZ F,et al.The expression of the IGF family and GH receptor in the bovine mammary gland[J].Journal of Endocrinology,2001,168(1):39-48.
[19] TONNER E,BARBER M C,TRAVERS M T,et al.Hormonal control of insulin-like growth factor-binding protein-5production in the involuting mammary gland of the rat[J].Endocrinology,1997,138(12):5101-5107.
[20] BRAZIL D P,HEMMINGS B A.Ten years of protein kinase B signalling:a hard Akt to follow[J].Trends in Biochemical Sciences,2001,26:657-664.
[21] BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J].Journal of Dairy Science.2010,93(1):153-161.
[22] LONG X Y,ORTIZ-VEGA L S,YONEZAWA K,et al.Rheb binds and regulates the mTOR kinase[J].Current Biology,2005,15:702-713.
[23] YANG X,YANG C,FARBERMAN A,et al.The mammalian target of rapamycin signaling pathway in regulating metabolism and growth[J].Journal of Animal Science,2008,86(14):E35-E50.
[24] PATURSKY-POLISCHUK I,STOLOVICH-RAIN M,HAUSNER-HANOCHI M,et al.The TSC-mTOR pathway mediates translational activation of TOP mRNAs by insulin largely in a raptor-or rictorindependent manner[J].Molecular and Cellular Biology,2009,29:3640-3649.
[25] RIUS A G,APPUHAMY J A D R N,CYRIAC J,et al.Regulation of protein synthesis in mammary gland of lactating dairy cows by starch and amino acids[J].Journal of Dairy Science,2010,93:3114-3127.
[26] BARASH I.Prolactin and insulin synergize to regulate the translation modulator PHAS-I via mitogen-activated protein kinase-independent but wortmannin-and rapamycin-sensitive pathway[J].Molecular and Cellular Endocrinology,1999,155:37-49.
[27] BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J].Journal of Dairy Science,2010,93(1):153-161.
[28] LI X,ALAFUZOFF I,SOININEN H,et al.Levels of mTOR and its downstream targets 4E-BP1,eEF2,and eEF2kinase in relationships with tau in Alzheimers’disease brain[J].FEBS Journal,2005,272(16):4211-4220.
[29] AKERS R M.Major advances associated with hor-mone and growth factor regulation of mammary growth and lactation in dairy cows[J].Journal of Dairy Science,2006,89:1222-1234.
[30] SMIRNOVA O V,OSTROUKHOVA T Y,BOGORAD R L.JAK-STAT pathway in carcinogenesis:is it relevant to cholangiocarcinoma progression? [J].World Journal of Gastroenterol,2007,13(48):6478-6491.
[31] MENZIES K K,LEFÈVRE C,MACMILLAN K L,et al.Insulin regulates milk protein synthesis at multiple levels in the bovine mammary gland[J].Funct Integr Genomics,2009,9(2):197-217.
[32] BEQUETTE B J,KYLE C E,CROMPTON L A,et al.Insulin regulates milk production and mammary gland and hind-leg amino acid fluxes and blood flow in lactating goats[J].Journal of Dairy Science,84:241-255.
[33] DIANE C,SOFIE S,CHRISTINA T,et al.Mammalian cell size is controlled by mTOR and its downstream targets S6K1and 4EBP1/eIF4E[J].Genes Development,2002,16(12):1472-1487.
[34] SHEN W,MALLON D,BOYLE D W,et al.IGF-Ⅰand insulin regulate eIF4Fformation by different mechanisms in muscle and liver in the ovine fetus[J].American Journal of Physiology Endocrinolgy Metabolism,2002,283(3):E593-E603.
[35] TERRUZZI I,PELLEGATTA F,LUZI L.Differential p70S6kand 4EBP1regulation by insulin and amino acids in vascular endothelial and smooth muscle cells[J].Acta Diabetologica,2005,42(3):139-146.
[36] MENZIES K K,LEE H J,LEFÈVRE C,et al.Insulin,a key regulator of hormone responsive milk protein synthesis during lactogenesis in murine mammary explants[J].Funct Integr Genomics,2010,10(1):87-95.
[37] APPUHAM J A D R,BELL L N Y A,NAYANANJALIE W A D,et al.Essential amino acids regulate both initiation and elongation of mRNA translation independent of insulin in MAC-T cells and bovine mammary tissue slices[J].The Journal of Nutrition,2011,141(6):1209-1215.
[38] CHOI K M,BARASH I,ROBERT E R.Insulin and prolactin synergistically stimulateβ-casein messenger ribonucleic acid translation by cytoplasmic polyadenylation[J].Molecular Endocrinology,2004,18(7):1670-1686.
[39] MUSSO T,JOHNSTON J A,LINNEKIN D,et al.Regulation of JAK3expression in human monocytes:phosphorylation in response to interleukins 2,4,and 7[J].The Journal of Experimental Medicine,1995,181(4):1425-1431.
[40] 王加启.胰岛素在多个水平调节奶牛乳腺乳蛋白质合成[J].奶业研究简报,2012(2):3.
[41] 黄田英,李庆章,侯晓明.乳腺中JAK-STAT通路的研究进展[J].中国乳品工业,2010,38(2):41-44.
[42] 贾祥捷,李秋玲,王长法.等.牛催乳素基因及其单核苷酸多态性与产奶性状关系的研究进展[J].中国畜牧兽医,2010,37(3):148-152.
[43] TAM L,MCGLYNN L M,TRAYNOR P,et al.Expression levels of the JAK/STAT pathway in the transition from hormone-sensitive to hormone-refractory prostate cancer[J].British of Journal Cancer,2007,97(3):378-383.
[44] RABKIN R,SUN D F,CHEN Y,et al.Growth hormone resistance in uremia,a role for impaired JAK/STAT signaling[J].Pediatric Nephrology,2005,20(3):313-318.
[45] BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J].Bioinformatics and Biology Insights,2011,5:83-98.
