分子印迹-固相萃取分离/富集EGCG试验
2013-08-22张海晖段玉清闫永胜孙晓波
张海晖,段玉清,秦 宇,闫永胜,孙晓波
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江苏大学化学化工学院,江苏 镇江 212013;3.中国医学科学院药用植物研究所,北京 100193)
表没食子儿茶素没食子酸酯 [(-)-epigallocatechin gallate,简称EGCG]是茶的主要活性成分,具有清除自由基、抗氧化[1-3]、抗癌和防辐射[4-6]等多种生物活性,但儿茶素单体间的化学结构和性质极其相似,现有吸附剂选择性吸附能力差,高纯度EGCG的分离一直难以实现.因此开发新型吸附剂、拓展其应用范围、提高吸附剂的选择性,是解决EGCG分离提取中长期困扰的高成本、低收率技术瓶颈的关键.分子印迹聚合物(molecular imprinted polymers,简称MIPs)是基于分子印迹技术制备的空间结构和结合位点上与印迹分子完全匹配的新型聚合物吸附材料,因MIPs对印迹分子具有高选择性和识别性,已在色谱分离、手性拆分、固相萃取、仿生传感器[6-11]等领域展现出良好的应用前景.
鉴于此,文中以EGCG为模板分子,微米硅胶为载体,γ-氨丙基三乙氧基硅烷(KH-550)为功能单体,正硅酸四乙酯(TEOS)为偶联剂,采用表面分子印迹技术,通过热聚合方法制备EGCG-微米硅胶分子印迹聚合物,并通过傅里叶变换红外光谱(FTIR)和扫描电子显微镜(SEM)对其进行物理表征.通过静态和动态固相萃取考察MIPs的性能,为MIPs-固相萃取分离/富集EGCG提供可靠的参考.
1 试验
1.1 硅胶活化
称取 50.0 g微米(160目)硅胶于 200 mL的3 mol·L-1盐酸中,搅拌均匀后置于室温下过夜后,分别用水和无水乙醇洗涤抽滤,于120℃下干燥12 h,置于干燥器中备用.
1.2 EGCG分子印迹聚合物的制备
向10 mL具塞试管中加入5 mL氯仿-甲醇(体积比4∶1)和0.04 g EGCG,超声溶解后,加入1 mL KH-550,磁力搅拌30 min,随后加入0.5 g微米硅胶和1 mL TEOS,继续搅拌20 min,最后加入1.0 mol·L-1醋酸 1 mL,搅拌均匀,充氮气 15 min后,密封.将该混合体系于60℃下搅拌反应10 h,反应结束后用无水乙醇洗涤,置100℃下干燥8 h,得到EGCG分子印迹功能材料前驱体.将该前驱体用甲醇-乙酸(体积比9∶1)的混合液索氏提取48 h,以除去印迹分子EGCG,再分别用氯仿和无水甲醇洗去材料表面的残留物并将其置于80℃下干燥12 h,即得MIPs.非印迹材料(NIPs)的制备除了不加EGCG外,其余步骤同MIPs.
1.3 MIPs吸附条件筛选
称取20 mg聚合物分别加入10 mL离心管中,随后加入质量浓度为20 μg·mL-1EGCG不同溶剂的溶液5 mL,充分混合后,于不同温度水浴中振荡吸附10 h后,5000 g离心10 min,移取上层清液,于274 nm处测定吸光度,换算成EGCG的质量浓度,差减法计算吸附量:
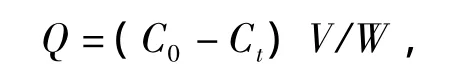
式中:Q为聚合物对EGCG的吸附量,mg·g-1;C0为溶液中EGCG的初始质量浓度,μg·mL-1;Ct为溶液中EGCG的终质量浓度,μg·mL-1;V为溶液的体积,mL;W为聚合物的质量,mg.
1.4 聚合物的静态等温吸附
称取20 mg的聚合物分别置于10 mL的离心管中,随后加入pH 5的不同质量浓度的EGCG去离子水溶液5 mL,充分混合后,置于25℃恒温水浴中振荡吸附10 h,离心取上清于274 nm处测定吸光度.采用Scatchard模型评价MIPs对EGCG的结合特性、其公式为
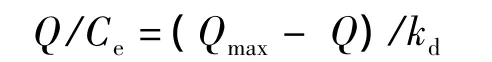
式中:Q和 Ce分别为 MIPs在不同质量浓度的EGCG溶液中的吸附量,mg·g-1和终浓度,μg·mL-1;Qmax表示 MIPs的最大吸附量,mg·g-1;kd为平衡解离常数,μg·mL-1.
1.5 吸附动力学试验
称取40 mg聚合物于10 mL离心管中,随后加50 μg·mL-1pH 5 的 EGCG 去离子水溶液5 mL,充分混合后,置于25℃恒温水浴中振荡吸附不同时间,离心取上清液于274 nm处测定吸光度.分别运用准一级和准二级动力学模型描述MIPs对EGCG的吸附动力学过程.2个方程分别为
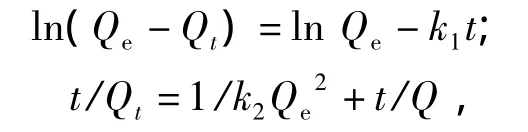
式中:Qe为平衡状态时MIPs的吸附量,mg·g-1;Qt为t时刻MIPs的吸附量,mg·g-1;k1为准一级速率常数,h-1;k2为准二级速率常数,g·(mg·h-1)-1.
1.6 分子印迹-固相萃取与HPLC选择性
取50 mg聚合物于5 mL去离子水中充分溶胀之后,装入固相萃取柱(13 mm×6 mm),以0.5 mL·min-1的流速加入5 mL蒸馏水清洗并平衡萃取柱,柱床体积(BV)为160 μL.以0.5柱床体积每分钟的流速上样,上样液为EGCG及其相似物,其质量浓度均是200 μg·mL-1的pH为5.0去离子水混合溶液,上样量为1柱床体积,静置吸附30 min后,用去离子淋洗液,每次1柱床体积共10次,再以甲醇-乙酸(体积比9∶1)洗脱,每次1柱床体积共10次.分别收集淋洗液和洗脱液,氮气吹干后再用去离子水定容到原体积,0.45 μm过滤膜后,HPLC分析检测.HPLC色谱条件为 ZORBAX 300SB-C18柱(4.6 mm ×250 mm,5 μm)色谱柱,甲醇 - 水 - 乙酸(体积比为24.5∶75.0∶0.5)为流动相,流速为0.6 mL·min-1,进样量为 10 μL,检测波长为274 nm.

图1 活化硅胶,MIPs和NIPs电镜图
为定量研究MIPs的选择性,引入分配系数Kd,选择性系数k和相对选择性系数k'.其中,Kd是分配系数,定义为平衡状态下该溶质在两相中的质量浓度之比.k是选择性系数,表示同一种吸附剂吸附2种不同物质,定义为2种竞争性溶质的Kd值之比.k'是相对选择性系数,为2种吸附剂的k值之比.计算公式分别为Kd=Qe/Ce,k=KdEGCG/Kdanalogues和 k'=kMIPs/kNIPs.其中 Ce为达到平衡时溶液中EGCG的质量浓度,μg·mL-1;Qe为结合位点的平衡结合吸附量,mg·g-1.
2 结果与分析
2.1 聚合物的表征
活化硅胶表面平整且光滑,MIPs的表面明显出现很多的“空洞”且其表面的凸凹不平的程度明显比NIPs要深,如图1所示.
这可能是由于MIPs经洗脱后,EGCG分子被洗脱下来,留下了具有空间结构的“空穴”.聚合物的FT-IR见图2.
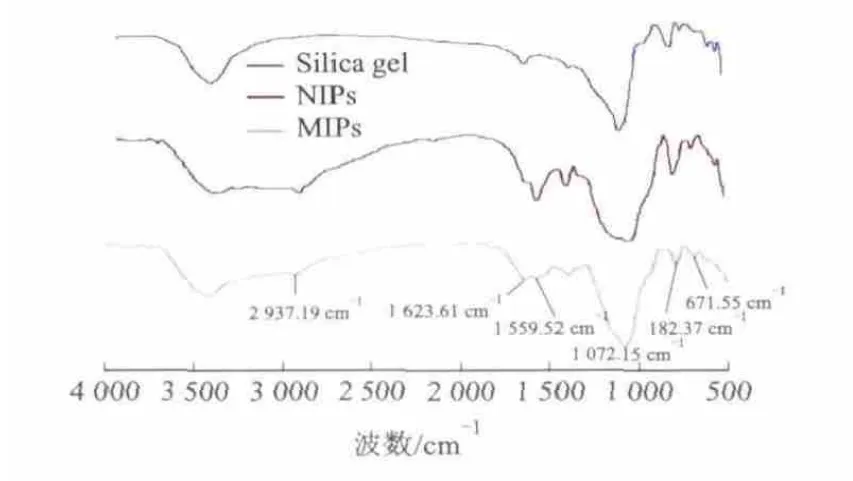
图2 活化硅胶、NIPs和MIPs的FT-IR
MIPs和NIPs在2937.15 cm-1处是—CH2反对称伸缩,1559.52 cm-1处是—NH2变形振动吸收峰,1035.36 cm-1处是—C—O的伸缩振动的宽吸收峰,这两处的特征吸收说明KH-550和TEOS在NIFMs中聚合成功.
元素分析表明,各元素质量分数活化硅胶中C为1.05%,H为0.48%;NIPs中 N为2.09%,C为12.21%,H为3.06%;MIFMs中N为1.12%,C为9.55%,H为3.06%.印迹后,3种元素的含量增加主要来源于KH-550和TEOS.MIPs中3种特征元素的含量均小于NIFMs,其中碳元素的差距最大,可能是MIPs在印迹过程中EGCG分子接枝在硅胶表面,进而被TEOS所包裹,经洗脱后,EGCG分子被洗脱下来在聚合物表面形成“空穴”.
2.2 吸附条件对聚合物吸附量的影响
吸附条件对吸附量的影响如图3所示.图3a为吸附溶剂对聚合物吸附量的影响.在相同溶剂的条件下,MIPs对EGCG的吸附量均大于NIPs,而且在去离子水中MIPs对EGCG的吸附量最大,故吸附溶剂选去离子水.图3b是pH对MIPs吸附量的影响.当pH 3~5时吸附量逐渐增加,pH为5时MIPs的吸附量达到最大值,随着pH值的升高反下降,因为EGCG在pH 5时以分子形式存在,能与功能单体充分作用,故吸附溶剂最佳pH为5.图3c为温度对MIPs吸附EGCG的影响.当温度在15~25℃时吸附量逐渐增 加,且25℃时吸附量达到最大,故最佳温度选25℃.
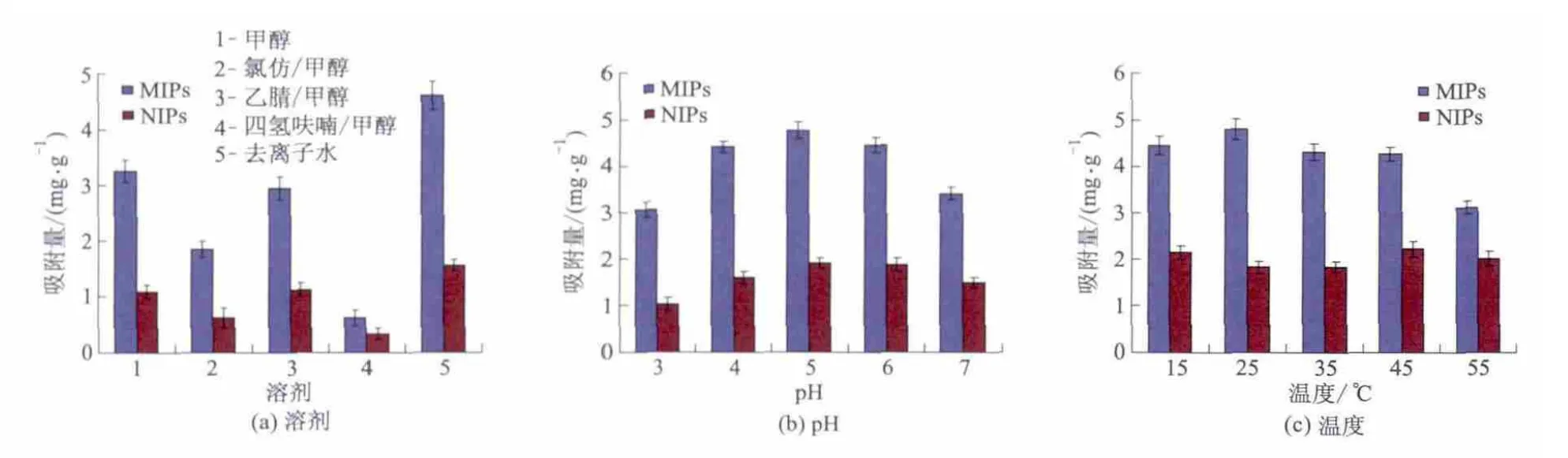
图3 吸附条件对吸附量的影响
2.3 等温吸附模型
聚合物对EGCG的等温吸附结果如图4所示.
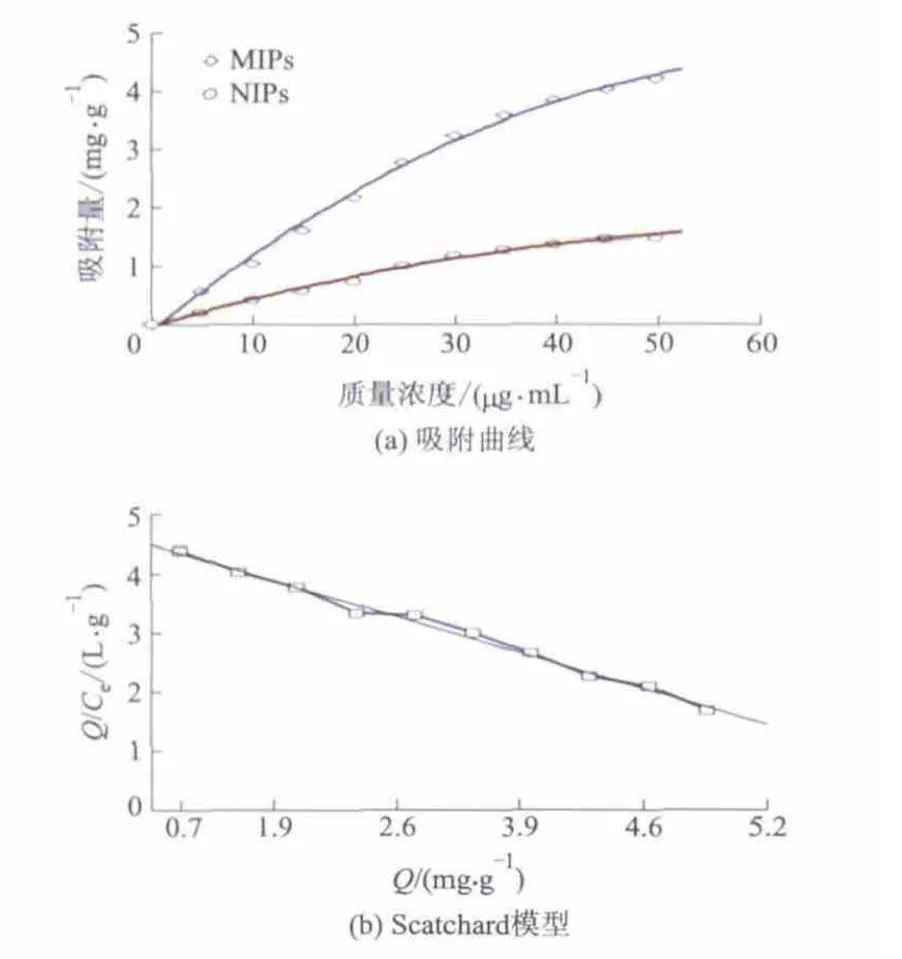
图4 聚合物对EGCG的等温吸附
在低质量浓度时,聚合物的吸附量与EGCG的质量浓度呈正相关.随EGCG质量浓度的增加,MIPs结构中的空间位点被充分“占据”.而在NIPs表面不存在有效的空间位点,与EGCG是非特异性作用力结合,故 MIPs的吸附量高于 NIPs(图4a).当EGCG 质量浓度为 50 μg·mL-1时,MIPs的吸附量是NIPs的2.8倍.依据Scatchard模型,以Q/Ce为纵坐标,Q为横坐标得拟合方程为Q/Ce=32.529-2.0359Q,相关系数R2=0.9912(图4b),表明MIPs对EGCG的吸附过程符合Scatchard模型.方程的斜率和截距分别表示Kd和Qmax.从方程可计算出MIPs对 EGCG 的 Qmax为15.98 mg·g-1,Kd为0.49.
2.4 聚合物的吸附动力学特性
聚合物的吸附动力学特性见图5.
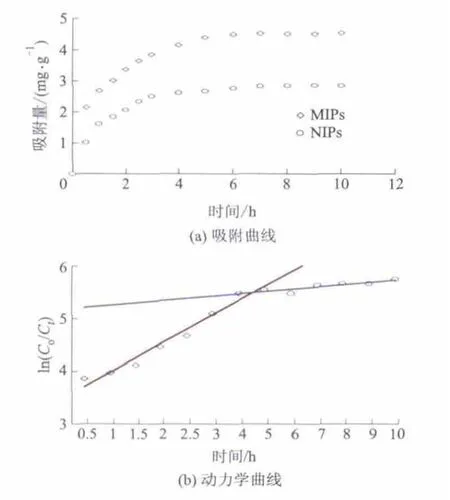
图5 聚合物的吸附动力学特性
由图5a所示,MIPs对EGCG的吸附在4 h时几乎达到吸附平衡;4 h后,吸附量增加缓慢.图5b是10 h内ln(C0/Ct)和t的相关动力学曲线.第1部分直线表明,0~4 h内MIPs对EGCG的快速吸附特性;第2部分直线表现出低的吸附速率,基本趋于平稳(4~10 h).表明MIPs在起始阶段对EGCG的吸附能力较强,待MIPs表面的空间位点充分吸附以后(达到饱和位点)曲线呈现平缓的趋势,吸附接近平衡.
MIPs对EGCG的吸附动力学准一级速率线性公式为ln(Qe-Qt)= -0.5296t+1.5046,R2=0.9971,k1为0.53 h-1;准二级动力学速率公式为t/Qt=0.1461t+0.1194,R2=0.9928,k2为0.19 g·(mg·h-1)-1.表明 MIPs对 EGCG 的吸附动力学过程更加符合准一级速率方程.
2.5 MIPs对EGCG和其类似物的选择性
MIPs对EGCG和其类似物的选择性见表1.
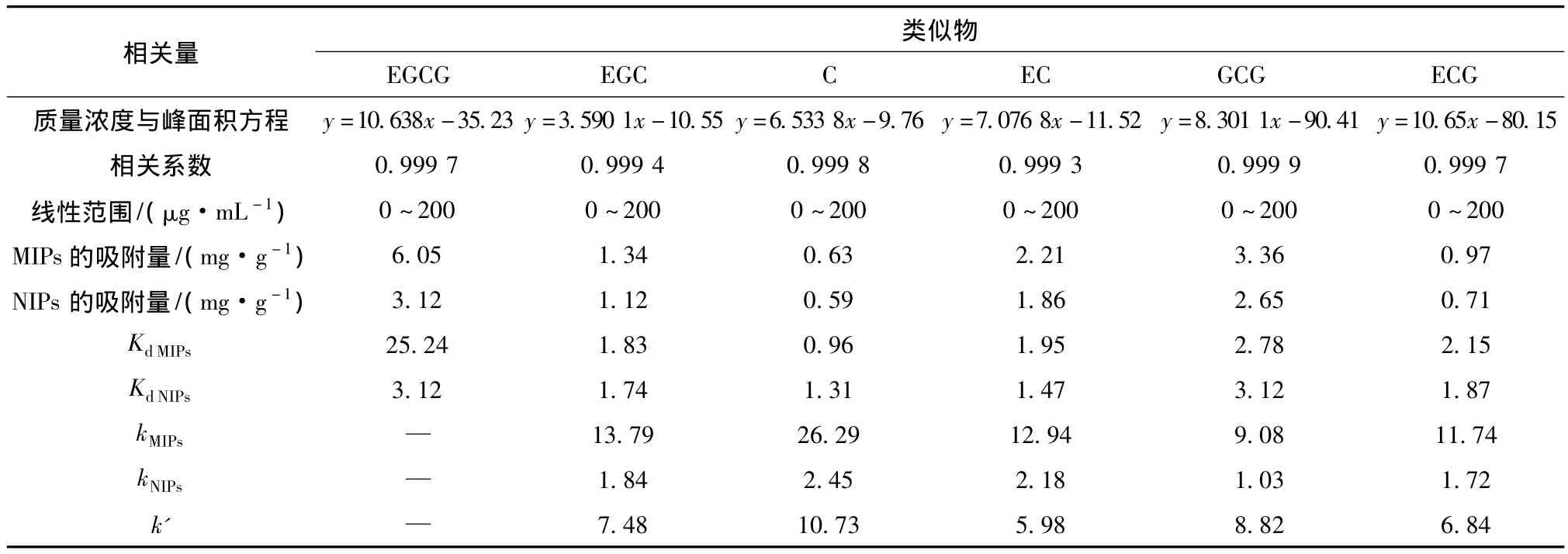
表1 MIPs对EGCG和其类似物的选择性
由表1可见MIPs对EGCG的Kd(25.24)均高于其他类似物,分别是EGC,C,EC,GCG和ECG的13,26,12,9 和 11 倍,说明 MIPs对 EGCG 分子具有优先吸附的特性,这与MIPs表面的空间位点有关;通过比较k值可以得出,k值越大,吸附剂的吸附能力越好,MIPs对其类似物的 k值分别是 EGC(13.79),C(26.29),EC(12.94),GCG(9.08)和ECG(11.74),即表示MIPs对EGCG的分离系数是其类似物的k倍,也说明MIPs对EGCG的吸附能力远高于其类似物.通过比较k'值可得出MIPs相对于NIPs的选择性大小,由表可见,k'值均大于1,说明MIPs相对于NIPs具有良好的选择性,而且MIPs对EGCG结构类似物的选择性大小的顺序为C,EGC,EC,ECG,GCG.通过制备的EGCG分子印迹聚合物MIPs能实现实际样品中EGCG的分离与富集.
3 结论
1)在相同溶剂的条件下,MIPs对EGCG的吸附量均大于NIPs,而且在去离子水中MIPs对EGCG的吸附量最大.
2)在低质量浓度时,聚合物的吸附量与EGCG的质量浓度呈正相关.MIPs对EGCG的吸附过程符合Scatchard模型.
3)MIPs对EGCG的吸附在4 h时可达到吸附平衡,MIPs对EGCG的吸附动力学过程更加符合准一级速率方程.
4)MIPs对EGCG的选择性系数Kd分别是其结构类似物 EGC,C,EC,GCG 和 ECG 的 13,26,12,9和11倍,表明MIPs对EGCG分子具有优先吸附的特性,其选择性大小的顺序为C,EGC,EC,ECG,GCG.
5)试验证明,制备的EGCG分子印迹聚合物MIPs吸附速度快,吸附效率高,能用于实际样品中EGCG的分离与富集.
References)
[1]Horie N,Hirabayashi N,Takahashi Y,et al.Synergistic effect of green tea catechins on cell growth and apoptosis induction in gastric carcinoma cells[J].Biological& Pharmaceutical Bulletin,2005,28(4):574-579.
[2]Osada K,Takahashi M,Hoshina S,et al.Tea catechins inhibit cholesterol oxidation accompanying oxidation of low density lipoprotein in vitro[J].Comparative Biochemistry and Physiology Part C,2001,128(2):153-164.
[3]Saffari Y,Sadrzadeh S M.Green tea metabolite EGCG protects membranes against oxidative damage in vitro[J].Life Sciences,2004,74(12):1513 -1518.
[4]Hernaez J F,Xu M,Dashwood R H.Antimutagenic activity of tea towards 2-hydroxyamino-3-methylimidazo[4,5-f]quinoline:effect of tea concentration and brew time on electrophile scavenging [J].Mutation Research,1998,402(1/2):299-306.
[5]Sen T,Moulik S,Dutta A,et al.Multifunctional effect of epigallocatechin-3-gallate(EGCG)in downregulation of gelatinase-A(MMP-2)in human breast cancer cell line MCF-7[J].Life Sciences,2009,84(7/8):194 -204.
[6]Elmets C A,Singh D,Tubesing K,et al.Cutaneous photoprotection from ultraviolet injury by green tea polyphenols[J].Journal of the American Academy of Dermatology,2001,44:425-432.
[7]贺敏强,宋承成,陈永强,等.芹菜素分子印迹聚合物的分子识别性能及机理[J].江苏大学学报:自然科学版,2010,31(5):596-600.He Minqiang,Song Chengcheng,Cheng Yongqiang,et al.Recognition property and mechanism of molecularly imprinted polymers of apigenin[J].Journal of Jiangsu University:Natural Science Edition,2010,31(5):596 -600.(in Chinese)
[8]史瑞雪,郭成海,邹小红,等.分子印迹技术研究进展[J].化学进展,2002,14(3):182-191.Shi Ruixue,Guo Chenghai,Zou Xiaohong,et al.The development of research in molecular imprinting technique[J].Progress in Chemistry,2002,14(3):182 -191.(in Chinese)
[9]孙瑞丰,罗 晖,隋洪艳,等.计量置换模型在分子印迹聚合物色谱分离中的应用[J].过程工程学报,2003,3(2):165 -170.Sun Ruifeng,Luo Hui,Sui Hongyan,et al.Application of stoichiometric displacement model for retention to the chromatographic separation by molecular imprinting polymer[J].The Chinese Journal Process Engineering,2003,3(2):165 -170.(in Chinese)
[10]吴 云,戈延茹,潘 如,等.SBA-15表面咖啡因分子印迹聚合物的制备及性能研究[J].江苏大学学报:医学版,2012,(22)2:151-154.Wu Yun,Ge Yanru,Pan Ru,et al.Preparation and characterization of mesoporous silica SBA-15-supported molecularly caffeine-imprinted polymers by surface molecularly imprinting technique[J].Journal of Jiangsu University:Medicine Edition,2012,(22)2:151 -154.(in Chinese)
[11]Carboni D,Flavin K,Servant A,et al.The first example of molecularly imprinted nanogels with aldolase type I activity[J].Chemistry-A European Journal,2008,14(23):7059-7065.
