镉在方斑东风螺组织内的蓄积及镉的毒性:水相暴露与食物相暴露比较
2013-08-20薛明柯才焕
薛明,柯才焕
1.广东海洋大学水产学院,湛江524025
2.厦门大学海洋与地球学院,厦门361005
镉(cadmium,Cd)作为一种生物体非必需重金属,痕量镉就有可能对生物体产生毒害效应,大部分动物可同时从水体与食物2个途径吸收Cd[1-2],所以水相或食物相均有可能是动物体Cd蓄积的主要来源,这取决于物种种类、金属种类及饵料类型[3]。水生动物体常通过鳃组织过滤大量海水,通过这种途径溶解态重金属得以在其体内浓缩;另一方面,动物体也可以通过摄食积累颗粒态重金属,即通过营养传递在生物体内蓄积[4-6],如 Pierron 等[7]报道野外或室内模拟状态下营养传递均是Cd在欧洲鳗鲡(Anguilla anguilla)体内积累的重要途径。过去几十年中,多数学者均是研究水环境中重金属对生物体的毒性效应[3-4],然而越来越多的证据表明,食物相暴露不仅在重金属积累方面有重要贡献,同时在毒性方面也不容忽视[6]。如有研究发现,虹鳟(Oncorhynchusmykiss)在暴露于食物相Cd后生长速度下降[8]。但关于水相与食物相2种Cd暴露途径对不同动物体组织蓄积能力及毒性效应的比较研究还较为少见,而这对水质标准的重新评估有重要意义[3]。
较多研究表明,腹足类动物的金属累积能力很强,是水体或沉积物污染重要的指示生物[9],如Kang等[10]报道韩国昂山湾短玉黍螺(Littorina brevicula)体 Cd浓度达0.48~27.11 μg·g-1(以生物体干质量计),且与海水中Cd浓度成正相关,因此可作为该海区Cd污染的指示物种;Daka等[11]的暴露实验表明,泥螺(Tympanotonus fuscatus)可以很好地指示Cd污染。方斑东风螺(Babylonia areolata)分布广,活动范围小,生命周期长,易采集,因此适合探索其作为重金属污染的指示种的可行性。同时该螺又是正兴起的优良养殖种类,但近年来养成时大规模死亡时有发生,具体原因尚未探明,但海水污染包括重金属毒性影响螺体正常生理活动无疑是重要诱因之一。因此本实验拟在相同水体Cd浓度下,通过水体直接暴露与饵料预暴露后再摄食2种途径,研究水相与食物相Cd暴露对螺组织Cd积累、MT诱导、肝胰脏脂质过氧化水平、螺内脏团中Cd的亚细胞水平分布及净化后螺组织中Cd排出的影响,以期阐明螺体Cd蓄积的主要途径与毒性效应,为该螺的健康养殖与安全食用提供理论指导,并可丰富海产腹足类的金属毒理学数据。
1 材料与方法(M aterials and methods)
1.1 实验材料
僧帽牡蛎(Saccostrea cucullata),壳长6~7 cm,购自湛江市水产品批发市场,以下简称牡蛎,洗净壳表附着生物后暂养于室内。方斑东风螺购自广东湛江东海岛养殖场,选取同池同批孵化幼体培育而成的个体,先在水簇箱中驯化2周,每天下午4∶00投喂1次新鲜牡蛎饵料,驯化摄食以1 h内吃完为宜,将剩余饵料移走,临实验前2 d停止投喂。
1.2 主要仪器与试剂
日本岛津AA6800原子吸收分光光度计,美国OptimaL-100XP超速离心机,瑞士Polytron-PT-2100组织匀浆机,德国Centrifuge5810R高速冷冻离心机,美国Cary50紫外可见分光光度计。Cd元素标准物(1 000 mg·L-1)和扇贝成分分析标准物质(GBW10024)购自国家标准物质研究中心;氯化镉,纯度99.9%,购自百灵威科技有限公司;福林-酚试剂、牛血红蛋白、牛血清白蛋白和PMSF(苯甲基磺酰氟)购自生工生物工程(上海)股份有限公司;质量分数为10%的磷酸二氢铵购自美国PerkinElmer仪器有限公司。
1.3 实验方法
预暴露牡蛎的获得:在水族箱(0.58 m×0.45 m×0.35m)内将僧帽牡蛎暴露于含Cd2+(100μg·L-1)的水体中,期间不投喂,连续充氧,自然光照。每隔2 d换1/3含相同Cd浓度的海水,并随机取3只牡蛎测其软体部Cd浓度,第14天达到平衡时结束,除取3只牡蛎供Cd浓度测定外,其余保存于-20℃作为饵料。
实验设水体Cd暴露(水相组)、饵料Cd暴露(食物相组)2个处理组,1个对照组,每组3个平行,每个平行1个水族箱,盛70 L自然砂滤海水,箱底铺约5 cm厚的细沙。然后每箱放入活力好、规格相近的螺60只,海水温度(27.1±0.5)℃,盐度31.3,pH 值 7.9,溶氧 >6.5 mg·L-1。
水相组是将螺放入Cd2+浓度为100μg·L-1的水体,投喂牡蛎;食物相组是将螺放入清洁水体,投喂Cd预暴露的牡蛎。每天下午4:00按约6%螺质量投喂1次,1 h后将残饵移走并称量质量。30 d暴露结束后分别将水相组换成清洁砂滤海水、食物相组饵料换成天然牡蛎,进入15 d净化期。实验起始随机取螺30只供各项指标测定,然后分别于暴露第10、20、30天以及净化第8、15天从各组各箱中随机取9只,对照组同时取样。将螺用双蒸水冲洗,滤纸吸干,冰上解剖仔细分离出螺体鳃、胃肠道(胃与直肠)、肝胰脏、足肌4种组织,因胃肠道与鳃组织样品量较少,所以Cd与MT含量测定是每箱3只螺取胃肠道混合作为1个样品,每箱9只螺取鳃混合作为1个样品;肝胰脏与足肌MT含量、肝胰脏MDA水平及螺内脏团中Cd的亚细胞分布测定均是每次每箱单只螺取样,装于聚乙烯样品袋内,液氮速冻后-80℃保存备用。
1.4 样品测定
1.4.1 Cd 浓度测定
采用湿法消化法,螺组织样品置80℃烘干至恒重,于三角烧瓶中按100 g·L-1加入 V(HNO3)∶V(HClO4)=4∶1混合液后,加盖室温静置12 h,之后再加相同体积的混合酸,放置可控温的电热板上,在通风橱中温度升至80℃,加热2 h,然后升温至110℃,保持微沸状态,待棕色气体冒尽,溶液澄清透明,继续加热至HClO4白烟冒尽后,消煮至近干,冷却后用少量超纯水淋洗三角瓶内壁若干次,淋洗液一并移入50 mL容量瓶,并定容至标线;同时制备样品空白与扇贝成分分析标准物质GBW10024,适当稀释后用岛津AA6800型原子吸收光谱仪测定,石墨炉法工作条件:波长228.8 nm;光谱带宽0.5 nm;灯电流 8.0 mA;原子化程序:干燥 100℃、20 s,灰化600℃、20 s,原子化 1 850℃、3 s;基体改进剂:1% 磷酸二氢铵(质量分数)。水样Cd浓度测定参照国标GB17378.4 进行。
1.4.2 MT 浓度测定
MT测定采用镉/血红蛋白饱和法,参照David和Brain[12]并略加改进。样品解冻后用双蒸水洗去粘液,滤纸吸干后按250 g·L-1加入预冷匀浆缓冲液(20mmol·L-1Tris-HCl,pH=8;0.15mol·L-1NaCl;10 mmol·L-1β-巯基乙醇),剪碎后用组织匀浆机冰浴匀浆,匀浆后于12 000×g、4℃离心15 min,分离出上清液。取上清液0.5 mL加入0.5 mL 1 mg·mL-1的Cd溶液,充分混合后室温下孵育10 min,加入0.2 mL 20 g·L-1牛血红蛋白混合,冰浴5 min后放入沸水浴中加热2 min,冷却后于10 000×g、4℃离心10 min;重复加牛血红蛋白以后的步骤2次。取上清液加体积分数为70%硝酸消化、定容,用石墨炉原子吸收光谱法测定Cd浓度。
MT分子量以6 500 Da计,因1 mol的MT可结合7 mol的Cd(原子量为112.4),所以MT浓度(μg·g-1湿质量)计算如下:
MT浓度(μg·g-1)=(CCd×S ×6500×V)/(G×7×112.4×N)
式中,CCd为定容液中 Cd的浓度(μg·mL-1),S为定容体积(mL),G为螺体软组织湿质量(g),V为匀浆离心后的上清液体积(mL),N为匀浆离心后的取样体积(mL)。
1.4.3 Cd 的亚细胞分布测定
参照Wallace等的方法[13],先分离出螺内脏团的5个亚细胞组分:富含金属颗粒(metal rich granule,MRG)、细胞碎片(cellular debris)、细胞器(organelles)、热敏感蛋白(heat sensitive protein,HSP)、类金属硫蛋白(metallothionein like protein,MTLP),测定各组分含Cd量,再计算各组分Cd含量占总体Cd含量的百分比。具体如下:将解冻后的样品按250 g·L-1加入预冷匀浆液(20 mmol·L-1Tris-HCl,2 μmol·L-1PMSF,pH 8.0),剪碎后用组织匀浆机冰浴匀浆5 min。然后4℃、1 500×g离心15 min。沉淀P1含有细胞碎片和组织碎片,上清液S1含有细胞器和可溶性组分。沉淀 P1用4 mL 1 mol·L-1NaOH重悬,60℃处理10 min,5 000×g离心获得2个组分,分别是沉淀P2(MRG)和上清液S2。上清液S1经4℃、100 000×g超速离心1 h,获得沉淀P3和上清液S3(胞质溶胶)。然后,上清液S3经80℃热处理10 min,冰浴1 h,在4℃、64 000×g高速离心10min,获得沉淀P4(HSP)和上清液S4(MTLP)。操作中除了热处理和离心外,样品须始终处于冰浴中。各分离组分于80℃烘干、称量质量,测定Cd浓度,方法同上 1.4.1。
1.4.4 MDA 含量测定
MDA(malondialdehyde,丙二醛)含量测定采用TBA(thibabituric acid)法,每实验组测定3只螺的肝胰脏组织,解冻后按100 g·L-1加入预冷匀浆缓冲液(0.154 mol·L-1KCl,0.01 mol·L-1Tris-HCl,pH 7.4),玻璃匀浆器冰浴中匀浆,匀浆液在4℃、10 000×g离心20 min,所得上清液根据需要稀释2~10倍,采用试剂盒测定(购自南京建成生物工程研究所),单位为nmol·mg-1。蛋白质含量用福林-酚法测定,以牛血清白蛋白为标准。
1.5 数据分析
数据均以平均值±标准差(Mean±SD)形式给出;对百分率进行反正弦平方根转换,在进行正态性检验后,数据总体差异性用单因素方差分析(ANOVA),当差异显著时,用Duncan's多重比较分析组间差异显著性;用t-检验分析对照组与处理组间差异;统计分析用SPSS13.0 软件进行,显著水平为 P <0.05。
2 结果(Results)
2.1 水体与饵料中的Cd对螺生长参数的影响
水相组 Cd 浓度实测为(96.53 ±17.41)μg·L-1,对照组与食物相组的水体Cd浓度均很低,分别为(0.21 ±0.08)和(0.25 ±0.05)μg·L-1;对照组与水相组饵料牡蛎体内的 Cd浓度为(0.92±0.07)μg·g-1,而食物相组的牡蛎体内Cd浓度为(34.56±4.29)μg·g-1。如表1所示,各组螺在暴露与净化实验结束时的平均壳长、湿质量及摄食率间均无显著差异(P>0.05),其中食物相组的摄食率略高,说明螺对Cd污染的牡蛎饵料没有回避反应。
2.2 螺各组织对Cd的蓄积
螺鳃、胃肠道、肝胰脏及足肌的Cd浓度变化如图1所示。可见暴露期间,第10天时水相组螺鳃中Cd 浓度(1.83 μg·g-1)即显著高于对照组(0.62 μg·g-1)(P<0.05),其后迅速升高,第30天时为对照组的12.45倍;而食物相组Cd蓄积缓慢,但第30天时也显著升高(P< 0.05),为对照组的2.51倍(图1A)。食物相组螺胃肠道中Cd浓度(10.45μg·g-1)在第10天时极显著高于对照组(1.26μg·g-1)(P<0.05),但后期则逐渐下降,但第30天时仍显著高于对照组(P< 0.05),为对照组的7.05倍;水相组螺胃肠道中Cd积累较慢,第20天时也显著高于对照组(P<0.05),第30天时上升为对照组的4.81倍(图1B)。2个处理组螺的肝胰脏中Cd浓度在暴露期间均呈逐渐上升趋势,第30天时分别达到7.65和9.37 μg·g-1,为对照组的 6.65 和 8.14 倍(图1C)。而2个处理组螺的足肌Cd浓度在实验中与对照组间始终差异不显著(P>0.05)(图1D)。进入净化期,除第8天时水相组螺的肝胰脏Cd浓度较暴露结束时高约4.71%外,其他均呈下降趋势;第15天时除食物相组螺鳃中Cd浓度与对照组差异不明显外(P>0.05),其余仍显著高于对照组(P<0.05)。
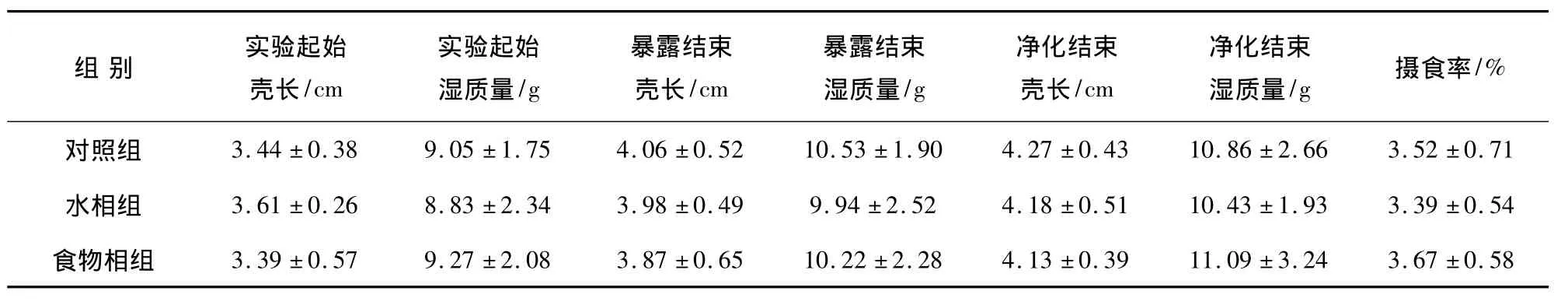
表1 Cd对方斑东风螺的壳长、体质量及摄食率的影响Table 1 Effect of Cd on shell length,total wetmass and feeding rates of B.areolata

图1 实验期间方斑东风螺鳃(A)、胃肠道(B)、肝胰脏(C)和足肌(D)中Cd浓度变化Fig.1 Changes of Cd concentrations in gills(A),gastrointestinal tract(B),hepatopancreas(C)and footmuscle(D)of B.areolata during experiment period
2.3 螺各组织MT的诱导量
表2所示为实验中螺的各组织MT含量变化。可见10 d水相暴露后,鳃中MT浓度较对照组显著上升,第20天时进一步升高,第30天时有所回落但仍显著高于对照组(P<0.05);食物相组螺鳃中MT浓度仅在第20天时显著高于对照组(P<0.05),暴露

表2 实验期间方斑东风螺鳃、胃肠道、肝胰脏和足肌中MT浓度Table 2 MT concentrations in tissues of gill,gastrointestinal tract,hepatopancreas and footmuscle of B.areolata during experiment period(μg·g-1)
后期及净化期内均与对照组间无明显差异(P>0.05)。螺胃肠道中MT浓度在2个处理组中尽管有波动,但与对照组间差异不显著(P>0.05)。而暴露期内螺肝胰脏中MT浓度均持续上升,第20天时即显著高于对照组(P<0.05);2种途径相比,水相组螺的MT含量始终高于相应的食物相组;进入净化期,各组织MT含量均迅速下降至对照组水平(P>0.05)。
因足肌中Cd蓄积与MT诱导量变化不明显,故以胃肠道、鳃、肝胰脏组织中Cd浓度为自变量x、MT浓度为因变量y,综合分析各组织中Cd含量与MT诱导量之间的相关性,发现在胃肠道、鳃中两者间无明显相关性,而肝胰脏中两者间呈显著的线性正相关:y=13.266x+56.221,r2=0.4733,P < 0.05。
2.4 螺肝胰脏中MDA水平
表3所示为实验中螺的肝胰脏MDA水平。可见暴露早期食物相组螺肝胰脏中MDA含量与对照组无显著差别(P>0.05),第30天时较对照组显著上升(P<0.05);而水相组螺的肝胰脏MDA含量第10天即显著高于对照组(P<0.05),且随着暴露时间而上升。净化期内,食物相组第8天时MDA水平即回落至对照组状态,而水相组仍显著高于对照组(P<0.05),但第15天时与对照组间也无显著差异(P>0.05)。

表3 实验期间方斑东风螺肝胰脏MDA含量Table 3 MDA concentrations in hepatopancreas of B.areolata during experiment period(nmol·mg-1)

图2 水相与食物相2种途径Cd暴露30 d后再净化15 d过程中方斑东风螺内脏团中Cd的亚细胞分布变化Fig.2 Changes of subcellular Cd distribution in visceralmass of B.areolata during 15 d depuration period after 30 d exposure to aqueous and dietary Cd
从图2可见,MRG与细胞碎片亚细胞组分是螺内脏团Cd的主要储存库,因此Cd倾向结合在不可溶性组分中。实验中对照组螺各组分Cd的百分比保持稳定状态,相比对照组,水相暴露30 d后螺内脏团的细胞器、HSP和MTLP组分中Cd的百分比均有所上升,尤其HSP组分中Cd的百分比明显上升;而细胞碎片中比例相应下降,由对照组的21.9%减少至15.7%,同时MRG中Cd的百分含量也略有增加;食物相暴露后除MRG中Cd的百分比略有减少外,其余各组分的变化趋势与水相组相似,但幅度较小,尤其是HSP中的百分比较对照组无明显变化,但 MTLP中 Cd的百分比(20.1%)较水相组(18.4%)提高。净化后,2种暴露途径螺内脏团的细胞器与MTLP中Cd的百分比均有所下降,而MRG与细胞碎片中Cd的百分比略有上升;但HSP中Cd的百分比在水相组净化后下降,但食物相组略有增加。
3 讨论(Discussion)
3.1 螺各组织特异性Cd积累
本研究表明,Cd在螺各组织产生了特异性积累,如第10天食物相组螺胃肠道Cd浓度即显著增加,但随后呈下降趋势,因此这种蓄积是短暂的;水相组螺胃肠道中Cd浓度也缓慢增加,说明螺为了维持渗透自稳态而摄入海水也能在胃肠道中蓄积一定量的Cd。鳃是Cd进入水生动物体的主要位点与临时贮存部位,但通过鳃分泌也是动物排出体内Cd的重要途径[3],因此最终鳃中Cd浓度取决于Cd吸收、分泌和转移等这些过程相互作用的结果,实验中水相组螺鳃中Cd浓度迅速上升,这可归因于鳃与水体直接接触,通过顶细胞膜快速吸收溶解态Cd;食物相暴露后期(30 d)螺鳃中Cd浓度也显著高于对照组,因食物中Cd泄漏至水体的量可忽略不计,推测可能是其他组织Cd通过基侧细胞膜逐渐转运至鳃,通过鳃分泌而暂时在鳃中储存的原因。螺肝胰脏中Cd的积累早期较慢,但随暴露时间延长逐渐增加,第30天时2种途径中均高于其他组织,表明胃肠道、鳃等组织吸收的Cd通过再分配转移至肝胰脏[10],因此肝胰脏是螺贮存Cd的主要器官。而Koyama等[14]也报道莱氏拟乌贼(Sepioteuthis lessoniana)在Cd 浓度为0.2mg·L-1水体中单独暴露14 d,或经过15 d的水体与饵料同时暴露后,其肝脏中Cd浓度与比例均最高。
除螺鳃中Cd浓度在水相暴露高于食物相外,其他3个组织均是从食物摄入高于水体,但鳃组织所占螺整体的比重极小,而胃肠道、肝胰脏与足肌所占螺体比重达80%以上,可见食物Cd的摄取对方斑东风螺的重要性,原因可能是Cd在饵料牡蛎中以有机结合态存在,螺摄入后易经消化系统吸收,而水体中Cd主以无机水合态离子存在,与除螺鳃外其他表皮细胞接触后不易被吸收进入血淋巴;Wang和Ke[15]用放射性同位素示踪技术也得出摄食是波部东风螺(Babylonia formosae)与小塔织纹螺(Nassarius teretiusculus)蓄积Cd的主要途径;但Blackmore[16]报道疣荔枝螺(Thais clavigera)对污染饵料藤壶或贻贝的摄食量高于同种的无污染饵料,但56 d后个体间Cd浓度无显著性差异,从而摄食不是该螺蓄积Cd的主要途径;可见不同腹足类吸收与同化Cd的途径存在差异。
3.2 螺组织中MT的表达
本研究中螺不同组织MT诱导表达量不同,可能与其不同组织中MT执行不同的生理功能也有关,如 Dallinger等[17]报道陆生蜗牛(Helix pomatia)中肠腺MT几乎只含Cd,Zn和Cu含量甚微,外套膜MT却主要结合Cu,表明中肠腺MT基本功能是Cd解毒,而外套膜MT则主要参与血蓝蛋白生物合成中的Cu调节作用。而螺肝胰脏中随着Cd的蓄积,MT浓度也逐渐增加,与较多动物相似,与该类蛋白结合是螺解除毒性的重要途径[2]。但2种途径相比,食物相组的螺肝胰脏MT表达量低于水相途径,但Cd的蓄积更高,内脏团亚细胞组分MTLP中Cd的百分比也更高;Dang和Wang[18]也报道花身鱼在水相与食物相Cd暴露处理后,亚细胞分布分析发现其肝脏中MT结合11% ~41%的Cd,而MTLP结合超过57%的Cd;本研究中螺对食物相Cd暴露的响应可能与花身鱼相似,即除MT外,还有其他类金属硫蛋白担负着Cd的螯合。另外,MT除了参与细胞内Cd的螯合解毒外,在机体抗氧化方面也有重要的作用,如在哺乳动物中,MT能够清除因Cd暴露胁迫而产生的自由基,以修复细胞损伤[19];实验中水相暴露时螺肝胰脏中MT浓度较高,可能也与其中更强的氧化胁迫反应有关。
3.3 2种暴露途径对螺毒性差异
实验中未观察到螺的死亡现象,2个处理组螺的终末壳长、体质量间均无明显差异,可见不同暴露方式对螺的存活与生长未造成显著影响。但一些生化水平指标比监测重金属压力的常规指标具有更高敏感性,如脂质过氧化(LPO)终产物丙二醛(MDA)常被用以监测Cd对生物体的氧化胁迫状态[20]。本研究水相组螺的肝胰脏MDA含量第10天即较对照组显著上升,且始终高于同期的食物相组MDA水平,因此水相Cd暴露对螺肝胰脏造成的氧化损伤高于食物相。Company等[20]也报道深海热液喷口的贻贝(Bathymofiolus azoricus)当暴露于0.9 μmol·L-1水体Cd时,鳃组织出现显著的脂质过氧化,但当暴露于食物相90μg·g-1的Cd时,则无脂质过氧化作用产生,这表明相对水体Cd来说,食物相Cd毒性较低。因此,水相组较高的毒性可能是溶解态Cd经螺鳃及表皮吸收后直接进入螺血淋巴,不先经肝胰脏生物转化,故毒性较明显;且Cd被转运至各器官组织后,部分被固定下来,不能全部到达肝胰脏;而经螺胃肠道吸收的Cd可迅速通过门静脉进入肝胰脏,先经不同程度化后才进入血淋巴,这种作用机制可能与高等动物相似[19]。
亚细胞分布研究是基于重金属对生物体的毒性由蓄积于体内金属含量及在亚细胞水平分布决定的[21],即进入生物体内的重金属在亚细胞水平上与5个组分结合,其中MRG、细胞碎片、细胞器是细胞不可溶组分,HSP、MTLP是细胞可溶组分;同时细胞器与HSP又是金属敏感组分,MTLP与MRG是金属解毒组分,而细胞器、HSP与MTLP是能够沿着食物链传递给摄食者组分,因此Cd的亚细胞分布研究有助于深入理解其在生物体细胞积累的具体位置与毒性[13]。从Cd在螺内脏团亚细胞组分中的分布来看,水相暴露30 d后,金属敏感组分细胞器与HSP中Cd的结合百分比均有所上升,两者之和由对照组的19.4%增加至23.1%;而食物相组只有细胞器中Cd的百分比小辐上升(0.4%),可见水相组与金属敏感组分结合比例较食物相组高,而金属脱毒组分MTLP中Cd的百分比则是水相组(18.4%)低于食物相组(20.1%),因此水相组螺肝胰脏细胞受损伤程度相对更大。
净化后,2种途径螺内脏团不可溶组分中Cd的百分比较暴露结束时均提高,水相组、食物相组分别由76.4%、75.3% 升至 80.8%、78.9%,表明 Cd 可能从其生物活性位点转移到生物脱毒位点,因此螺对残留于体内Cd的解毒形式主要是与MRG、细胞碎片组分螯合蓄积于体内,这与 Pan和 Wang[22]报道华贵栉孔扇贝(Chlamys nobilis)对2种暴露途径吸收的Cd在体内去毒方式相似。而Choi等[23]报道南极帽贝(Laternula elliptica)在水体Cd 50μg·L-1暴露14 d后鳃中蓄积的Cd主要与细胞不可溶组分结合,而消化腺细胞中可溶胞液与不可溶颗粒结合的Cd相当,因此两组织采取的Cd解毒策略不同,导致不同物种及同一物种不同组织在亚细胞水平去毒机制上的差异。
3.4 净化期螺各组织Cd排出率差异
本实验中螺经15 d净化后,各组织Cd排出率不同,水相暴露后高低顺序为:鳃(78.43%)、胃肠道(19.41%)、足肌(16.67%)、肝胰脏(2.35%),食物相则为:鳃(47.66%)、足肌(40.00%)、胃肠道(34.21%)、肝胰脏(15.37%);可看出螺组织在 Cd暴露时吸收越快,净化时排出率也更高,如暴露结束时水相组螺鳃中Cd浓度是食物相组的5.74倍,净化后水相组螺鳃的排出率(78.43%)远高于食物相组(47.66%);其余3组织中蓄积的Cd浓度均是食物相组较高,相应的净化时排出率也更高;同时也说明食物相Cd在螺净化时易排出体外,而水相Cd则更容易蓄积在螺体内,且水相组螺除鳃外各组织的排出率低于相关报道,如王凡等[24]报道染毒18 d栉孔扇贝(C.farreri)放入清洁海水中,11 d净化后,其鳃、肌肉和内脏团中Cd的排出率分别为65.41%、66.18%和38.11%;尤其是水相暴露后进入净化期第8天时,螺的肝胰脏中Cd浓度不但没有降低,反而较暴露结束时上升4.71%,这说明短期净化过程中,其他组织的Cd通过再分配进入肝胰脏,这与Koyama等[14]报道的乌贼在水体Cd浓度为0.2mg·L-1中暴露14 d后移入清洁海水中净化时,肝脏中Cd浓度在净化第4天时反而较暴露结束时高相似。这种较低的排出率可归因于Cd诱导螺体产生了大量的Cd-MT复合物,使Cd被贮存在螺体内,从而增加了营养传递时Cd的生物可利用性,因此,Cd在腹足类体内的高度蓄积必须引起人们的重视,尤其是在螺类等海鲜食物深受人们喜爱的沿海地区[25]。
[1] 范文宏,段勇,林爽,等.水体沉积物结合态镉对大型溞(Daphniamagna)的生物毒性研究[J].生态毒理学报,2009,4(4):544-551 Fan W H,Duan Y,Lin S,etal.The biotoxicity of cadmium associated with fresh-water sediment to the Daphniamagna[J].Asian Journal of Ecotoxicology,2009,4(4):544-551(in Chinese)
[2] 张高川,张春华,葛滢.镉胁迫下蚯蚓金属硫蛋白氧化修饰的研究[J].生态毒理学报,2010,5(4):558-562 Zhang G C,Zhang CH,Ge Y.Oxidativemodification of metallothionein in earthworm under Cd stress[J].Asian Journal of Ecotoxicology,2010,5(4):558-562(in Chinese)
[3] Wang W X,Fisher N S.Delineatingmetalaccumulation pathways for marine invertebrates[J].Science of the Total Environment,1999,237-238:459-472
[4] BaudrimontM,Andres S,Durrieu G,et al.The key role ofmetallothioneins in the bivalve Corbicula fluminea during the depuration phase after in situ exposure to Cd and Zn[J].Aquatic Toxicology,2003,63(2):89-102
[5] Xu Y,Wang W X.Exposure and potential food chain transfer factor of Cd,Se and Zn in marine fish Lutjanus argentimaculatus[J].Marine Ecology Progress Series,2002,238:173-186
[6] Seebaugh D R,Daisuke G,WallaceW G.Bioenhancement of cadmium transfer along a multi-level food chain[J].Marine Environmental Research,2005,59(5):473-491
[7] Pierron F,Baudrimont M,Lucia M,et al.Cadmium uptake by the European eel:Trophic transfer in field and experimental investigations[J].Ecotoxicology and Environmental Safety,2008,70(1):10-19
[8] Ng T Y T,Wood CM.Trophic transfer and dietary toxicity of Cd from the oligochaete to the rainbow trout[J].Aquatic Toxicology,2008,87(1):47-59
[9] Rainbow P S.Biomonitoring of heavy metal availability in themarine environment[J].Marine Pollution Bulletin,1995,31(4-12):183-192
[10] Kang SG,ChoiM S,Oh IS,etal.Assessmentofmetal pollution in Onsan Bay,Korea using Asian periwinkle Littorina brevicula as a biomonitor[J].Science of the Total Environment,1999,234(1-3):127-137
[11] Daka E R,Oweisana I I,Braide SA.Accumulation of heavymetals from single and mixed metal solutions by the gastropod mollusc Tympanotonus fuscatus linnaeus from a Niger Delta estuary:Implications for biomonitoring[J].African Journal of Biotechnology,2006,5(20):1954-1962
[12] David L E,Brain F T.Evaluation of the Cd/hemoglobin affinity assay for the rapid determination ofmetallothionein in biological tissues[J].Toxicology and Applied Pharmacology,1982,66(1):134-142
[13] WallaceW G,Lee BG,Luoma SN.Subcellular compartmentalization of Cd and Zn in two bivalves.I.Significance ofmetal-sensitive fractions(MSF)and biologically detoxified metal(BDM)[J].Marine Ecology Progress Series,2003,249:183-197
[14] Koyama J,Nanamori N,Segawa S.Bioaccumulation of waterborne and dietary cadmium by oval squid,Sepioteuthis iessoniana ,and its distribution among organs[J].Marine Pollution Bulletin,2000,40(11):961-967
[15] Wang W X,Ke C H.Dominance of dietary intake of cadmium and zinc by two marine predatory gastropods[J].Aquatic Toxicology,2002,56(3):153-165
[16] Blackmore G.Field evidence ofmetal transfer from invertebrate prey to an intertidal predator,Thais clavigera(Gastropoda:Muricidae)[J].Estuarine,Coastal and Shelf Science,2000,51(2):127-139
[17] Dallinger R,Berger B,Hunziker P,et al.Structure and Function of Metallothionein Isoforms in Terrestrial Snails[M].Klaassen CD.Metallothionein IV.Basel:Birkhauser Verlag,1999:173-178
[18] Dang F,Wang W X.Assessment of tissue-specific accumulation and effects of cadmium in amarine fish fed contaminated commercially produced diet[J].Aquatic Toxicology,2009,95(3):248-255
[19] 印木泉.遗传毒理学[M].北京:科学出版社,2002:55-70
[20] Company R,Serafim A,Bebianno M J,et al.Effect of cadmium,copper and mercury on antioxidant activities and lipid peroxidation in the gills of the hydrothermal ventmussel Bathymodiolus azoricus[J].Marine Environmental Research,2004,58(2-5):377-381
[21] Wang W X,Rainbow P S.Subcellular partitioning and the prediction of cadmium toxicity to aquatic organisms[J].Environmental Chemistry,2006,3(6):395-399
[22] Pan K,Wang W X.The subcellular fate of cadmium and zinc in the scallop Chlamys nobilis during waterborne and dietarymetal exposure[J].Aquatic Toxicology,2008,90(4):253-260
[23] Choi H J,Ji J,Chung K H,et al.Cadmium bioaccumulation and detoxification in the gill and digestive gland of the Antarctic bivalve Laternula elliptica[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2007,145(2):227-235
[24] 王凡,赵元凤,吴益春,等.栉孔扇贝对Cd的累积和排出[J].湛江海洋大学学报,2005,25(4):95-98
[25] 王文雄,潘进芬.重金属在海洋食物链中的传递[J].生态学报,2004,24(3):599-604 Wang W X,Pan J F.The transfer of metals in marine food chains:A review [J].Acta Ecologica Sinica,2004,24(3):599-604(in Chinese) ◆
