三(2-羟基-苯甲醛)乙醇胺三足配体汞(Hg)配合物的合成、结构及其与DNA 相互作用的研究
2013-08-20陈凤娟朱永泽朱锐伦刘国旗彭万通陈国举曾正志
陈凤娟 朱永泽 朱锐伦 刘国旗 马 骞 李 洁 彭万通 陈国举 曾正志
(1 兰州大学化学化工学院,兰州730000)
(2 兰州金川新材料科技股份有限公司,兰州 730101)
0 前 言
汞(Hg)是一种剧毒、有腐蚀性并且对环境有害的元素。一些汞盐(如,HgCl2)能够充分挥发并以气体形式存在[1]。汞(Hg)可以通过空气、水、食品、疫苗、化妆品等多种途径传递,并且能够在环境中持续存在、在食物链中累积,对于环境以及生物体都产生了严重的危害,这引起了人们强烈的关注[2]。
科研工作者对具有活泼性质的分子自组装受体做了深入的研究,发现其具有多种潜在的应用价值,例如分子及药物的传递[3],分子催化[4]等。三足配体由于具有特殊的半刚性结构,在与金属配位时能够表现出特有的选择性配位能力,近些年来已成为热门的离子选择性受体。
氯化汞(HgCl2)在溶液中以分子形式存在时,很容易与氮(N)、氧(O)等配位原子发生配位[5]。我们设计合成了一些含有N、O 等配位原子的三足配体,作为汞离子的选择性受体。氯化汞(HgCl2)能够很容易的与其发生反应生成汞(Ⅱ)的配合物,这些汞(Ⅱ)的配合物非常稳定,能够很好的遏制氯化汞等进入到生物循环系统之中。此外,本研究利用紫外-可见光谱滴定、稳态荧光光谱滴定、圆二色谱和粘度实验研究了三足配体汞配合物与小牛胸腺DNA 的相互作用。
1 实 验
1.1 测试仪器及试剂
化合物熔点用北京XT4-100x 显微熔点仪测定;C,H,N 分 析 采 用Elemental Vario-EL 型 元 素 分 析仪; 红外光谱(4 000~400 cm-1) 用Therrno Mattson FTIR 光谱仪(KBr 压片法)测定;1HNMR 和13CNMR光谱测试用Varian200 核磁共振仪测定(CDC13为溶剂,Me4Si 为 内 标); 质 谱 测 试 用 HP-5988A spectrometer (EI at 70 eV);晶体测试用Bruke Smart APEX ⅡCCD 面探测仪;粘度用乌氏粘度计在恒温槽中测定。
Tris-HCl 缓冲溶液:该缓冲溶液为水溶液,其中三羟甲基氨基甲烷(tris)的浓度为10 mmol·L-1,NaCl的浓度为50 mmol·L-1,加盐酸调节pH 到7.2。小牛胸腺DNA(CT-DNA)购自Sigma 公司,用Tris-HCl 缓冲溶液配置的样品保存在冰箱,一周内用完。该实验所用到的所有试剂均为分析纯,实验用水均为二次蒸馏水。三(2-氯乙基)胺盐酸盐根据文献[6]合成。
1.2 配体的合成
取3.0 mmol 水杨醛于100 mL 的圆底烧瓶中,加入50 mL 的无水乙醇及4.0 mmol 的NaOH 固体,常温搅拌0.5 h。然后加入1.0 mmol 的三(2-氯乙基)胺盐酸盐,加热使其回流6 h,冷却到室温,然后倾入到150 mL 的冰水中,出现大量沉淀,过滤,并用水及冷的无水乙醇洗涤,干燥后得白色固体粉末即为配体L,二氯甲烷中重结晶可得无色块状晶体。产率: 67%。1H NMR (CDCl3) δ(ppm): 3.25 (t, 6, J=7 Hz, CH2N), 4.20 (t, 6, J=7 Hz, CH2O). MS: m/z=462.2[M+H]+。
1.3 配合物的合成
称取配体L 0.092 2 g (0.2 mmol)于25 mL 的圆底烧瓶中,加入10 mL 的甲醇,加热使其溶解,待其溶解后,慢慢滴加5 mL (0.2 mmol)的HgCl2甲醇溶液到圆底烧瓶中,继续反应3.0 h 后,冷却,过滤,滤液用自然挥发法培养单晶,1 周后得无色块状晶体。产 率:~72%。元 素 分 析 (C33H45Cl2HgNO9) (%): C,45.62; H, 5.15; N, 1.49。理论值 (%):C, 45.50; H,5.21; N, 1.61。FTIR (KBr pellet) (cm-1): 3 445 (br),2 935 (s), 2829 (m), 2 360 (m), 1 601 (s), 1 491 (s),1 453 (s), 1 368 (s), 1 285 (m), 1 234 (vs), 1 090 (vs),1 049(vs), 978 (s), 909 (s), 757 (s), 676 (w), 609 (w),509 (w)。

Scheme 1 Synthetic routeine of ligand L
1.4 测试方法
1.4.1 紫外吸收光谱
向样品池及参比池中分别加入2.0 mL 的Tris-HCl 缓冲溶液,扫描基线,再向样品池中加入20 μL的1.0×10-3mol·L-1的配合物溶液,扫描其紫外吸收光谱; 然后向样品池及参比池中分别加入相同体积的CT-DNA 储备液,测定配合物的紫外吸收光谱随CT-DNA 加入量的变化。配合物与CT-DNA 的结合常数可通过公式1 计算[8]:
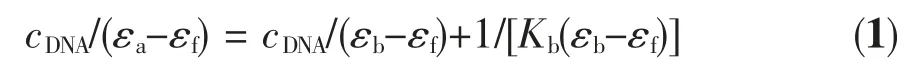
其中,cDNA表示样品池中CT-DNA 的浓度,εa,εb,εf分别表示吸光系数(Aobsd/cM),未与DNA 结合的配合物和已与DNA 结合的配合物的吸光系数。结合常数Kb就是以cDNA/(εa-εf)对cDNA作图所得的斜率与截距的比值。
1.4.2 荧光光谱
向荧光比色皿中加入2.0 mL 的Tris-HCl 缓冲溶液,再加入20 μL 的1.0×10-3mol·L-1的配合物溶液,混合均匀后扫描其荧光发射光谱;然后再逐渐加入CT-DNA 储备液,测定配合物的荧光发射光谱随CT-DNA 的加入量的变化。配合物与CT-DNA 的结合常数可通过公式2 计算[9]:

其中,ct表示配合物的总浓度,F 表示加入DNA后的荧光强度,F0、Fmax分别表示配合物在未加入DNA 时的荧光强度和与DNA 反应后的最大荧光强度。
1.4.3 粘 度
溶液粘度用乌式粘度计在25(±0.1) ℃的恒温槽里测量。首先向粘度计中加入10 mL 的Tris-HCl 缓冲溶液,测定溶液流过毛细管所用的时间t0(s);然后加入100 μL 1.0×10-3mol·L-1的DNA 溶液,使粘度计中DNA 的浓度为1.00×10-5mol·L-1,再记录此溶液通过毛细管所用的时间tD(s);之后向溶液中逐渐加入被测化合物溶液(浓度是1.00×10-3mol·L-1),每次10 μL,同样测定混合溶液流过毛细管所用的时间t(s)。溶液的粘度值与溶液流过粘度计中的毛细管所花费的时间成正比,因此溶液粘度的比值(η/η0)1/3等于耗费时间的比值[(t-t0)/(tD-t0)]1/3。以(η/η0)1/3对1/Rt 作图可观察被测化合物对DNA 溶液粘度的影响(Rt 是DNA 与化合物物质的量浓度的比值:cDNA/c被测化合物),η0和η 分别是单独的DNA 溶液和含有不同浓度化合物溶液的粘度[10]。
1.4.4 配体及配合物的晶体结构测试
将合适大小的配体L 的晶体 (0.25 mm×0.32 mm×0.31 mm)及配合物的晶体(0.37 mm×0.34 mm×0.28 mm)置于Rigaku RAXIS-RAPID 面探测仪上,于296 K 下用经石墨单色器单色化的Mo Κα(λ=0.071 073 nm) 辐射作为衍射光源进行X 射线单晶结构测试。数据用multi-scan 和sadabs 软件校正后,以可观测的独立衍射点(7150)进行结构计算。用SHELXTL-97 软件包进行结构解析,初结构用直接法解出,非氢原子坐标是在以后的数轮差值Fourier 合成中陆续确定的[11]。基于F2对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正,所有氢原子均为理论加氢。配体L 及配合物的晶体学数据及结构精修参数分别列于表1 中。
CCDC: 952313, L; 843072, complex.

表1 配体及配合物的晶体学数据及结构精修参数Table 1 Crystallographic data for ligand and complex

Continued Table 1
2 结果与讨论
2.1 配体L 及配合物的晶体结构分析
X-射线单晶衍射分析表明配体L 是以单斜晶系、C2/c 空间群结晶,其3 条侧链存在非晶体学的伪C3对称性(如图1 所示)。配体L 的主要的键长及键角列于表2 中。以氮原子(N1)为中心3 个键的键长和键角分别为0.145 1 (2) nm, 0.1459 2 (19) nm,0.145 7(2) nm, 115.47(13)°, 114.41(13)°, 113.57(13)°。这些键长和键角的大小与先前所报道的其它三足配体相一致[12]。

图1 配体L 的晶体结构图Fig.1 Crystal structure of L

表2 配体L 的主要的键长及键角Table 2 Bond lengths and bond (nm) angles (°) for ligand and complex

Continued Table 2

图2 配合物的晶体结构图Fig.2 Crystal structure of complex
2.2 配合物与DNA 的相互作用研究
2.2.1 紫外吸收光谱
配合物与CT-DNA 作用的紫外吸收光谱变化如图3 所示。配合物在220 nm 附近有很强的吸收峰,这主要归于配合物中的π→π* 跃迁。随着所加入DNA 浓度的逐渐增加,配合物的吸收峰强度逐渐降低,并伴随有较明显的红移。吸收峰强度降低了30.3%,向高波数分别红移了12 nm。这种特征的紫外吸收光谱的变化说明了配合物与DNA 之间以插入方式发生相互作用[14]。在这种作用模式下,插入配体的π* 轨道与碱基对的π 轨道发生耦合,降低π→π* 跃迁的能量;其次,由于耦合的π* 轨道部分填充电子,降低跃迁的可能性; 因此当配合物与DNA 以插入方式结合时会同时出现吸收峰降低及红移现象[15]。
为了定量的比较配合物与DNA 的结合力,我们利用配合物的最强吸收峰的强度变化计算了它们与DNA 作用的结合常数。由图3 可知,配合物与DNA的结合常数为7.34×105L·mol-1。
2.2.2 荧光光谱分析
配合物与DNA 作用的荧光光谱变化如图4 所示。在未加入DNA 的情况下,配合物在Tris-HCl 缓冲溶液中表现出较弱的荧光发射强度。随着DNA 浓度的不断增加,配合物的荧光发射强度也在不断增大,并且配合物还发生了较明显的红移现象。这是由于当配合物插入DNA 碱基对后,DNA 双螺旋结构内的疏水环境以及配合物中平面芳香基团与碱基对形成耦合堆积,降低了水分子与配合物碰撞频率,从而产生荧光敏化作用[16];配合物的红移现象与其紫外吸收光谱相一致。这又进一步说明了配合物与CT-DNA 之间存在着明显的插入结合相互作用。
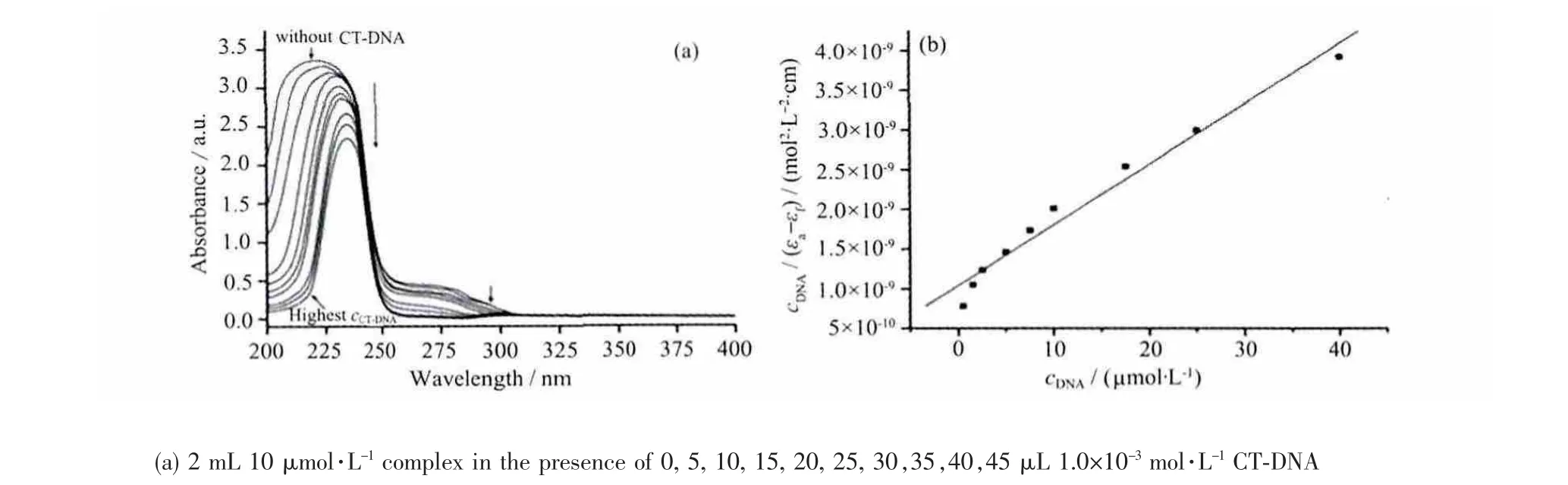
图3 (a) 配合物与CT-DNA 作用的紫外可见吸收光谱变化; (b) 配合物与CT-DNA 作用的cDNA/(εa-εf)对cDNA 的曲线图Fig.3 (a) Electronic spectra of the complex in the presence of CT-DNA; (b) plots of cDNA/(εa-εf) versus cDNA of the titration of DNA with the complex
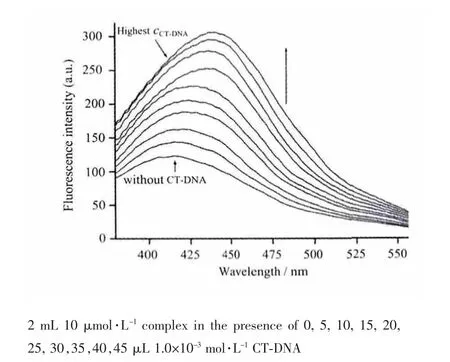
图4 配合物与CT-DNA 作用的荧光光谱变化Fig.4 Fluorescence spectra of the complex reacted with CT-DNA
2.2.3 粘 度
为了进一步证实配合物与CT-DNA 之间的相互作用,我们做了配合物对CT-DNA 粘度影响实验。由于流体动力学方法对长度的变化非常敏感(如粘度、沉降),能够对溶液中的结合方式研究提供最客观、最重要的测试数据[17]。经典插入试剂插入到DNA 双螺旋结构内,相邻碱基对为容纳插入配体而被拉伸,导致DNA 双螺旋伸长,溶液的粘度增加。如图5 所示,CT-DNA 的粘度随着配合物浓度的增加而逐渐变大。粘度实验清晰的表明,化合物1、2 以插入方式与DNA 相结合,插入到相邻碱基对的中间,从而导致DNA 双螺旋链的拉伸,提高了DNA 的粘度。粘度实验进一步验证了先前从光谱研究中所得出的结论。

图5 25 ℃下配合物对CT-DNA 粘度的影响Fig.5 Effect of increasing amounts of the complex on the relative viscosity of DNA
3 结 论
综上所述,本文设计合成了含有N、O 配位原子的三足配体L,该配体与汞离子生成非常稳定的配合物,遏制了氯化汞等对生物体及环境的危害。通过元素分析、红外光谱、X 射线单晶衍射等测试手段对该配合物的组成和结构进行了表征。此外,我们还对金属配合物与CT-DNA 的相互作用进行了系统研究,通过紫外吸收光谱、荧光光谱、粘度的测试,结果显示该配合物与CT-DNA 以插入方式相结合。
[1] Feng X B, Lu J Y, Hao Y J, et al. Anal. Bioanal. Chem.,2003,376:1137-1140
[2] Hansen J C. Dasher G, J. Rev. Environ. Health, 1997,12:107-116
[3] Ghosh S, Reches M, Gazit E, et al. J. Angew. Chem., Int.Ed., 2007,46:2002-2004
[4] Yoshizawa M, Miyagi S, Kawano M, et al. J. Am. Chem.Soc., 2004,126(30):9172-9173
[5] Singh A S, Bharadwaj P K. Dalton Trans., 2008,6:738-741
[6] Ward K. J. Am. Chem. Soc., 1935,57:914-916
[8] Wolfe A, Shimer G H, Meehan T. Biochemistry, 1987,26:6392-6396
[9] Howe G,Wu K,Bauer W.Biochemistry,1976,15:4333-4339
[10]Satyanarayana S, Dabrowiak J C, Chaires J B. Biochemistry,1992,31:9319-9324
[11]Sheldrick G M. SHELXTL-97, Program for X-ray Crystal Structure Solution, Göttingen: University of Gottingen, 1997.
[12]Weber G, Sheldrick G M. Acta Cryst., 1980,36:1978-1980
[13]Bowmaker G A, Assadollahzadeh B, Brodie A M, et al.Dalton Trans., 2005,9:1602-1612
[14]ZHAO Hai-Yan(赵海燕), MA Jing-Jun(马晶军), YANG Fu-Li(杨芙丽).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,11:2468-2472
[15]Eriksson M, Leijon M, Hiort C, et al. Biochemistry, 1994,33:5031-5040
[16]Efink M R,Ghiron C A.Anal.Biochemistry,1981,114:199-227
[17]Xiong Y, He X F, Zou X H, et al. J. Chem. Dalton Trans.,1999,1:19-23
