乡土树种改造豆科人工纯林对植物群落和土壤微生物学和化学属性的影响
2013-08-17韦兰英申卫军
韦兰英,申卫军
(1.中国科学院 华南植物园,广州510650;2.中国科学院大学,北京100101)
近几十年来,随着人口的持续增长和经济的快速发展,人类活动对陆地生态系统的干扰与破坏达到前所未有的程度;由于大气污染、土壤侵蚀、森林砍伐和过度耕作等不合理的资源利用方式引发的土壤退化已经成为人类面临的主要环境问题之一[1-2]。大规模的植被退化不仅减少了植被覆盖和物种多样性,而且严重损害了土壤特性。土壤特性的严重损害将会导致土壤质量和生产力的长久退化[3]。营造人工林,尤其是外来速生树种人工林,被认为是防止土壤退化的有效方法[4-5]。因为人工林不仅能改善土壤条件,还可以克服植被演替的障碍,促进乡土植物定居和更新,并为进一步演替为人工林与乡土植物混交林提供条件[4,6-10]。但由于立地条件的限制[11],如缺乏乡土树种种源或散布种子的动物[12]等,先锋树种人工林的自然更新较低,且少有乡土植物定居,部分人工林甚至衰退[13]。
因此,在退化立地上营造的人工林往往难以演变为人们所期望的多样性较高的乡土植物群落[13-15],对于已经停止演替且乡土树种多样性较低的人工林[15-16],需要通过适当的林业经营措施对其进行持续的管理[14,17-18]。
自从20世纪80年代以来,我国为了恢复退化土地,营造了大面积的人工林。迄今为止,中国具有世界面积最大的人工林,占林地总面积的1/3。在热带和亚热带地区,除了松林和桉树林外,豆科树种在人工林营造中被广泛使用。林分发育早期,豆科树种人工林生长快,对立地条件具有较好的改善作用[19-21]。但是,大约15a后,豆科树种人工林冠层开始萎缩,导致阳生性灌木或草本如桃金娘和芒萁的大量入侵,同时,其自身更新困难,乡土树种难以定居[22-23]。为了克服这一问题,在已退化的人工林中种植乡土树种被认为是将此类人工林恢复为多样性更高的植物群落的有效措施。但是,这一措施对土壤微生物学和化学属性的影响尚不清楚。
因此,本研究以种植和未种植乡土树种的两种豆科人工林(马占相思林(Acacia.Mangium;AM)和大叶相思林(Acacia.Auriculiformis;AA)为研究对象,通过比较两组种植(NM和NA)与未种植乡土树种人工林在发育早期植物群落组成和土壤微生物学和化学属性的差异,探明这一措施对土壤质量的影响,并基于植物群落和土壤的变化,讨论这一措施对植被恢复和管理的启示,以期为南亚热带地区植被恢复提供管理依据。
1 研究区自然条件和研究方法
1.1 研究区概况
研究区位于广东省中部的鹤山野外生态定位研究站(112°54′E,22°41′N),该区属南亚热带丘陵区,平均海拔高度80m,年平均太阳辐射为4 350.5MJ/(m2·a),年平均≥10℃的有效积温为7 597.2℃。该区年平均气温21.7℃,最高温37.5℃,最低温0℃,年均降雨量1 700mm,具有明显的干湿季之分[24]。土壤为强淋溶性砖红壤。该区历史上为森林地带,顶级群落为亚热带季风常绿阔叶林。由于人类活动的影响,植被退化和水土流失十分严重。为恢复退化立地,鹤山站自1984年起构建了多种人工林生态系统类型,以速生耐瘠树种组成的先锋人工林为主,如外来豆科速生树种马占相思林(A.mangium)和大叶相思林(A.auriculaeformis)。林分发育大约15a后,豆科树种人工林冠层开始萎缩,阳生性灌木如桃金娘和芒萁大量入侵,同时,其自身更新困难,乡土树种难以定居[22-23]。为了克服这一问题,鹤山站在1998年左右对约20hm2的大叶相思和马占相思纯林利用84种乡土树种进行了林分改造。种植时,将原有林分进行部分砍伐,将1~2a生的乡土树种幼苗以株行距为2.5m×2.5m种植到其中,主要的植物种类为樟树、阴香、米老排、火力楠、厚壳桂、红锥和青皮等。目前乡土树种已在改造后的大叶相思林和马占相思林内成功定居、发育,而未改造的部分仍只有大叶相思和马占相思占据乔木层,林下有少量灌、草。这两组样地相临,土壤和小气候条件相似。开展本研究时,AM和AA人工林林龄为28a,用乡土树种进行改造的(NM和NA)已发育10多年时间(表1)。
1.2 研究方法
于2011年3月下旬在4个样地中进行植被调查和土壤取样。植被调查时,在每个植被类型内选择具代表性的3个20m×20m的样方(共12个),进行乔木(10m×10m)、灌木(5m×5m)和草本植物(1m×1m)的调查。乔木记录树高、胸径、冠幅,灌木记录高度,草本记录盖度。土壤取样时,在进行植被调查的每个样方内用土钻随机选择6个点采集0—20 cm的土壤,去除石头、根系等杂物后过2mm筛,将土壤分为三部分,一部分带回实验室立即进行铵态氮和硝态氮的测定;一份保存于4℃冰柜中,用于土壤微生物生物量碳(MBC)、可溶性有机碳(DOC)和基础呼吸(BR)的测定,另一份土样在室温条件下风干,用于土壤pH值、土壤有机碳(TOC),全氮(TN)和全磷(TP)的测定。通过以上指标,计算代谢熵(Q=MBC/Corg)和呼吸熵(qCO2=BR/MBC)。

表1 研究样地概况
1.3 指标测定
物种数指各人工林群落物种数目,Shannon-Wiener多样性指数计算公式如下[25]:

式中:Ni——群落中某一层次第i个物种的重要值;N——该层次所有物种重要值之和;S——物种数。土壤微生物碳(MBC)和基础呼吸(BR)分别参照文献[26]和文献[3]测定。土壤全氮(TN)采用凯氏定氮法测定,土壤有机碳(TOC)采用重铬酸钾容量外加热法测定,土壤全磷(TP)采用钼锑抗比色法测定,土壤含水量采用烘干法测定,重复3次。
1.4 数据分析
采用SPSS统计分析软件包对数据进行相关分析、One-Way ANOVA方差分析,并用LSD法进行多重比较。
2 结果与分析
2.1 林分改造对植物生长和多样性的影响
在改造和未改造的林分中,原豆科树种仍处于优势,占据林分上层。改造林分中的马占相思或大叶相思其树高、胸径和冠幅均高于未改造林分中的马占相思或大叶相思,表明改造林分的环境条件有利于原优势树种的生长(表2)。通过比较,发现乡土树种树高、胸径、冠幅远低于豆科优势树种,这与乡土树种种植时间不长有关。
未改造与改造马占相思林乔木种总数分别为4种和42种,自然更新的物种分别为3种和10种;未改造与改造大叶相思林乔木种总数分别为5种和26种,自然更新的物种分别为4种和6种(图1)。可见,引入乡土树种后的马占相思林和大叶相思林乔木物种数均高于未改造的马占相思林和大叶相思,表明大部分乡土树种都能存活。对林下灌草而言,未改造马占相思林灌木(17种)和草本(10种)与改造马占相思林灌(20种)、草本(17种)种类相当;未改造大叶相思林灌木(17)和草本(15)总数也与改造大叶相思林灌木(14种)和草本(16种)总数相当(图1)。表明林分改造对林下灌草物种数影响不大,但是能明显促进马占相思林乔木层和草本层种类的自然更新。

表2 四种林分的群落结构特征

图1 人工林乔木、灌木和草本的物种数
林分改造对马占相思和大叶相思的丰富度指数和多样性指数的影响表现出一致的规律,即改造的马占相思林和大叶相思林乔木层丰富度指数和多样性指数均显著高于未改造的马占相思林和大叶相思林(图2A,2B)。改造和未改造灌木层丰富度指数和多样性指数无显著差异(图2A,2B)。改造的马占相思林草本层丰富度指数和多样性指数显著高于未改造马占相思林,而改造与未改造大叶相思草本丰富度指数和多样性指数没有差异(图2C,2D)。表明林分改造提高了乔木层丰富度指数和多样性指数,但对灌木层的影响较小,对草本层丰富度指数和多样性指数的影响因纯林种类而异。

图2 人工林土植物多样性指数的变化
2.2 林分改造对凋落物量和地表凋落物层的影响
对4个林分2011年6月到2013年2月(共为期21个月)的凋落量的测定结果表明,未改造马占相思林(图3A)与改造马占相思林(图3B)凋落量的年动态变化较为一致,凋落高峰均集中在6—10月。未改造大叶相思林(图3C)与改造大叶相思林(图3D)6月、7月和10月凋落量显著高于其它月份。虽为同属不同种的两种豆科植物,未改造林分在2011年6—12月的的分布极其相似(图3A,3C),2012年完整的年动态分布格局类似。两个豆科人工纯林改造后((图3B,3D),其凋落量年分布格局基本一致。
虽然两组人工林相对应的月凋落量相似,但是其地表凋落物层厚度差异显著(p<0.01)。改造后的马占相思林地表凋落物厚度比未改造马占相思林降低47%,而改造后的大叶相思林地表凋落物厚度比未改造大叶相思林增加92%(p<0.01)。而无论是否改造,在某些月份,大叶相思的月凋落量显著高于马占相思,如2012年的7月和10月。尽管一年中这样的月份不多,但是由于两个豆科树种分解较慢,长期的积累仍会导致两个林分类型地表凋落物层厚度的显著差异(p<0.01)。不过,未改造的马占相思林地表凋落物厚度显著高于未改造的大叶相思林(p<0.01),改造后马占相思林地表凋落物厚度显著低于改造的大叶相思林(p<0.01)。

图3 不同年份、不同植被的凋落量年动态分布

图4 地表凋落物层厚度
2.3 林分改造对土壤微生物学属性的影响
林分改造使马占相思林土壤微生物量碳(MBC)、基础呼吸(BR)和qCO2显著下降(图5A,B,D),Q(MBC/Corg)下降,但未达到显著水平(图5C);林分改造后,大叶相思林土壤微生物量碳(MBC)、基础呼吸(BR)和qCO2无明显变化(图5A,5B,5D),Q(MBC/Corg)显著增加(图5C)。虽然两种人工林的气候和土地利用历史相同,但在马占相思和大叶相思人工林种植乡土树种对土壤微生物学属性的影响程度和变化的方向存在差异,这可能是由于马占相思和大叶相思虽均为豆科树种,但是其凋落叶质量和分解速率存在差异,也可能是由于优势树种与乡土树种相互作用存在差异导致的。

图5 林分改造对土壤微生物学属性的影响
2.4 林分改造对土壤化学属性的影响
林分改造使马占相思林土壤有机碳和可溶性有机碳下降,但能在一定程度上提高大叶相思林土壤有机碳和可溶性有机碳含量(图6A,6B),这可能与凋落物输入存在差异有关。对马占相思林和大叶相思林进行改造后,土壤全氮无明显变化,但是均不同程度地增加了土壤全磷含量(图6C,6D),表明进行林分改造不会降低土壤全氮含量,一定程度上还可以促进全磷的积累。对马占相思林和大叶相思林进行改造,均会不同程度地降低土壤无机氮含量(图6E,6F),这可能与乡土植物的摄取有关。
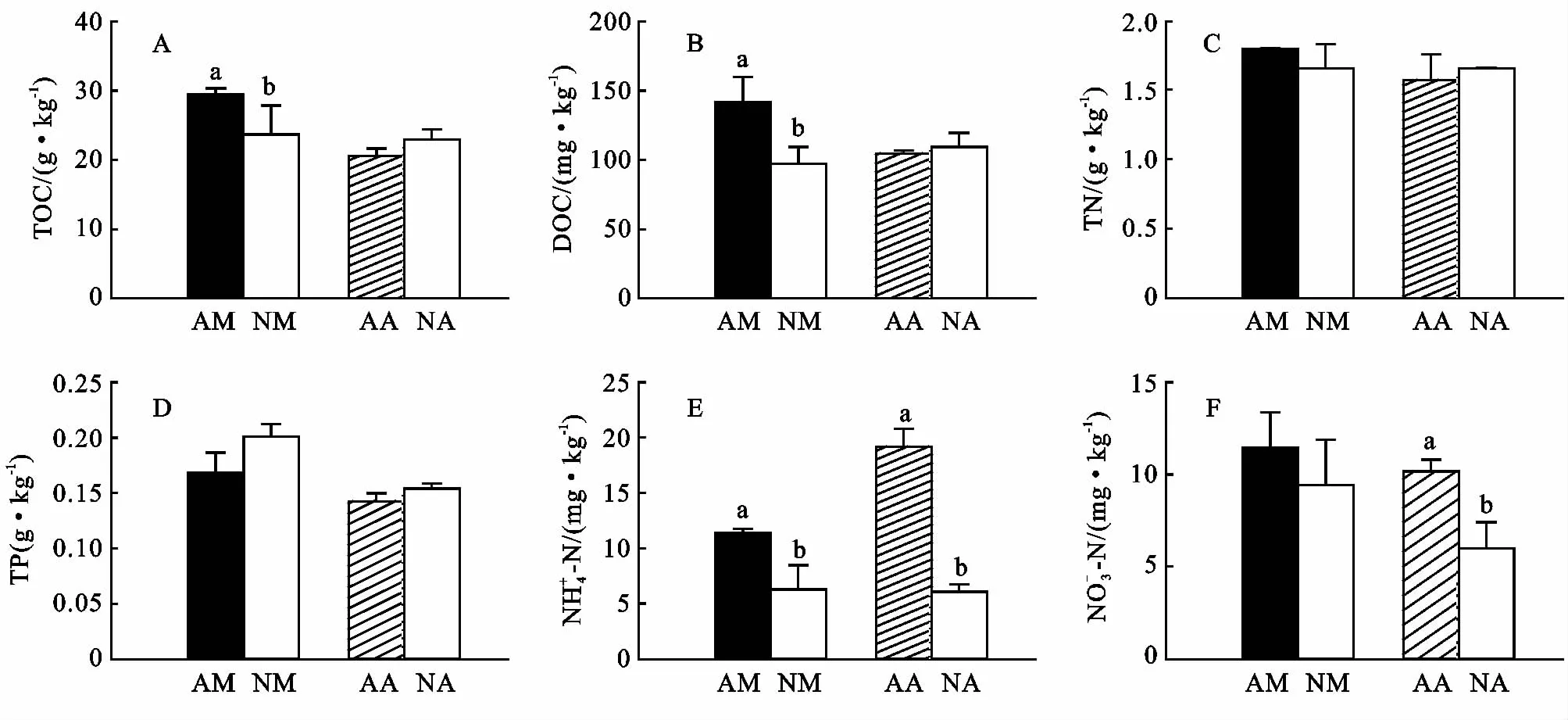
图6 林分改造的土壤化学属性的影响
3 讨 论
一些研究表明,不同森林经营管理方式对物种组成和群落结构的影响不同,如间伐和计划火烧一般会降低林分密度,但是对植物多样性和丰富度无影响甚至具有正面影响[27-28]。在人工林中种植乡土树种通常增加了树种密度,因此对物种组成和多样性具有深刻的影响。本研究中,在两个退化人工林中种植乡土树种后,由于大部分乡土树种均能存活,因此增加了植物多样性,改变了群落结构。我们发现由于种植了乡土树种,改造后马占相思(NM)和大叶相思林(NA)促进了更多乔木树种的更新,因此增加了乔木的多样性和丰富度。乡土树种较高的存活率可能与马占相思和大叶相思对林分条件的改善作用有关[19-21],而NM和NA促进了更多乔木树种的更新以及马占相思和大叶相思的生长情况优于未改造的马占相思(AM)和大叶相思(AA),可能是由于NM 和NA创造了更为优越与适宜的环境条件。
大多数研究表明,造林后30a和50a,土壤C和N显著增加[29]。尽管如此,林业经营管理对人工林土壤C的影响仍存在很大的不确定性,可能增加、下降或无影响[30]。在亚热带地区,间伐导致的树木去除导致碳储量的增加[31]。本研究中,我们预测乡土树种种植到人工林后,由于树种密度的增加,凋落物数量和质量的差异,TOC和DOC将会增加[32],但是与我们的假设相反,在马占相思林中种植乡土树种后,TOC和DOC降低;而大叶相思种植乡土树种后,TOC和DOC无显著变化。NM人工林TOC和DOC的下降可能是由于乡土树种丰富度增加,土壤微生物活性下降所致。相反的是,尽管具有与NM几乎相同的乡土树种,甚至与AA相比较高的微生物活性,但是NA对TOC无显著影响。这些不一致的研究结果表明人工林对土壤有机碳的影响较为复杂。本研究中,我们发现与AM和AA相比,NM和NA的无机氮含量降低,TN和TP差异不显著。在丹麦,相似的一个研究报道造林后30a,人们没发现土壤属性发生显著的变化[33]。这可能是由于人工林或造林对土壤TN和TP的影响受多种因素的影响,如土地利用、气候、树种,因此可能需要较长的时间才能体现[34]。
本研究中,NM人工林中qCO2的显著降低反映了土壤微生物群落对基质利用的效率提高[35],而且也反映了土壤微生物更具有活性[36],与 Agnelli等[37]的研究结果类似。qCO2的下降可能由以下因素引起:NM植物种类多,因而具有更多多样性的凋落物[35]。NA和AA的qCO2无明显差异。从这个角度分析,林分改造一定程度上可以维持和提高土壤质量。Q反映了微生物固定的碳量,我们的研究结果表明,大叶相思林改造后,固定了更多的碳,而马占相思改造后,其Q下降,可能是由于微生物固定作用的下降[35]导致的。
总的说来,在退化的人工林中种植乡土树种初期,土壤微生物学和化学属性产生了显著而不同的影响。虽然两种人工林的气候和土地利用历史相同,但在马占相思和大叶相思人工林种植乡土树种所产生的效应的程度和变化的方向存在差异,我们的研究结果与Ruiz-Jaen和Aide的结论[38]类似。这种影响的差异可能是由于优势树种的差异及其与乡土树种的相互作用导致的。在森林生态系统中,优势树种在决定土壤的生物学和化学属性中可能比土壤质地和气候具有更为重要的作用[39-42]。物种多样性以及与之相连的凋落物和根系分泌物的差异可能是引起NA和NM土壤微生物学和土壤化学属性存在差异的主要原因。
林业经营管理通常关注地上部分植被,而不是土壤。我们的研究发现当在退化的人工林中种植乡土树种后,土壤微生物学和大部分的土壤化学属性均发生了改变。在马占相思人工林中种植乡土树种后能促进更多木本植物的更新。这一研究工作对于植被的恢复和管理具有重要的启示:首先,并不是所有的人工林都能促进乡土植物的更新,需要对树种进行选择,进行适当的林业经营管理以促进乡土树种的更新,以使其恢复为更自然的乡土树种群落。其次,乡土树种引进人工林后,生态系统特性可能会随很多因子而变,进而导致地下部分过程的变化,这一过程可能需要较长的时间。地上部分的相互作用可以潜在地转化为植物的地下响应,但是由于现实条件的限制,我们对这些相互作用理解有限[43]。虽然植被组成是重要的生态系统特征,但是土壤微生物学和土壤化学属性的变化也值得关注。
4 结 论
把乡土树种引入两种豆科纯林经过约14a的发展后,大部分乡土树种都存活了下来,增加了群落中乔木种类的多样性,更重要的是促进了其他树种的自然更新,而在未改造的豆科纯林中自然更新树种较少。同时,改造过程中引入小的乡土树种幼苗和砍伐部分豆科树种减少了优势豆科种之间的竞争,从而有利于保留豆科树种的生长。因此,从植物多样性恢复的角度来看,在本地带用乡土树种改造豆科纯林是可行的和有利的。豆科纯林引入乡土树种后对两种同属、不同种的豆科纯林土壤微生物学和化学属性也产生了不同的影响。马占相思纯林由于凋落量大,对其进行改造后降低了土壤有机碳含量和微生物活性;但林分改造对大叶相思林土壤有机C含量和微生物活性影响不大。林分改造对土壤中营养元素(N、P)含量的影响一致,增加了P含量,未改变全N含量,但降低了无机N含量。因此,用乡土树种改造豆科纯林可能会降低土壤C累积的速率并减少无机N淋失的风险。
[1] Doran J W.Soil health and global sustainability:translating science into practice[J].Agriculture Ecosystems &Environment,2002,88(2):119-127.
[2] Dinesh R S,Chaudhuri G,Ganeshamurthy A N,et al.Changes in soil microbial indices and their relationships following deforestation and cultivation in wet tropical forests[J].Applied Soil Ecology,2003,24(1):17-26.
[3] Islam K R,and Weil R R.Land use effects on soil quality in a tropical forest ecosystem of Bangladesh[J].Agriculture Ecosystems & Environment,2000,79(1):9-16.
[4] Otsamo R.Secondary forest regeneration under fastgrowing forest plantations on degraded Imperata cylindrica grasslands[J].New Forests,2000,19(1):69-93.
[5] Boley J D,Drew A P,Andrus R E.Effects of active pasture,teak(Tectona grandis)and mixed native plantations on soil chemistry in Costa Rica[J].Forest Ecology and Management,2009,257(11):2254-2261.
[6] Lugo A E.The apparent paradox of reestablishing species richness on degraded lands with tree monocultures[J].Forest Ecology and Management,1997,99(1/2):9-19.
[7] Parrotta J A,Turnbull J W,Jones N.Introduction-Catalyzing native forest regeneration on degraded tropical lands[J].Forest Ecology and Management,1997,99(1/2):1-7.
[8] Powers J S,Haggar J P,Fisher R F.The effect of overstory composition on understory woody regeneration and species richness in 7-year-old plantations in Costa Rica[J].Forest Ecology and Management,1997,99(1/2):43-54.
[9] Cusack D,Montagnini F.The role of native species plantations in recovery of understory woody diversity in degraded pasturelands of Costa Rica[J].Forest Ecology and Management,2004,188(1/3):1-15.
[10] Abiyu A,Lemenih M,Gratzer G,et al.Status of native woody species diversity and soil characteristics in an exclosure and in plantations ofEucalyptusglobulusandCupressuslusitanicain Northern Ethiopia[J].Mountain Research and Development,2011,31(2):144-152.
[11] Lee E W,Hau S B C H,Corlett R T.Natural regeneration in exotic tree plantations in Hong Kong,China[J].Forest Ecology and Management,2005,212(1/3):358-366.
[12] Senbeta F,Teketay D,Naslund B A.Native woody species regeneration in exotic tree plantations at Munessa-Shashemene Forest,southern Ethiopia[J].New Forests,2002,24(2):131-145.
[13] Healey S P,Gara R I.The effect of a teak (Tectona grandis)plantation on the establishment of native species in an abandoned pasture in Costa Rica[J].Forest Ecology and Management,2003,176(1/3):497-507.
[14] Vallauri D R,Aronson J,Barbero M.An analysis of forest restoration 120years after reforestation on badlands in the Southwestern Alps[J].Restoration Ecology,2002,10(1):16-26.
[15] Gomez-Aparicio L,Zavala M A,Bonet F J,et al.Are pine plantations valid tools for restoring Mediterranean forests?An assessment along abiotic and biotic gradients[J].Ecological Applications,2009,19(8):2124-2141.
[16] Shono K,Davies S J,Kheng C Y.Regeneration of native plant species in restored forests on degraded lands in Singapore[J].Forest Ecology and Management,2006,237(1/3):574-582.
[17] Wang J,Ren H,Yang L,et al.Establishment and early growth of introduced indigenous tree species in typical plantations and shrubland in South China[J].Forest Ecology and Management,2009,258(7):1293-1300.
[18] Xiang C H,Luan J W,Liu S R,et al.Assessments of the impacts of Chinese fir plantation and natural regenerated forest on soil organic matter quality at Longmen mountain,Sichuan,China[J].Geoderma,2010,156(3/4):228-236.
[19] 彭少麟,余作岳,张文其,等.鹤山亚热带丘陵人工林群落分析[J].植物生态学报,1992,16(1):1-10.
[20] 余作岳,彭少麟.热带亚热带退化生态系统植被恢复生态学研究[M].广东科技出版社,1996.
[21] Li P,Huang Z L,Xiang Y C,et al.Survival,growth and biomass of acacia auriculiformis and schima superba seedlings in different forest restoration phases in Nan'ao Island,South China[J].Journal of Tropical Forest Science,2011,23(2):177-186.
[22] 申卫军,彭少麟.南亚热带鹤山主要人工林生态系统C、N累积及分配格局的模拟研究[J].植物生态学报,2003,27(5):690-699.
[23] Duan W J,Ren H,Fu S L,et al.Community and comparison and determinant analysis of understory vegetation in South China[J].Restoration Ecology,2010,18(2):206-214.
[24] Shen W J,Lin Y B,Jenerette G.D,et al.Blowing litter across a landscape:Effects on ecosystem nutrient flux and implications for landscape management[J].LandscapeEcology,2011,26(5):629-644.
[25] 马克平.生物群落多样性的测度方法:Ⅰ.α多样性的测度方法[J].生物多样性,1994:2(3):162-168.
[26] Vance E D,Brookes P C,Jenkinson D.S.An extraction method for measuring soil microbial biomass-C[J].Soil Biology & Biochemistry,1987,19(6):703-707.
[27] Ryu S R A,Concilio J Q,Chen M,et al.Prescribed burning and mechanical thinning effects on belowground conditions and soil respiration in a mixed-conifer forest,California[J].Forest Ecology and Management,2009,257(4):1324-1332.
[28] Verschuyl J,Riffell S,Miller D,et al.Biodiversity response to intensive biomass production from forest thinning in North American forests:A meta-analysis[J].Forest Ecology and Management,2011,261(2):221-232.
[29] Li D J,Niu S L,Luo Y.Q.Global patterns of the dynamics of soil carbon and nitrogen stocks following afforestation:A meta-analysis[J].New Phytologist,2012,195(1):172-181.
[30] Laiho R,Sanchez F,Tiarks A,et al.Impacts of intensive forestry on early rotation trends in site carbon pools in the southeastern US[J].Forest Ecology and Management,2003,174(1/3):177-189.
[31] Tian D L,Peng Y Y,Yan W D,et al.Effects of thinning and litter fall removal on fine root production and soil organic carbon content in masson pine plantations[J].Pedosphere,2010,20(4):486-493.
[32] Shirato Y,Taniyama I,Zhang T H.Changes in soil properties after afforestation in Horqin Sandy Land,North China[J].Soil Science and Plant Nutrition,2004,50(4):537-543.
[33] Ritter E,Vesterdal L,Gundersen P.Changes in soil properties after afforestation of former intensively managed soils with oak and Norway spruce[J].Plant and Soil,2003,249(2):319-330.
[34] Smal H,Olszewska M.The effect of afforestation with Scots pine (PinussilvestrisL.)of sandy post-arable soils on their selected properties.Ⅱ.Reaction,carbon,nitrogen and phosphorus[J].Plant and Soil,2008,305(1/2):171-187.
[35] Behera N,Sahani U.Soil microbial biomass and activity in response to Eucalyptus plantation and natural regeneration on tropical soil[J].Forest Ecology and Management,2003,174(1/3):1-11.
[36] Araujo A S F,SilvaE F L,Nunes L,et al.The effect of converting tropical native savanna to eucalyptus grandis forest on soil microbial biomass[J].Land Degradation & Development,2010,21(6):540-545.
[37] Agnelli A,Ugolini F C,Corti G,et al.Microbial biomass-C and basal respiration of fine earth and highly altered rock fragments of two forest soils[J].Soil Biology & Biochemistry,2001,33(4/5):613-620.
[38] Ruiz-Jaen M C,Aide T M.Restoration success:How is it being measured[J].Restoration Ecology,2005,13(3):569-577.
[39] Muys B,Lust N.Inventory of the Earthworm Communities and the State of Litter Decomposition in the Forests of Flanders,Belgium,and Its Implications for Forest Management[J].Soil Biology & Biochemistry,1992,24(12):1677-1681.
[40] Menyailo O V,Hungate B A,Zech W.The effect of single tree species on soil microbial activities related to C and N cycling in the Siberian artificial afforestation experiment-Tree species and soil microbial activities[J].Plant and Soil,2002,242(2):183-196.
[41] Grayston S,Prescott C.Microbial communities in forest floors under four tree species in coastal British Columbia[J].Soil Bioloby and Biochemistry,2005,37(6):1157-1167.
[42] Smolander A,Kitunen V.Comparison of tree species effects on microbial C and N transformations and dissolved organic matter properties in the organic layer of boreal forests[J].Applied Soil Ecology,2011,49:224-233.
[43] Bais H P,Weir T L,Perry L G,et al.The role of root exudates in rhizosphere interations with plants and other organisms[J].Annual Review of Plant Biology,2006,57:233-266.
