微波辅助NH4Cl改性沸石及其在调湿材料中的应用
2013-08-15郑佳宜陈振乾
周 波 郑佳宜 陈振乾
(东南大学能源与环境学院,南京 210096)
空气湿度是影响建筑室内环境舒适性的重要参数之一,对于人体健康、产品生产、物品保护等均具有重要作用[1].因此研制出一种能够依靠自身吸放湿性能感应并自动调节空气相对湿度的墙体调湿材料具有重要的意义和工程应用价值.
沸石孔隙率高,比表面积大,同时因有色散力和静电力的共同作用而具有极强的吸附性,理论上可以吸收其自身质量2~3倍的水[2].由于天然沸石孔道中含沸石水及杂质,并且相互通联程度较差[3],故天然沸石的实际吸附能力达不到理论值,要使天然沸石具有良好的调湿性能,须对天然沸石进行改性处理.国内外普遍采用酸活化、热活化等化学方法来对沸石进行改性处理.Janotka等[4]对天然沸石从结构改性、吸附性及功能材料组装等方面进行了研究;Lee等[5]以特殊季铵盐为模板剂合成高硅比沸石,热稳定性高达1100℃;Zhong等[6-7]分别用盐酸和氟硅酸铵处理沸石,降低了六配位铝的含量,提高了硅铝比.由于不同种类的沸石稳定性、反应活性及其自身孔道结构的特殊性差异较大,因而处理工艺比较复杂.寻找工艺简单、节能环保的新型改性方法对于沸石应用于墙体湿敏材料的研究具有重要意义.近几年微波技术成为快速催化及制备高性能新材料的有效方法[8-10],但是微波应用于多孔介质材料改性的研究却少有报道.
因此,本文提出一种通过微波辅助强化NH4Cl溶液活化对沸石改性的新方法,采用热稳定和耐酸性良好的天然丝光沸石作为研究的基础材料,制备出一种新型调湿填料,并研究了微波加热时间和功率、环境湿度等参数对沸石调湿性能的影响,以扫描电镜(SEM)、红外光谱(FTIR)及低温吸附等方法系统表征沸石改性前后的微观结构性质,对比测试其吸、放湿率,为进一步开拓改性沸石在墙体湿敏材料上的应用奠定基础.
1 实验方法
1.1 改性沸石的制备
将天然沸石磨细至100~120目,用干燥器皿装好,放入烘箱烘干.烘箱温度设定为100℃,干燥6 h后作为沸石试样备用.将电子天平精确称重得到的沸石试样放入变频微波炉中,改变加热时间和微波功率,得到一次改性沸石试样.之后用不同浓度的NH4Cl溶液(质量分数为1%,2%,3%,4%,5%,6%)在一定功率下经微波辐照一定时间,将处理液倒出,洗净、烘干,得到二次改性沸石样品.
1.2 性能测试方法
在不同微波加热时间、微波功率和不同浓度的NH4Cl溶液(质量分数为1%,2%,3%,4%,5%,6%)条件下,对改性沸石吸、放湿速率进行测试:①人工气候箱恒温在25℃,相对湿度RH维持在80%,将5 g沸石试样放入箱体中,每隔一段时间称重,直至24 h样品质量变化不超过0.01 g,记录试样的吸湿量;② 人工气候箱恒温在25℃,相对湿度RH维持在30%,将吸湿饱和的沸石试样放入箱体中,每隔一段时间称重,直至24 h样品质量变化不超过0.01 g,记录试样的放湿量.
在绝对湿度变化条件下,测试二次改性沸石试样的调湿性能:①在25℃恒温、2 L密闭容器的相对湿度分别控制在高湿(湿度为80%,75%,70%,65%)条件下,将10 g二次改性沸石试样放入容器内,记录容器中相对湿度的变化和达到平衡时所消耗的时间;②在25℃恒温,2 L密闭容器的相对湿度分别控制在低湿(湿度为 30%,35%,40%,45%)条件下,将吸湿饱和的二次改性沸石试样放入容器内,记录容器中相对湿度的变化和达到平衡时所消耗的时间.
2 结果与分析
2.1 二次改性沸石的形貌和结构特征
通过对图1中的天然沸石试样和一次改性、二次改性后的沸石试样的表面微观结构对比发现,天然沸石表面的平均孔径为33.8 nm,沸石试样经微波辅助强化NH4Cl二次改性后,表面出现了较大的孔隙和空穴,平均孔径为72.8 nm,最大的空穴可达到389.6 nm.利用NH4Cl活化改善沸石试样的离子交换性能,同时辅以微波加热,在微波磁场作用下,使得沸石骨架中部分的Al3+脱离,铵根离子替代Al3+补充到沸石骨架上,将天然沸石改性成型沸石.型沸石单位质量的孔道体积较大,表面结构疏松,与图1所示一致,这说明微波辅助强化NH4Cl溶液改性有助于改善天然沸石表面积、孔径及孔容积.

图1 沸石试样SEM照片
氮气吸附/脱附曲线如图2所示,一次和二次改性试样的氮吸附量大于天然试样的吸附量,且二次改性试样的氮吸附量最大,说明微波辅助强化NH4Cl改性可显著增加沸石样品的比表面积.由孔径分布曲线(见图3)可以看出,天然沸石试样微孔集中分布在10~20 nm,中孔分布在30~40 nm范围内,经微波辅助NH4Cl二次改性后的样品,微孔分布在10~20 nm,中孔分布在40~60 nm,而且二次改性试样的孔径分布曲线在10 nm处的峰发生左移,这是由于改性过程中,NH+4进入孔道与沸石表面的Na+,K+,Mg2+发生置换,填塞沸石部分孔道,导致部分沸石的孔道容积减小,同时经微波预处理后也可以拓宽孔径,使得沸石样品中大孔数量有所增加,因此二次改性样品的表面产生了大量40~60 nm和少量100 nm的新孔.
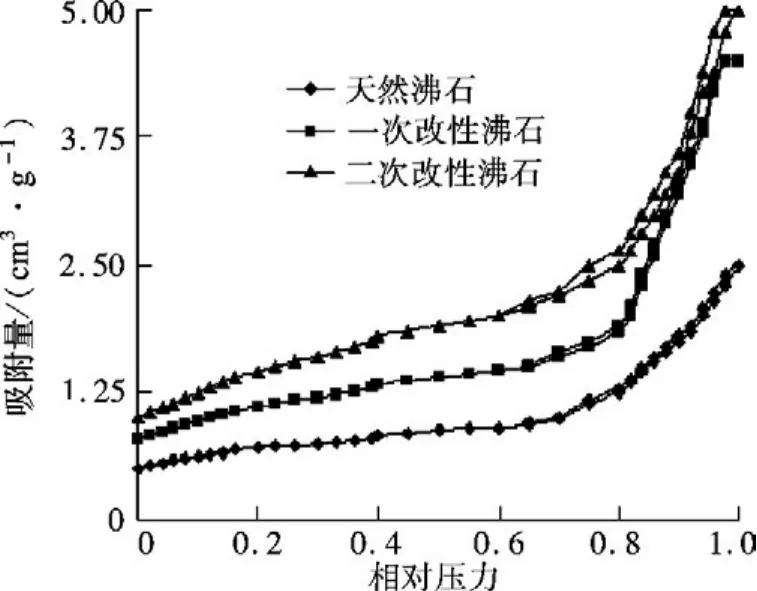
图2 氮气吸附/脱附曲线
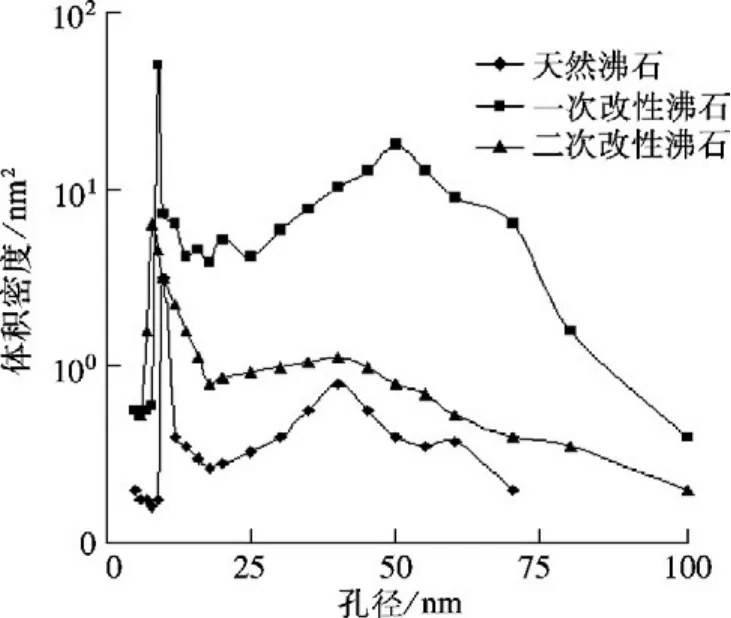
图3 孔径分布曲线
由红外谱图(见图4)可以看出,天然沸石和一次改性沸石的红外谱图曲线基本相同,说明微波改性对于多孔介质骨架结构没有影响,不会引入新的键与官能团,3400与1637 cm-1处为晶格水的吸收峰,1140和650 cm-1为沸石硅氧四面体内部连接的反对称伸缩振动和对称伸缩振动,438 cm-1为Si—O键和 Al—O键的弯曲振动,1071和800 cm-1为硅氧四面体外部连接的反对称伸缩振动和对称伸缩振动;与天然沸石和一次改性沸石的曲线相比,二次改性沸石在1400,1460 cm-1附近出现了双峰,属于NH+4的形变振动,这进一步说明了微波辅助铵盐溶液活化改性处理后沸石会发生脱铝,使得沸石分子筛结构中引入了NH+4.
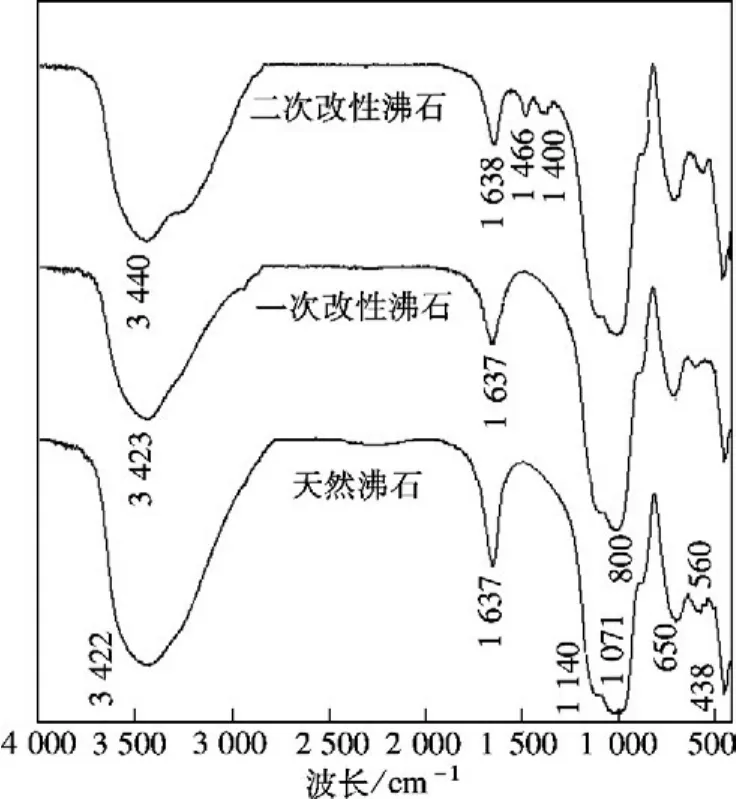
图4 沸石试样的红外谱图
2.2 微波一次改性对沸石调湿速率的影响
天然沸石试样放入变频微波炉中,改变加热时间和微波功率,得到一次改性沸石试样,将5 g一次改性试样于25℃,RH 80%环境下吸湿和25℃,RH 30%环境下放湿,每隔一段时间称重,得到吸湿、放湿动力曲线如图5(a)所示.随着微波加热时间的增加,沸石的吸、放湿效果变好,加热至3 min时,沸石的吸、放湿率可提高至6.6%和2.7%.微波加热功率对沸石吸、放湿率的影响如图5(b)所示.在微波加热时间同为3 min的情况下,加热功率为100 W时,活化改性后的沸石在吸附平衡时对水分子的吸、放湿率比天然沸石提高2.8%和1.6%.
2.3 二次改性沸石试样的调湿性能分析
图6分别为25℃,RH 80%环境下,天然沸石试样、一次改性沸石试样、二次改性沸石试样的吸湿率、放湿率随时间的变化曲线.由图6(a)可知,吸湿36 h后,二次改性试样的吸湿率为32.6%,天然试样的吸湿率仅为6.6%,二次改性后试样的吸湿率提高了25%;由图6(b)可知,二次改性沸石试样的放湿效果为最佳,放湿36 h后,试样的放湿率为19.56%,天然试样的放湿率为2.59%,改性试样的放湿率提高了约17%.
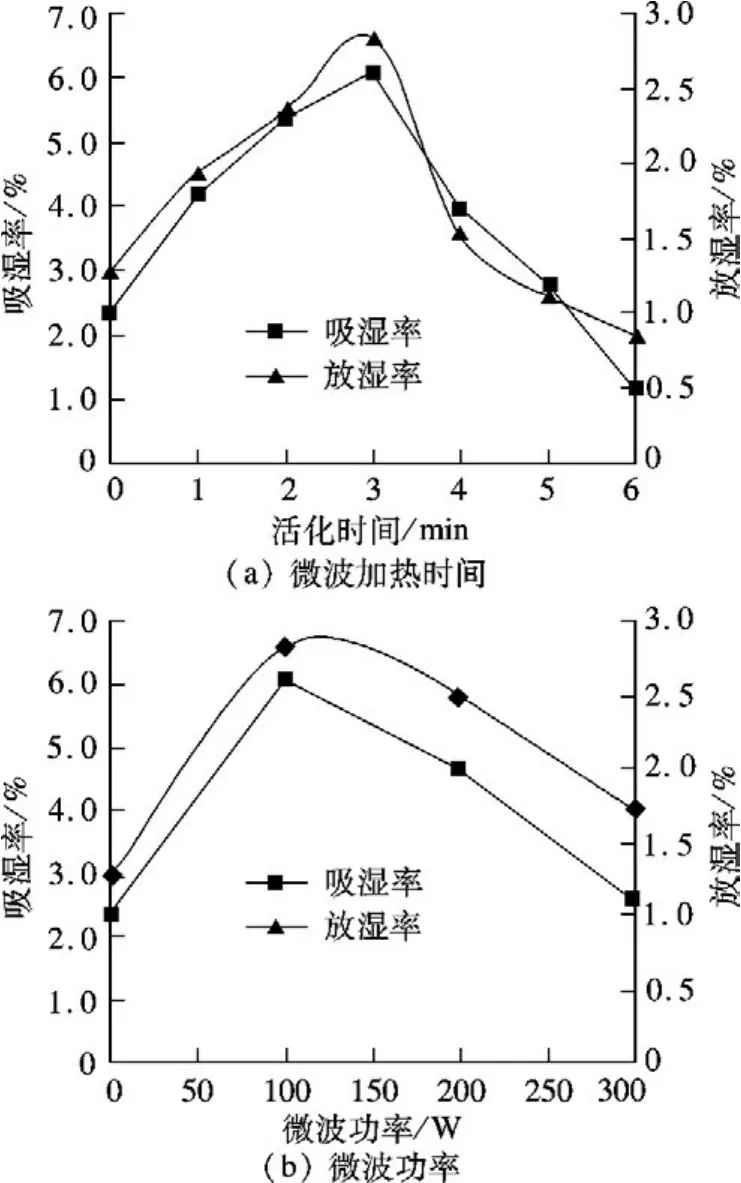
图5 微波加热时间和功率对吸、放湿率的影响
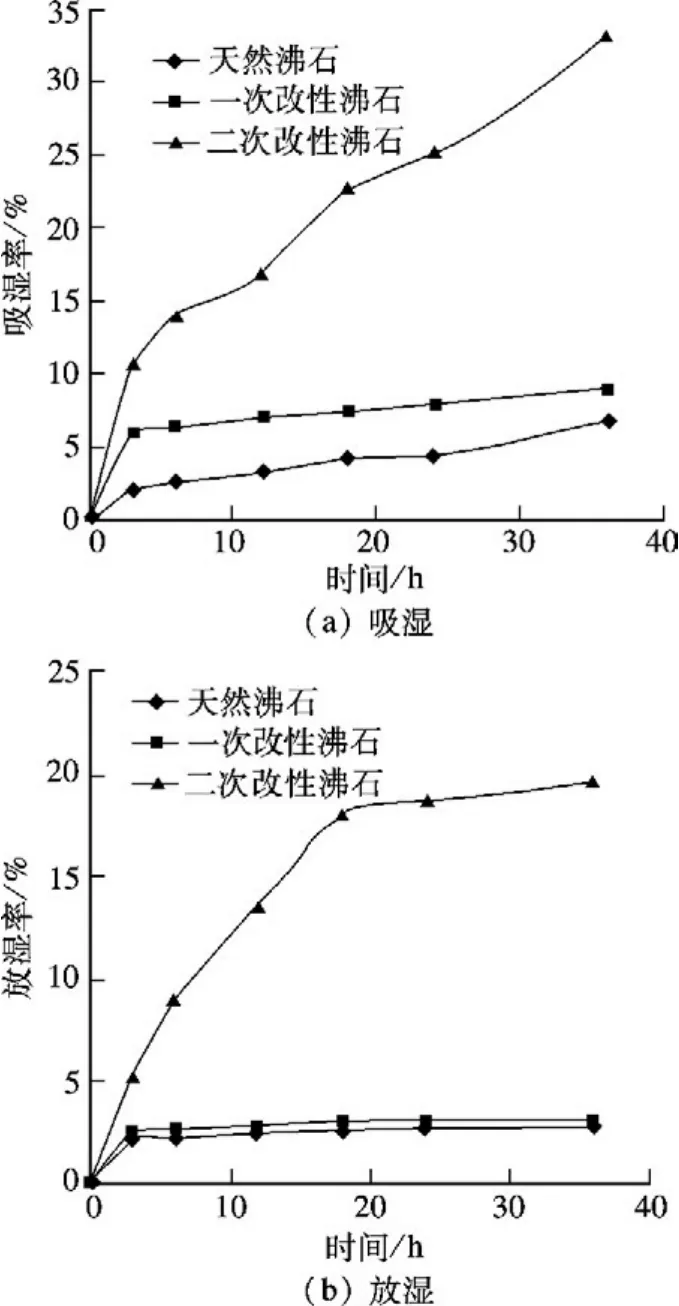
图6 25℃,RH 80%环境下吸、放湿性能
2.4 湿度对二次改性沸石调湿性能的影响
由图7可以看出,二次改性后沸石试样吸湿、放湿能力显著提高.在RH 80%条件下,经过4.5 h可以达到调湿平衡,在RH 30%条件下,4 h可调湿平衡;在相对湿度变化±5%时,调控时间均不超过6 h.从相对湿度变化的曲线看出,当湿度环境发生变化时,二次改性沸石试样依然可以把相对湿度控制在56.8%~60.3%范围内,说明二次改性后的沸石比天然沸石更适合充当墙体湿敏材料.
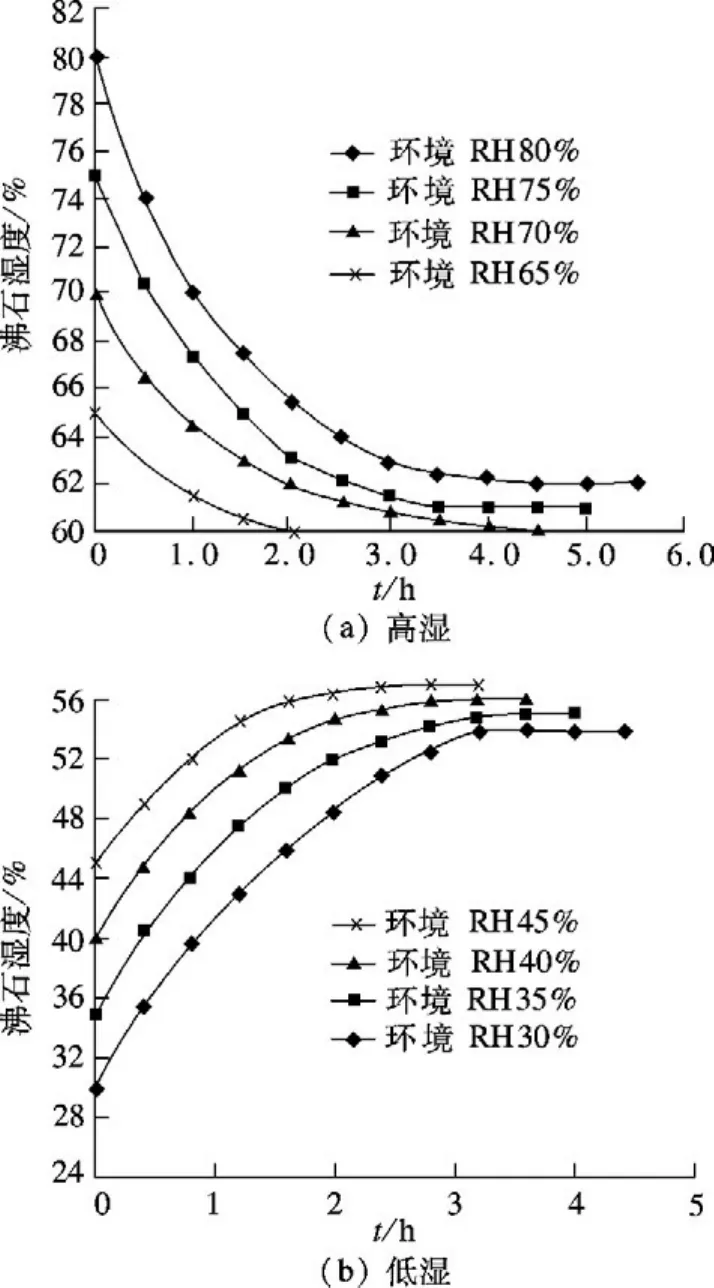
图7 二次改性沸石在不同环境湿度情况下的调湿性
3 结论
1)微波加热时间和功率可优化沸石吸附性能,采用100 W微波加热沸石3 min,得到的改性沸石吸附性能最佳.
2)经微波辅助强化和NH4Cl改性后的沸石,其比表面积、平均孔径和孔容积均比天然沸石要增加;在吸附平衡时改性沸石对水分子的吸、放湿率较天然沸石分别提高25%和17%.
3)经微波辅助强化NH4Cl改性后的沸石,在环境湿度改变的情况下,可以把相对湿度控制在56.8% ~60.3%范围内.
因此,改性沸石试样的调湿性能良好,十分适合用作墙体湿敏材料.
References)
[1]Kalamees T,Korpi M,Vinha J,et al.The effects of ventilation systems and building fabric on the stability of indoor temperature and humidity in Finnish detached houses[J].Building and Environment,2009,44(2):1643-1650.
[2]Abusafa A,Yucel H.Removal of(137)Cs from aqueous solutions using different cationic forms of a natural zeolite:clinoptilolite[J].Separation and Purification Technology,2002,28(2):103-116.
[3]Gonzlez J C,Molina-Sabio M,Rodrguea-Reinoso F.Sepiolite-based adsorbents as humidity controller[J].Applied Clay Science,2001,20(3):111-118.
[4]Janotka I,Krajci L,Dzivak M.Properties and utilization of zeolite-blended portland cements[J].Clays and Clay Minerals,2003,51(1):616-624.
[5]Lee Y,Hriljac J A,Parise J B,et al.Pressure-induced hydration in zeolite tetranatrolite[J].American Mineralogist,2006,91(2/3):247-251.
[6]Zhong Y,Cheng X W,Wang J,et al.Studies on CXN natural zeoliteⅥ.Acid-resistant property and thermal stability of various cation forms[J].Acta Chimica Sinica,2005,63(11):955-960.
[7]Alberti A,Sacerdoti M,Quartieri S,et al.Heating-induced phase transformation in zeolite brewsterite:new 4-and 5-coordinated(Si,Al)[J].Physics and Chemistry of Minerals,1999,26(3):181-186.
[8]Wang X J,Ren J X,Li Y Z,et al.Synthesis of cathode material"carbon-included"LiFePO4 by microwave heating[J].Chinese Journal of Inorganic Chemistry,2005,21(2):249-252.
[9]Wang L,Huang Y D,Jiang R R,et al.Preparation and characterization of nano-sized LiFePO4by low heating solid-state coordination method and microwave heating[J].Electrochimica Acta,2007,52(24):6778-6783.
[10]Hu G R,Liao G,Peng Z D,et al.Structure and electrochemical properties of LiCoO2synthesized by microwave heating[J].Journal of Inorganic Materials,2004,11(3):261-264.
