活猪携带猪瘟病毒检测方法比较
2013-08-14莫胜兰张步娴施开创屈素洁粟艳琼陆文俊
胡 杰,梁 媛,莫胜兰,张步娴,施开创,屈素洁,粟艳琼,陆文俊,苏 凯,李 军
(广西动物疫病预防控制中心,广西南宁530001)
猪瘟(Classical swine fever,CSF )是由黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的猪瘟病毒(Classical swine fever virus,CSFV)引起的一种急性、热性、接触性传染病,可感染各年龄的猪,一年四季都可流行,发病率和病死率均很高,由于其发生频繁,危害大,流传分布广泛,至今仍是世界防控的主要动物疫病之一。CSFV的检测方法包括常规病毒分离鉴定、兔体交互免疫试验、ELISA、荧光抗体染色法和RT-PCR等,特别是随着分子生物学技术的发展,对CSFV的检测方法发展很快,出现了套式PCR、一步法RT-PCR、多重RT-PCR、实时荧光定量PCR等方法[1-8],但这些方法在基层很难大面积推广应用,尤其是养殖企业在人员、设备、技术等方面存在着较大差异,还是倾向于使用荧光抗体法、ELISA等快速、简单易操作的检测技术。这些方法在猪瘟的诊断上各有优缺点,但各方法间的具体差异没有详细资料,CSFV检测方法进行比较的资料有桂祎等[9]用RT-PCR与ELISA试验比较,张朝红等[10]用病毒分离鉴定、荧光抗体法、RT-PCR和夹心ELISA 4种方法检测23份病料的比较;王向鹏等[11]用病毒分离、胶体金免疫层析试纸条、抗原捕捉ELISA、RT-PCR、TaqMan荧光定量 RT-PCR(RT-qPCR)和反转录-环介导等温扩增(RTLAMP)等6种方法,分别对50份疑似猪瘟病料中的CSFV进行检测;袁雪梅等建立了SYBR Green和TaqMan探针的两种荧光定量PCR检测方法,并进行比较[12]。上述资料多数是对病死猪进行检测,还未见有资料对活猪的不同样品间的差异进行比较。本试验对猪的全血、血清、扁桃体和精液4种不同样品用CSFV糖蛋白ErnsELISA、RT-PCR、CSFV抗原ELISA、荧光抗体染色法4种方法进行检测比较,观察不同样品的检测差异及不种方法之间的复合性、重复性等特性。
1 材料与方法
1.1 材料
1.1.1 样品 分别采集广西贵港和横县2个猪场的母猪全血、血清和扁桃体样品各20份和40份,要求所有样品一一对应,并于1个月后再次采集上述样品;同时采集2个场的种公猪精液各15份,并于1个月后再次采集1次,两次采集的样品进行相同方法检测。
1.1.2 试剂 CSFV糖蛋白ErnsELISA试剂盒、CSFV抗原ELISA试剂盒购自北京爱德士世纪元亨有限公司,批号分别为172-480,433902-3320;蛋白酶K为Merxk公司的产品;MiniBEST viral RNA/DNA Extraction Kit Ver.3.0购自宝生物工程(大连)有限公司;凝胶电泳试剂,6×Loading buffer,昆明云科生物技术有限公司产品;dNTPs、M-MLV RTase、Taq 酶,Promega 公 司 产 品;DL Marker 2 000,上海生工生物工程技术服务有限公司产品。
1.1.3 引物合成 参照文献[13]设计,其根据GenBank数据库经典毒株NS3基因序列设计,引物序列为上游引物P1:5′-GCTCCTGGTTGGTAACCTCGG-3′,下游引物P2:5′-TGATGCTGTCACACAGGTGAA-3′,对猪瘟病毒兔化弱毒疫苗株、猪瘟病毒石门系强毒株均能扩增出508bp目的片段,而对牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)则不能扩增出片段,引物由宝生物工程(大连)有限公司合成。
1.1.4 对照毒株来源 猪瘟病毒兔化弱毒株由广西生物制品厂提供,猪瘟病毒石门强毒株种毒由广西兽医研究所惠赠;BVDV Oregon C24V株,购自中国兽药监察所。阳性样品对照包括猪瘟病毒阳性扁桃体、阳性全血样品、公猪精液均为本实验室从猪瘟发病猪场分离、保存;猪瘟阳性血清购中国农业科学院自兰州兽医研究所,批号为20110312。
1.2 方法
血清样品进行CSFV糖蛋白ErnsELISA检测,扁桃体样品进行荧光抗体、CSFV抗原ELISA和RT-PCR检测,全血样品和公猪精液进行CSFV抗原ELISA和RT-PCR检测。
1.2.1 CSFV糖蛋白 Erns(gp44/48)ELISA检测方法 按试剂盒说明书进行。
1.2.2 荧光抗体染色法 由中国兽医药品监察所完成。
1.2.3 CSFV抗原ELISA方法 按试剂盒说明进行测定。
1.2.4 RT-PCR方法
1.2.4.1 样品RNA抽提 按TaKaRa RNA/DNA抽提试剂盒说明进行抽样。
1.2.4.2 反转录-聚合酶链反应(RT-PCR)过程取16μLRNA与1μL的下游引物(25pmol/μL)混匀,于PCR仪中70℃5min、90℃5min后,立即放入冰浴中5min;再在上液中加入如下试剂:5×buffer 5μL,dNTP(2.5mmol/L)4μL,Rnasin 0.5μL,M-MULV Reverse Transcriptase 0.5μL,置PCR仪中42℃反转录1h后于-20℃保存备用;再进行PCR扩增,体系为50μL,其中灭菌去离子水34μL,10×buffer 5μL,dNTP(2.5mmol/L)4μL,cDNA4 μL,P1(25pmol/μL)1 μL ,P2(25pmol/μL)1 μL, Taq DNA polymerase(5μ/μL)1μL,按如下程序扩增 :94 ℃ 预变性10min;94℃1min,53℃1min,72℃1min 30s,35个循环;72℃ 延伸10min。PCR产物用10g/L琼脂糖凝胶电泳并拍照。
2 结果
2.1 2个场母猪3种样品(扁桃体、全血、血清)检测结果
从检测方法差异上看,第1次检测时,荧光抗体染色法、CSFV糖蛋白ErnsELISA、CSFV ELISA、RTPCR 4种检测方法在贵港和横县2个场3种样品的检测结果完全吻合的数量分别为15份和2份,吻合率分别为37.50%(15/40)、10.00%(2/20);第2次检测时,2个场3种样品结果完全吻合的数量分别为21份和7份,吻合率分别为52.50%(21/40)和35.00%(7/20)。若不考虑荧光抗体染色法,2个场3种样品第1次检测时在CSFV糖蛋白ErnsELISA、CSFV ELISA、RT-PCR 3种方法结果完全吻合的数量分别为19份和12分,吻合率分别为47.33%(19/40)和60.00%(12/20),说明荧光抗体染色法与CSF糖蛋白ErnsELISA、CSFV ELISA、RT-PCR存在较大差异,后3种方法有比较高的吻合率(表1和表2)。
从样品类别来看,扁桃体的检出率最高,其次是全血样品,最低是血清;但从RT-PCR、CSFV抗原ELISA方法和CSFV糖蛋白 Erns(gp44/48)ELISA 3种方法看,全血样品的检出率高于扁桃体(表1和表3)。

表1 贵港猪场母猪检测结果Table 1 The detection result of sow in Guigang pig farm
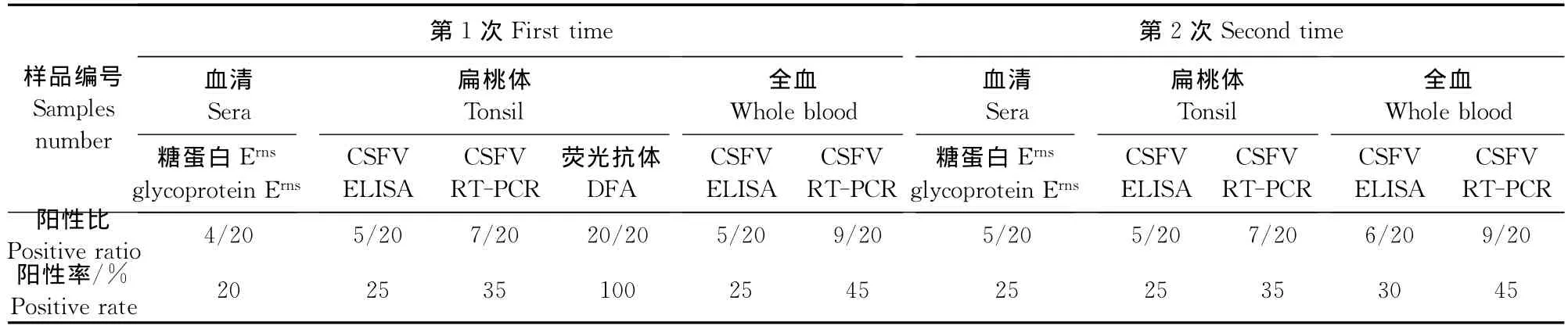
表2 横县猪场母猪检测结果Table 2 The detection result of sow in Hengxian pig farm
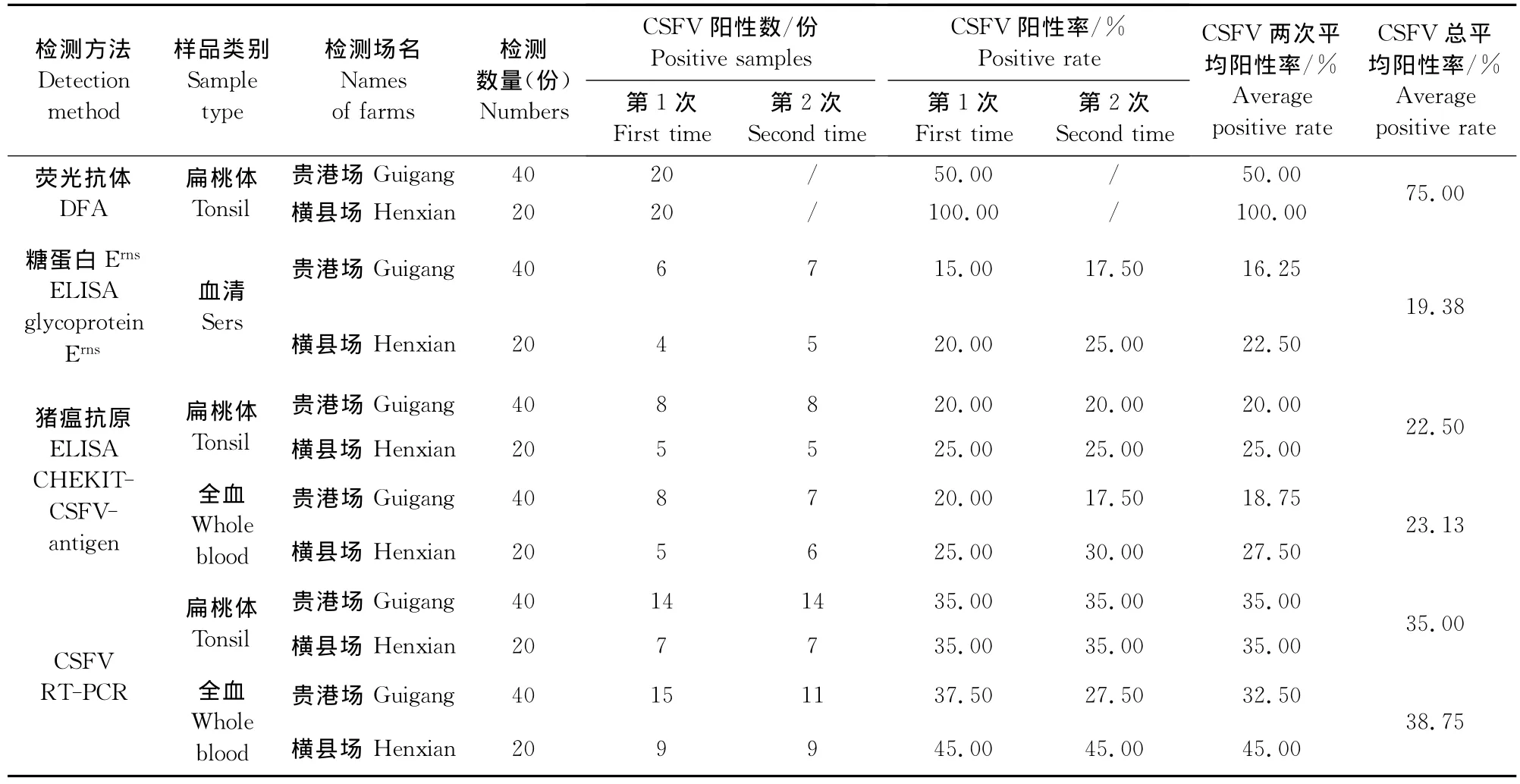
表3 2次检测结果汇总Table 3 Summary of detection results in two tests
从检出阳性率看,4种检测中荧光抗体染色法中扁桃体检出率最高为75%;其次是用RT-PCR方法,全血样品平均检出率为38.75%,扁桃体为35%;CS-FV抗原ELISA方法检出率第3,全血样品平均检出率为23.13%,扁桃体平均为22.50%;CSFV糖蛋白Erns(gp44/48)ELISA检出率最低,血清平均检出率为19.38%(表3)。
从检测的重复性看,CSFV抗原ELISA的检测方法重复性最高,扁桃体和全血平均吻合率分别为87.50%和96.25%%;RT-PCR方法第2,扁桃体和全血平均吻合率分别为75.13%和77.50%;CSFV糖蛋白ErnsELISA方法最低,平均吻合率为71.25%;CSFV抗原ELISA和RT-PCR方法中均是全血样品重复性高于扁桃体 (表4)。
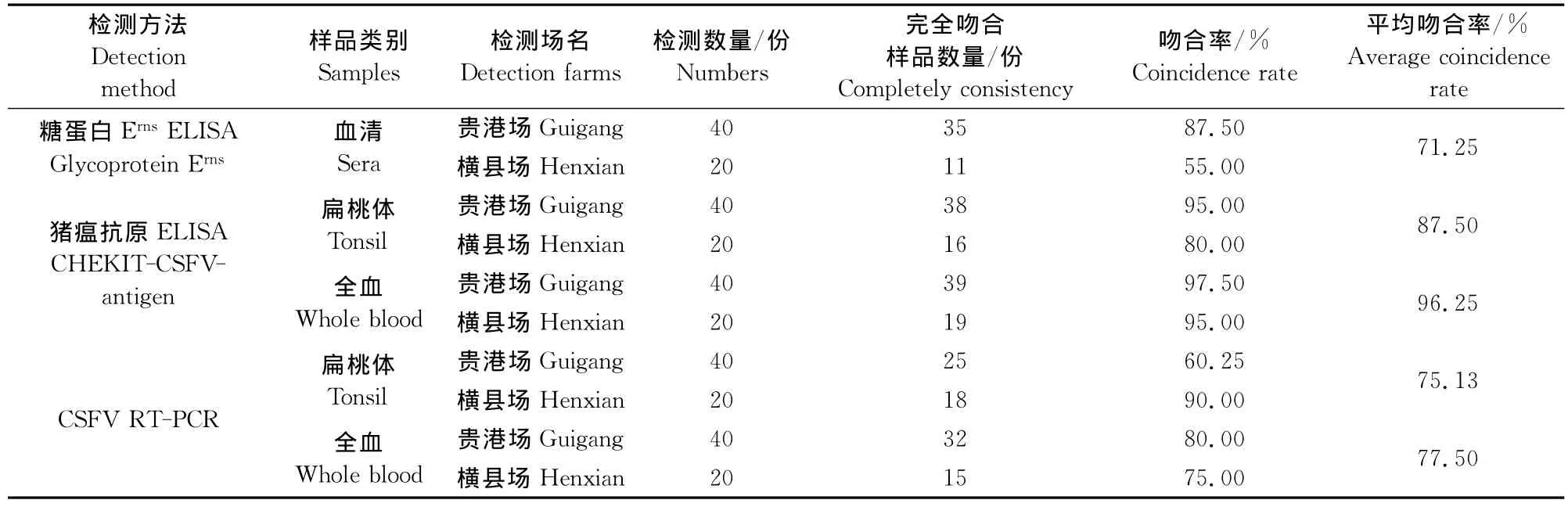
表4 不同方法2次检测吻合率汇总Table 4 Summary of detection result using different ways in two tests
2.2 2个猪场公猪精液的检测结果
用CSFV抗原ELISA和RT-PCR方法2次检测2个场的种公猪精液均是RT-PCR方法检出率高于CSFV抗原ELISA方法,其中贵港场检出率分别是40.00%和33.33%,横县场检出率分别是33.33%和26.67%(表5)。
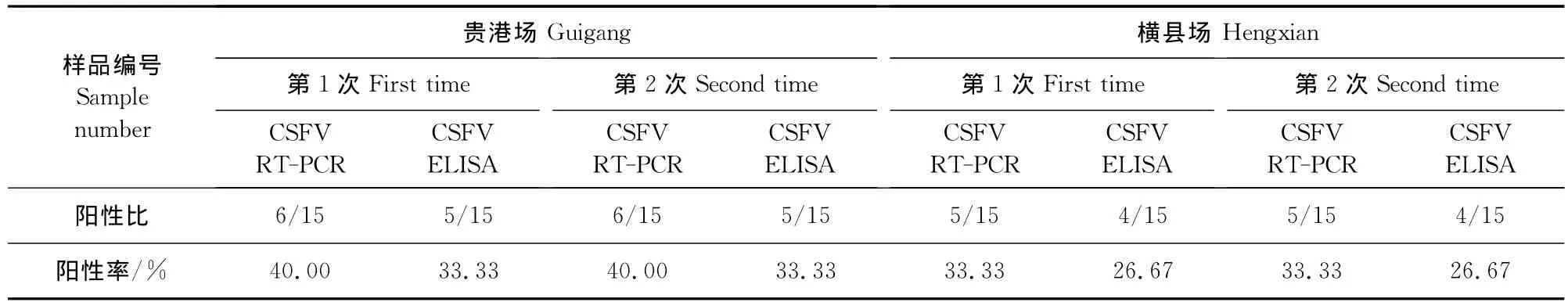
表5 2个场种公猪精液检测结果Table 5 The detection result of swine semen in two farms
2.3 RT-PCR的检测结果
从图1和图2可以看出,标准石门强毒株、猪瘟兔化弱毒疫苗株均能扩增出约508bp目的片段,而BVDV、生理盐水未扩增出相应片段,为阴性,检测样品中2、3、4、10也均能扩增出与标准石门强毒株、猪瘟兔化弱毒疫苗株相同的目的片段,为阳性;检测样品5、6未能扩增出任何片段,为阴性。
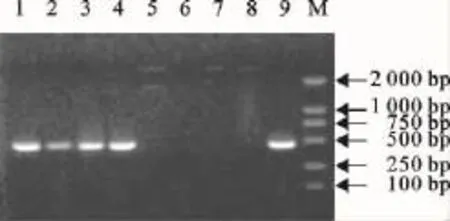
图1 猪瘟病毒RT-PCR检测结果Fig.1 CSFV RT-PCR detection results

图2 猪瘟病毒RT-PCR检测结果Fig.2 CSFV RT-PCR detection results
3 讨论
本试验中扁桃体的检出率最高,其次是全血样品,血清样品最低。4种方法中荧光抗体敏感性最高,RT-PCR方法的敏感性次之,CSF抗原ELISA方法敏感性第3,重复性最好,CSFV糖蛋白ErnsELISA敏感性最低。这几种方法各有优缺点。荧光抗体法对实验人员和仪器有一定要求,过去临床诊断中多推荐采用CSFV荧光抗体检测法,该方法需活体取扁桃体,操作复杂,易出现非特异性荧光,对结果判定人员的素质要求相对较高。扁桃体是猪的免疫器官,采集后猪不愿吃食,出现掉膘,所以不建议采用荧光抗体法;RT-PCR方法不能区分是疫苗株和野毒感染,对操作人员要求较高,还要专门的仪器,同时易出现假阳性,但对全血样品和扁桃体检测均能特异性的检测,可作为初步筛选;CSFV抗原ELISA方法相对来说准确性高、重复性好,可首选,虽然CSFV糖蛋白ErnsELISA的敏感性最低,但可检测出猪群是否感染猪瘟病毒野毒,可作为控制与净化CSF时的备选方法。
CSFV糖蛋白ErnsELISA与CSFV抗原ELISA方两种方法的符合率较高,达75%。血清样品与全血样品存在差异。原因是糖蛋白ErnsELISA主要针对糖蛋白Erns,而CSFV抗原ELISA方法主要针对E2蛋白,E2蛋白是CSFV主要的保护性抗原,是产生中和抗体的主要成分,两者侧重点不同,敏感性存在差异属正常情况。另外,全血样本的敏感性高于扁桃体样本,这可能与病毒发展的时期不同,第2次检测时病毒已发展到病毒血症,所以血液的检出率高于扁桃体样品。
本试验在对2个场的公猪精液进行检测时,发现公猪精液均有CSFV,贵港场平均阳性率在33.33%以上,横县场在26.67%以上,但2个场公猪却不表现临床症状。众所周知,带毒公猪可通过精液将病毒传染给母猪。带毒母猪妊娠后病毒通过胎盘屏障感染胎儿造成垂直传播,产下带毒的仔猪或僵猪不断产毒、排毒,污染环境,感染其他健康猪,形成恶性循环。种公猪在该病的传播中也起着重要作用,病毒可通过带毒公猪精液垂直传播。因此,加强公猪,特别是种公猪的CSFV检测,从种源控制与净化猪瘟至关重要。
如果规模化养猪企业要自行进行大规模CSFV控制与净化工作,建议采用多种方法联合应用。即不同类别的动物采用不同的方法进行CSFV病原检测。主要分为几下几种情况:①种公猪:可采集精液,先用RT-PCR初步筛选,再用CSFV抗原ELISA,两种方法联合应用,均出现阳性者淘汰;②种母猪:采集全血和血清样品,先用RT-PCR初步筛选,再CSFV抗原ELISA复查,两种方法联合进行对应检测,均出现阳性者淘汰;③后备猪和小猪:RT-PCR初筛或CSFV抗原ELISA筛选。
[1] 鲁建民,熊忙利.猪瘟病毒套式PCR检测方法的建立[J].黑龙江畜牧兽医:科技版,2010(10):129-30.
[2] 魏淑英,张启迪,刘焕奇,等.巢式PCR技术在CSF病毒检测中的应用[J].畜禽业,2008(5):6-8.
[3] 任夫渡,张 志,张丽丽,等.猪瘟病毒荧光定量RT-PCR检测方法的建立[J].动物医学进展,2011,32(5):82-85
[4] 殷进方,吴志鹏,江灿芬,等.猪瘟病毒实时荧光RT-PCR检测[J].中国畜牧兽医,2009,36(10):142-144.
[5] 田莉莉,李 林.荧光定量PCR技术在猪病毒病诊断上的应用[J].中国农学通报,2011,27(26):47-51.
[6] Pérez L J,Díaz de Arce H,Tarradas J,et,al.Development and validation of a novel SYBR Green real-time RT-PCR assay for the detection of classical swine fever virus evaluated on different realtime PCR platforms[J].J Virol Meth,2011,174(1-2):53-59.
[7] Huang Y L,Pang V F,Pan C H,et al.Development of a reverse transcription multiplex real-time PCR for the detection and genotyping of classical swine fever virus[J].J Virol Meth,2009,160(1-2):111-118.
[8] Leifer I,Blome S,Beer M,et al.Development of a highly sensitive real-time RT-PCR protocol for the detection of classical swine fever virus independent of the 5'untranslated region[J].J Virol Meth,2011,171(1):314-317.
[9] 桂 祎,李 琼,李彦兵,等.猪瘟病毒RT-PCR核酸检测与EL ISA抗原检测应用研究[J].中国畜牧兽医,2009,36(7):184-186.
[10] 张朝红,张彦明,张永国,等.猪瘟病毒4种检测方法的比较[J].西北农林科技大学学报:自然科学版,2007,35(5):24-28.
[11] 王向鹏,张兴娟,孙 元,等.六种检测猪瘟病毒方法的比较.微生物学报,2010,50(8):1087-1093.
[12] 袁雪梅,陈 宁,陈 宇,等..两种荧光定量PCR方法检测猪瘟病毒的比较及应用,中国动物传染病学报2010,18(3):66-72.
[13] 罗廷荣,莫 扬,吴文德,等.RT-PCR技术检测猪瘟病毒的应用研究[J].中国预防兽医学报,2004,26(4):307-309,312.
