鹿茸顶端组织端粒酶活性检测及TERT基因的差异表达1)
2013-08-08田玉华孟星宇
胡 薇 李 沐 李 婷 田玉华 孟星宇 刘 宁
(吉林农业大学,长春,130118)
鹿茸是梅花鹿的雄性第二性征,每年可周期性的脱落与再生,是哺乳动物中唯一的可再生器官,它的生长发育受特定的分子机理调控。国内外研究发现,鹿茸再生与其它低等生物的断肢再生不同,是一个依赖于干细胞的过程[1-3]。此外,在哺乳动物中,鹿茸的生长速度也是其他组织器官所无法比拟的,在鹿茸生长最旺盛阶段,它以1~2 cm/d的速度快速生长,其顶端增殖区细胞的增殖速度比肿瘤细胞还快,但与肿瘤不同的是鹿茸的生长受到了很好的调控,在维持高速生长的同时并未出现任何癌变迹象[4-5]。鹿茸的这些独特之处使它成为了肿瘤医学和再生医学的研究热点。端粒酶是一种逆转录酶,它由3个亚单位构成,即RNA亚单位(TR),端粒酶催化亚单位(TERT)和端粒酶蛋白亚单位(TEP1)。端粒酶能以自身RNA为模板,催化合成端粒末端(TTAGGG)n序列,使端粒延长,从而延长细胞的寿命甚至使其永生。利用TRAP法可以检测到端粒酶在肿瘤细胞及干细胞中的高活性表达,但在正常细胞中却检测不到端粒酶活性[6]。目前研究表明,有端粒酶活性的细胞几乎均存在TERT的表达,但在正常细胞中虽有TR和TEP的表达,却没有TERT的表达,这说明端粒酶活性主要由TERT的表达水平的高低决定[7-8]。TERT是端粒酶的主要组成部分,TERT基因mRNA表达水平与端粒酶活性存在良好的相关性[9-10]。因此,本研究旨在采用 TRAP法检测鹿茸顶端增殖区各组织部位的端粒酶活性,以及检测体外不同培养代数鹿茸间充质干细胞的端粒酶活性。在此基础上克隆了梅花鹿TERT基因的部分序列,利用相对荧光定量PCR技术分析TERT基因在鹿茸顶端增殖区的表达水平,探讨鹿茸的再生发育与端粒酶活性的关系,期望为深入研究鹿茸生长调控的分子机理提供新思路。
1 材料与方法
1.1 试验材料
新鲜东北梅花鹿鹿茸于2012年6月采自吉林农业大学试验鹿场1头4岁左右的健康雄鹿,保存于液氮中带回实验室备用。胰蛋白酶、透明质酸酶、胶原酶I、胶原酶II购自Sigma;胎牛血清和DMEM高糖培养基购自Hyclone;TRIzoL试剂购自Invitrogen 公司,pMD-18T vector、Ex Taq DNA 聚合酶、OligdT、dNTPs、AMV逆转录酶、限制性内切酶 XbaⅠ和HindIII、DL-2000 Marker购自 TaKaRa公司,Real Master Mix购自长春宝泰克公司。
1.2 鹿茸细胞培养
按照Li等的取材方法[11],在解剖显微镜下定位并分离鹿茸顶端组织茸皮层、间充质层和软骨层。采用酶消化法,将不同部位组织剪成约1 mm的小块,用胶原酶Ⅰ和透明质酸酶37℃消化1.5 h,再加入胶原酶Ⅱ继续消化3 h。当观察到大量细胞从组织块中游离出来时,1 000 r/min离心5 min。将离心收集的细胞与组织块加入含10%血清的DMEM培养液,置于培养箱中37℃、5%的CO2继续培养。
1.3 鹿茸细胞端粒酶活性检测
取对数生长期的茸皮层细胞、间充质细胞和软骨细胞,当细胞丰度达到80%时,用胰蛋白酶消化并离心收集细胞,向细胞沉淀加入CHAPS裂解液200 μL(预先加入PMSF和巯基乙醇),冰浴裂解30 min。4℃、12 000 r/min离心30 min,吸取上清并分装。
以小鼠MA782细胞的端粒酶提取液为阳性对照,采用端粒重复扩增(TRAP)法[12]检测端粒酶活性,引物序列分别为 5'-TCACCTTGTAATCCGTCGAGCAGAGTT-3'(TF)和 5'-CAACAT CTCCACTACCTTCTAACCGTAACC-3'(TR)。TRAP 反应体系为50 μL其组分为10×TRAP缓冲液(200 mmol/L Tris-HCl,pH=8.3,15 mmol/L MgCl2,1%Tween-20(V/V),630 mmol/L KCl,10 mmol/LEGTA)5.0 μL、dATP、dTTP、dGTP 和 dCTP 各 50 μmol(采用蜡封的方式将dCTP与总体系分开),TF引物和反向引物TR各15 pmol,Taq聚合酶2 U,模板2.0 μL,加入无菌 DEPC 处理的水至 50.0 μL。反应条件为25℃保温20 min,反转录合成端粒酶产物,90℃加热3 min灭活端粒酶(在此期间将石蜡熔化以便dCTP进入总反应体系),PCR扩增(94℃ 30 s,64℃ 45 s,72℃ 1 min,30个循环)。通过12%非变性聚丙烯酰胺凝胶电泳分离PCR产物。
1.4 不同培养代数鹿茸间充质干细胞端粒酶活性的检测
用含有10%胎牛血清的DMEM培养鹿茸间充质干细胞,当细胞丰度达到80%时即可传代,分别收集1代至5代的鹿茸间充质干细胞,提取端粒酶并用TRAP法检测端粒酶活性。
1.5 鹿茸细胞总RNA提取与双链cDNA的合成
待鹿茸细胞丰度达到80%以上时收集细胞,按照Trizol操作手册分别提取茸皮层细胞、间充质细胞和软骨细胞样品总RNA,1.0%琼脂糖凝胶电泳检测总RNA质量。以提取的总RNA为模板,以Oligo-dT为引物,以逆转录酶AMV反转录合成双链cDNA。
1.6 梅花鹿TERT基因部分序列的克隆与序列分析
参照GenBank中相关序列,设计TERT基因特异性引物(上游引物:GCCAGAGTCGTG CAGAGG和下游引物:CTTTGACGAACCCTTGGT),以 cDNA为模板进行PCR扩增,利用DNA凝胶回收试剂盒回收PCR产物,将回收产物连接到pMD18-T载体上,转化大肠杆菌DH5α中,涂板并于37℃培养。挑取转化菌落,接种于LB液体培养基,37℃振荡培养过夜,采用碱裂解法小量提取质粒并将鉴定正确的重组质粒送北京三博远志公司测序。并将测序结果分别与 GenBank中牛(NM_001046242)和羊(EU139124.1)的序列进行同源性分析。
1.7 相对荧光定量PCR法检测鹿茸细胞TERT基因的表达水平
合成用于TERT基因的特异引物(上游引物5'-CTGCGCCTACCAGGTGTGT-3'和下游引物 5'-CCGTGGCAGCCTTTCG-3',扩增片段长度为 96 bp,荧光探针:FAM-CGCCGCTCTACGAC CTCCGCTAMRA。以鹿的持家基因actin(GenBank登录号:AY345228)作为内参基因,合成actin引物(上游引物 5'-TGACCCTTAA GTACCCCATCGA-3'和下游引物5'-TTGTAGAAG GTGTGGTGCCAGAT-3'),扩增片段长度为 85 bp,荧光探针:FAM-CACGGCATCGTCACCA ACTGGGA-TAMRA。
以鹿茸细胞cDNA为模版,PCR分别扩增TERT和 actin。PCR 体系:cDNA 模板 6.00 μL,上下游引物各 1.00 μL,dNTP 2.00 μL,10×Ex Taq buffer 2.50 μL,Ex Tag 0.25 μL,加去离子水至 25 μL。反应条件:94℃预变性5 min,94 ℃ 30 s,59 ℃ 30 s,72 ℃30 s,进行40个循环。采用Real Master Mix试剂和7500 Real Time PCR System分析TERT基因在茸皮层细胞、间充质和软骨细胞中的表达水平。Realtime PCR体系:1ng总RNA反转录的cDNA,上下游引物各 5 pmol,10 μL real Master Mix,总体积为 25 μL。反应条件:94℃激活DNA聚合酶3 min;94℃变性30 s;59℃复性30 s;68℃延伸45 s;进行40个循环。使用StepOne Software v2.1软件分析TERT相对内参actin基因的差异表达Ct值(Ct为荧光达到荧光阈值的循环数)。
2 结果与分析
2.1 鹿茸顶端不同组织细胞的端粒酶活性检测
TRAP法检测结果(图1)显示,在鹿茸顶端增殖区茸皮层细胞、间充质细胞及软骨细胞中均检测到端粒酶活性,与小鼠MA782细胞相比,端粒酶活性在间充质细胞、软骨细胞和茸皮层细胞中依次降低,其中,间充质干细胞中端粒酶活性最高。

图1 鹿茸顶端不同组织细胞的端粒酶活性检测结果
2.2 不同培养代数鹿茸细胞的端粒酶活性检测
采用TRAP法进行端粒酶活性的测定。与对照组小鼠乳腺癌细胞相比,不同代数间充质干细胞端粒酶活性变化无明显差异。说明鹿茸再生过程与端粒酶活性呈一定的相关性,端粒酶可能是研究鹿茸再生机理的一个很重要的方向(图2)。

图2 体外培养1代至5代的间充质细胞端粒酶活性
2.3 鹿茸顶端组织总RNA的提取
各样品总RNA经1%琼脂糖凝胶电泳检测后,28S、18S和5S 3条带清晰可见(图3),表明所提取的茸皮层、间充质和软骨组织总RNA质量符合定量PCR分析用标准,未发生RNA明显降解。
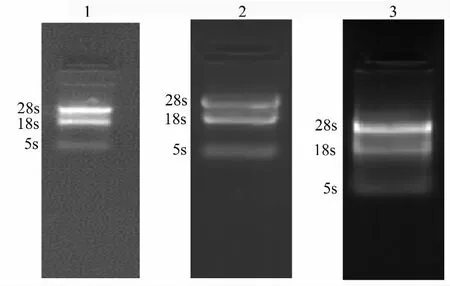
图3 鹿茸顶端组织RNA提取结果
2.4 TERT基因部分序列的克隆
TERT基因PCR扩增产物经1%琼脂糖凝胶电泳得到约915 bp的1条特异性条带(图4),与预期结果相符。提取重组质粒,用XbaⅠ和HindIII双酶切质粒pMD-18T-TERT(图5)。从图4中可看出,可获得与目的带大小相符的电泳条带915 bp,表明克隆成功。

图4 TERT基因部分序列克隆PCR鉴定结果
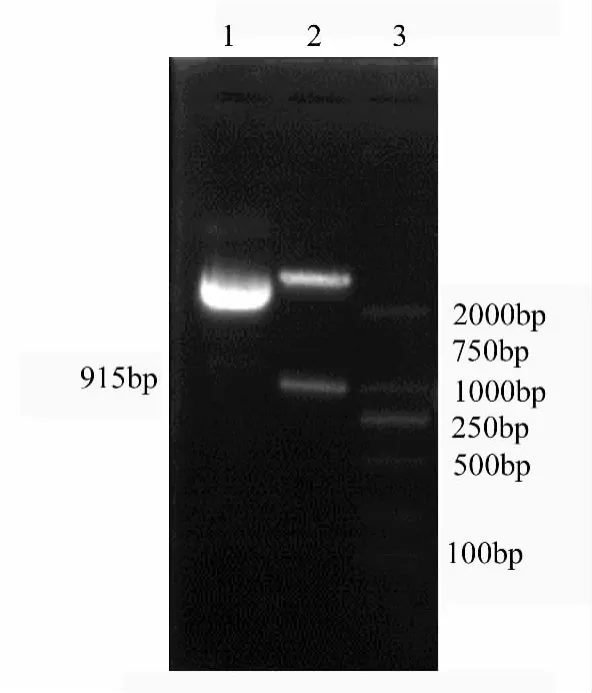
图5 TERT基因部分序列克隆双酶切鉴定结果
2.5 TERT基因的部分cDNA序列分析
梅花鹿TERT基因部分序列与GenBank中牛和羊的核苷酸和氨基酸序列Blast分析结果显示:梅花鹿TERT基因编码区部分cDNA为915 bp,核苷酸序列与牛、羊的同源性分别为94.89%和94.31%(图6);氨基酸序列同源性分别为92.16%和92.11%(图7)。
2.6 TERT基因在鹿茸顶端组织中的表达水平
以鹿茸顶端组织cDNA为模版,PCR分别扩增actin和TERT。actin扩增长度为85 bp,TERT扩增片段长度为105 bp,见图8。利用Real time PCR的方法,使用梅花鹿actin作为内源参照基因,每个样本做3个重复,检测TERT基因在鹿茸组织不同部位的表达丰度。通过RT-PCR和Real time PCR检测分析发现,在鹿茸顶端组织不同部位TERT基因mRNA表达水平存在明显的表达差异,其中茸皮层细胞、软骨细胞和间充质细胞中TERT基因的表达量呈递增趋势(图8和表1)。

图6 梅花鹿、牛、羊TERT基因核苷酸序列分析结果

图7 梅花鹿、牛、羊TERT基因氨基酸序列分析结果
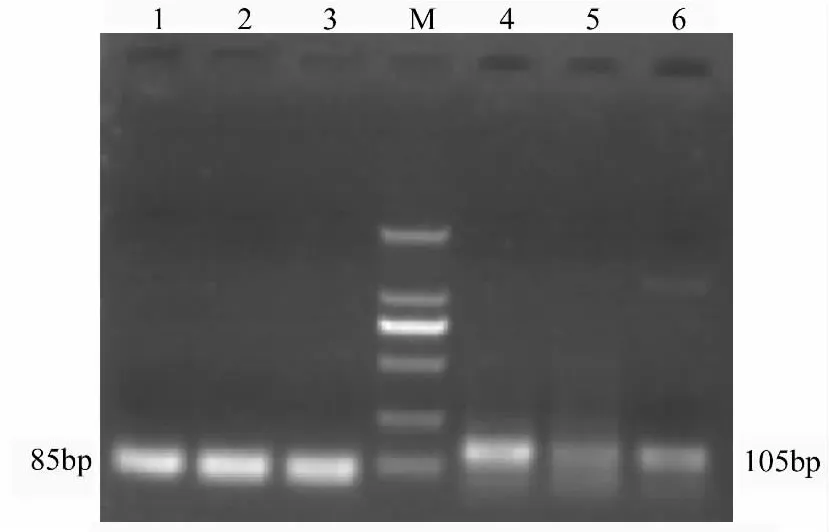
图8 鹿茸顶端组织不同部位TERT基因及actin基因RTPCR结果

表1 鹿茸组织TERT基因表达丰度检测结果(n=3,¯x±s)
3 结论与讨论
己有大量的证据显示,鹿茸的再生建立与来源同特定位置的组细胞有关,也就是生茸区骨膜中的干细胞,即鹿茸的再生包含大量间充质干细胞的形成。由于鹿茸的独特性质,更深入地了解鹿茸再生对于再生医学的研究十分重要。因此,不断地深入探索鹿茸再生过程内部的调控机制是目前研究者的共同目标。端粒酶是一种逆转录酶,它以自身RNA为模板合成富含脱氧单核糖鸟苷的端粒DNA序列,从而弥补因有丝分裂而消耗的端粒长度,在延长细胞寿命上起着重要作用。近年来许多学者对端粒酶的研究结果表明,端粒酶调控着细胞增殖活性和细胞寿命,是决定基因扩增和稳定的主要因素。端粒酶在大部分正常的体细胞中活性受到明显的抑制,在大多数肿瘤细胞及干细胞等增殖旺盛的细胞中则可检测到高活性的端粒酶,而鹿茸细胞在快速生长期的增殖速度比肿瘤细胞还快。Lee等[13]体外研究表明,端粒酶的过表达能提高胚胎干细胞的增殖、分化能力。Flores等[14]研究小鼠的表皮干细胞,发现其端粒长度和端粒酶的活性影响着表皮干细胞的增殖、迁移和分化;端粒的缩短可抑制干细胞的动员,从而抑制表皮干细胞的体外增生。顶端增殖区是梅花鹿鹿茸的生长中心,已有研究显示,鹿茸的再生是一个基于干细胞的过程,而间充质就是鹿茸再生的干细胞储备层[15]。因此,开展鹿茸细胞端粒酶活性的相关研究,对于探讨鹿茸周期性再生发育机理是一个重要的新思路。
本研究从鹿茸顶端增殖区分离培养了茸皮层、间充质层和软骨层细胞,并采用TRAP法检测其端粒酶活性。结果显示,在这4种细胞中均表现出不同程度的端粒酶活性,其中间充质层细胞的端粒酶活性明显高于其他组织层细胞,端粒酶活性在增殖区的各层中呈现递减的趋势,随着细胞逐渐分化成熟,端粒酶活性逐渐降低。这也支持了间充质细胞是鹿茸生长过程中的干细胞来源这一说法。此外,本研究同时利用TRAP法检测了体外培养不同代数的间充质细胞的端粒酶活性,结果显示,在体外培养的不同代数间充质细胞端粒酶活性并没有明显变化。这一结果进一步证明,在鹿茸快速生长阶段,其顶端生长中心表达了端粒酶,端粒酶在鹿茸的生长发育中可能具有重要的作用。这与孙浩然等[15]推断,在生长速度极快的鹿茸中很可能表达端粒酶,以维持高速的增殖分化,端粒酶可能参与调控鹿茸的生长发育的结果基本一致。
在端粒酶组分中,端粒酶逆转录酶具有反转录酶活性,TERT基因在调节端粒酶活性中起决定作用。TERT是端粒酶发挥作用的重要限速步骤。本研究初次获得了梅花鹿TERT基因的部分cDNA序列,并发现与牛和羊的TERT基因的同源性较高,说明该基因进化程度比较保守。以此设计探针利用荧光定量PCR技术检测鹿茸顶端不同组织部位TERT基因的表达水平。结果表明,在间充质细胞中TERT基因的mRNA表达量最高,其次为软骨细胞和茸皮层细胞,TERT在增殖区的各层中的表达量呈现递减的变化,与端粒酶活性变化模式相一致,这一结果验证了TRAP法检测端粒酶活性结果的可信性。
目前,鹿茸细胞中端粒酶活性的研究才刚刚起步。Kierdorfu等[16]研究显示,鹿茸再生是是由于角柄末梢的骨膜干细胞受到激活,从而完成鹿茸的再生。近年来,Li等[17-18]对赤鹿生茸骨膜的发育进行了大量的研究,认为具有极强的分化能力的骨膜可能是出生后仍保留的胚胎组织。随着鹿茸的生长,骨膜组织向间充质组织转化,而其中的间充质细胞仍然具有干细胞的特征,在体内可以向软骨组织转化[19-20]。但是由于鹿种的差别,在梅花鹿中骨膜很薄,要想从骨膜中将细胞层从纤维层中剥离开来很难,因此,选择分离仍然具有干细胞特征的间充质干细胞为主要研究对象,分析鹿茸间充质干细胞端粒酶活性和TERT基因的表达水平。由此,推测鹿茸干细胞的永生化能力和端粒酶活性的相关性,以及端粒酶在鹿茸的生长规律和再生调节机制等方面可能具有的重大意义,这些问题国内外研究甚少,研究结果说明,在鹿茸的快速生长期,其顶端增殖区的各层组织中均表达了不同活性的端粒酶,并且端粒酶活性与细胞的分化状态有关,细胞分化程度越低端粒酶活性越高,说明端粒酶可能参与调控鹿茸细胞的增殖与分化,可能是鹿茸快速生长的原因之一,这也给人们带来了许多新的思考,笔者将通过课题的不断深入开展和探索,为鹿茸再生机理的阐明提出一些新的观点。
[1] Price J,Allen S.Exploring the mechanisms regulating regeneration of deer antlers[J].Philos Trans R Soc Lond B Biol Sci,2004,359:809-822.
[2] Suttie J M,Gluckman P D,Butler J H,et al.Insulin-like growth factor 1(igf-1)antler stimulating hormone[J].Endocrinology,1985,116(2):846-848.
[3] Suttie J M,Gluckman P D,Fennessy P F,et al.Elevated plasma igf1 levels in stags prevented from growing antlers[J].Endocrinology,1988,122(6):3005-3007.
[4] Suttie J M,White R G,Breier B H,et al.Photoperiod associated changes in insulin-like growth factor-i in reindeer[J].Endocrinology,1991,129(2):679-682.
[5] Price J,Faucheux C,Allen S.Deer antlers as a model of mammalian regeneration[J].Curr Top Dev Biol,2005,67:1-48.
[6] 朱晓应,符伟军,洪宝发.端粒酶与肿瘤靶向治疗[J].国外医学遗传分册,2005,28(6):366-368,353.
[7] Counter C M,Meyerson M,Eaton E N,et al.Telomerase activity is restored in human cells by ectopic expression of hTERT(hESTZ),the catalytic subunit of telomerase[J].Oncogene,1998,16(9):1217-1222.
[8] Ramakrishnan S,Eppenberger U,Mueller H,et al.Expression profile of the putative catalytic subunit of the telomerase gene[J].Cancer Res,1998,58(4):622-625.
[9] Lehner R,Enomoto T,McGregor J A,et al.Quantitative analysis of telomerase hTERT mRNA and telomerase activity in endometrioid adenocarcinoma and in normal endometrium[J].Gynecol Oncol,2002,84(1):120-125.
[10] 田玉华.梅花鹿角脱盘蛋白多肽的分离纯化及活性研究[D].长春:吉林农业大学,2011.
[11] Li C,Waldrup K A,Corson I D,et al.Histogenesion of antlerogenic tissues cultivated in diffusion chambersin vivo in red deer(Cervus elaphus)[J].J Exp Zool,1995,272(5):345-355.
[12] 吴东林.端粒重复扩增程序(TRAP)的改进和应用以及端粒酶酶学性质研究[D].长春:中国人民解放军军需大学,2001.
[13] Lee M K,Hande M P,Sabapathy K.Ectopic mTERT expression in mouse embryonic stem cells does not affect differentiation but confers resistance to differentiation-and stress-induced p53-dependent apoptosis[J].J Cell Sci,2005,118:819-829.
[14] Flores I,Cayuela M L,Blasco M A.Effects of telomerase and telomere length on epidermal stem cell behavior[J].Science,2005,309:1253-1256.
[15] 孙浩然,郑伟,吴山力,等.梅花鹿鹿茸细胞端粒酶活性及其mRNA表达的检测[J].安徽农业科学,2011,39(2):1073-1075.
[16] Kierdorfu U,Kierdorf H,Szuwart T.Deer antler regeneration:cells,concepts,and controversies[J].Morphol 2007,268(8):726-38.
[17] Li C,Suttie J M.Deer antlerogenic periosteum:a piece of postnatally retained embryonic tissue[J].Anat Embryol,2001,204(5):375-388.
[18] Li C,Harris A J,Suttie J M.Tissue interactions and antlerogenesis:new findings revealed by a xenograft approach[J].J Exp Zool,2001,290(1):18-30.
[19] Gyurján I Jr,Molnár A,Borsy A,et al.Gene expression dynamics in deer antler:mesenchymal differentiation toward chondrogenesis[J].Mol Genet Genomics,2007,277(3):221-235.
[20] Mount J G,Muzylak M,Allen S,et al.Evidence that the canonical Wnt signalling pathway regulates deer antler regeneration[J].Dev Dyn,2006,235(5):1390-1399.
