益生菌对发酵酸乳蛋白的影响
2013-08-07闵伟红姜铁民陈历俊
药 璐,闵伟红,姜铁民,陈历俊,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.北京三元食品股份有限公 司,北京 100076)
随着人们生活水平和健康消费意识的提高,发酵酸乳以其独特的风味和营养价值日益受到人们的重视。尤其是添加益生菌的发酵乳制品,其无论是在产品特性还是在保健功能上都受到广泛关注。因此许多产品都利用益生菌与传统的乳酸菌嗜热链球菌(Streptococcus thermophilus )和保加利亚乳杆菌(Lactobacillus bulgaricus)共同发酵生产酸乳制品[1-3]。
益生菌具有提高免疫力、降低胆固醇、治疗风湿病、抗 癌、提高乳糖耐受性、阻止或降低特异性皮炎和局限性回肠炎、治疗链球菌病、泌尿系统感染等功能[4-6]。这也是消费者喜爱益生菌发酵酸乳的原因,另一方面由于益生菌的发酵分解作用,使酸乳中游离氨基酸、维生素、糖类和矿物质含量高于鲜牛乳[7]。因此益生菌发酵酸乳作为营养性保健食品在世界范围内迅速发展,其营养功效也非常明显。由于受蛋白质降解产物如多肽、氨基酸以及氨基酸的代谢产物等的影响,不同菌种发酵酸乳的品质和功能特性也有很大差异[8]。目前国内关于益生菌对发酵酸乳蛋白的影响还未有深入的报道。
本实验选用目前常用的两株益生菌:干酪乳杆菌(Lactobacillus casei)和植物乳杆菌(Lactobacillus plantarum)与传统的乳酸菌共同发酵,以响应面优化后的最优生产工艺条件制备发酵酸乳。通过对比分析探讨了益生菌对发酵酸乳蛋白的影响,为研究益生菌在酸乳中的发酵机理提供参考。
1 材料与方法
1.1 菌种与试剂
嗜热链球菌(Streptococcus thermophilus,St)、保加利亚乳杆菌(Lactobacillus bulgaricus,Lb)、干酪乳杆菌(Lactobacillus casei,Lc) 丹尼斯克(中国)有限公司;植物乳杆菌(Lactobacillus plantarum,Lp) 中国工业微生物菌种保藏管理中心;脱脂乳粉 新西兰进口脱脂乳粉;蛋白Marker 北京全式金生物技术有限公司;十二烷基磺酸钠(SDS)、巯基乙醇、过硫酸铵、TEMED、Tris碱、游离氨基酸标准品 美国Sigma-Aldrich公司;丙烯酰胺、甲叉双丙烯酰胺 美国Amresco公司;乙腈、三氟乙酸 美国Thermo Fisher Scientif ic公司;AccQ·TagTMUltra缓冲盐溶液 美国Waters公司。
1.2 仪器与设备
Mini Protean Ⅱ蛋白电泳仪 美国Bio-Rad公司;UVP GDS-8000凝胶成像仪 上海天能公司;Cintra20紫外-可见光分光光度计 澳大利亚GBC公司;高效液相色谱仪 日本岛津公司;超高效液相色谱仪 美国Waters公司;冷冻干燥离心机 德国Sigma公司;PB-10型pH计 赛多利斯科学仪器有限公司。
1.3 方法
1.3.1 酸乳生产工艺
脱脂乳粉120g/L复原→灭菌(110℃,10min)→冷却→接菌→分装→发酵→冷藏后熟(4.0℃,24h)→成品。不同菌种的实验条件如表1所示。

表 1 不同菌种组合发酵酸乳的实验条件Table 1 Fermentation conditions for yogurt with different strains
1.3.2 样品的处理
取1mL发酵酸乳样品,加入所需稀释倍数的双蒸水,将发酵样品配成蛋白质量浓度约2~5mg/mL的溶液,吸取20μL液体,加入等体积的样品缓冲溶液,沸水浴10min,然后12000r/min离心10min,用于聚丙烯酰胺凝胶电泳的测定。
取适量的发酵酸乳样品,用手持均质机均质2min,将pH值调至4.6,室温静置30min,4500r/min离心30min,上清液(pH4.6可溶性部分)用Whatman硬化 无灰级定量滤纸(NO.42,2.50μm)过滤,滤液保存于-20℃待用,用于氨基氮含量的测定。上清液(pH4.6可溶性部分)用0.22μm的膜过滤,滤液保存于-20℃备用,用于pH4.6可溶性氮的测定。滤液用1.00mol/L NaOH溶液调pH值至8.20~10.00之间,最后用0.22μm的膜过滤后保存于-20℃待用,用于游离氨基酸的分析测定。
1.3.3 SDS-PAGE电泳
SDS-PAGE电泳测定方法参照文献[9],12%分离胶和4%浓缩胶。采用恒压电泳,80V预电泳,待样品进入分离胶后调整电压为120V。待指示剂溴酚蓝前沿到达电泳槽底部时,停止电泳。
1.3.4 氨基氮含量的测定
氨基氮包括游离氨基酸和小肽,采用邻苯二甲醛(o-phthaldialdehyde,OPA)分光光度法测定12%TCA可溶性组分中氨基氮的含量[10],伯氨基(α-氨基和ε-氨基)与邻苯二甲醛和β-巯基乙醇反应形成的加合物在340nm有强烈的光吸收。取50μL已过滤的上清液,加入1mL邻苯二甲醛试剂中,室温下计时反应 2min,340nm波长处测定吸光度。
邻苯二甲醛试剂的配制:准确称取40mg OPA溶解于1.0mL甲醇中,加入100μL β-巯基乙醇、0.95g四硼酸钠(Na2B4O7·H2O)、0.50gSDS,溶解后定容50mL,现配现用。
氨基酸标准曲线的制作:配制1.0mg/mL亮氨酸溶液,稀释为质量浓度分别为50、100、200、300、400、500μg/mL的标准溶液系列,按照上述方法测定吸光度,制作标准曲线,计算样品中氨基氮的含量。
1.3.5 反相高效液相色谱法(RP-HPLC)检测pH4.6可溶性氮的变化
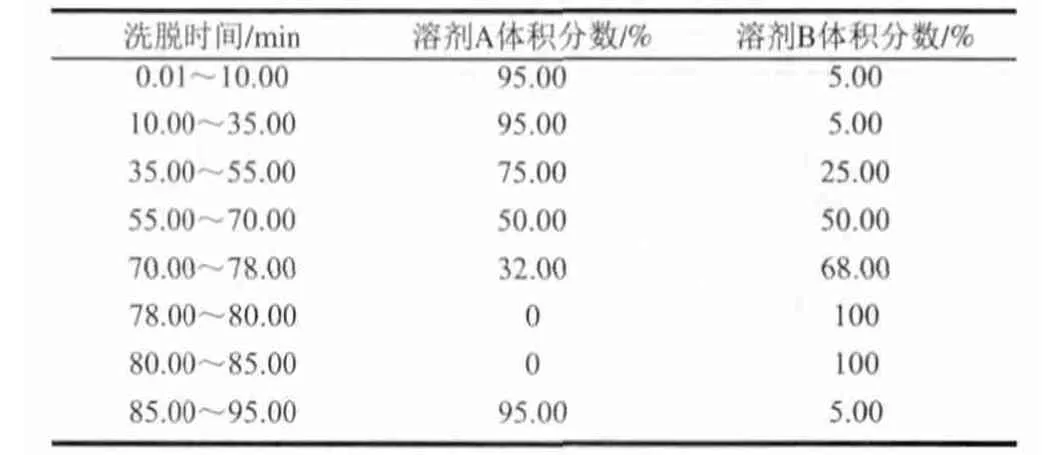
表 2 RP-HPLC梯度洗脱程序Table 2 RP-HPLC Gradient elution procedure
采用Waters公司的RP-HPLC对其进行测定,色谱柱选用Agela Venusil XBP C18(250mm×4.6mm, 孔径150Å,5.0μm粒径)色谱柱,柱温35℃;流动相包括溶剂A:0.10%三氟乙酸(TFA)水溶液,溶剂B:0.10%三氟乙酸(TFA)乙腈溶液;流速:0.80mL/min;检测波长:214nm;进样量:10μL;梯度洗脱程序如表2所示。
1.3.6 游离氨基酸含量的测定
采用Waters公司的UPLC进行游离氨基酸分析,色谱柱选用ACCQ·TagTMUltra氨基酸色谱柱(2.1mm×100mm)。AccQ·TagTMUltra缓冲盐溶液配制:取12.50mL的AccQ·TagTMUltra缓冲盐溶液定容到250mL即可。
用AccQ·TagTMUltra方法进行氨基酸的柱前衍生,具体方法如下。1)将10μL样品和70μL AccQ-TagTMUltra硼酸盐缓冲剂添加到完全回收样品瓶中振荡数秒,对照组为80μL AccQ-TagTMUltra硼酸盐缓冲剂。2)加入20μL AccQTagTMUltra试剂,立即涡旋混合几秒钟,静置1min。3)将样品置于55℃培养箱中保持10min,取出,排气泡后用于游离氨基酸含量的测定。流动相A:AccQ·TagTMUltra缓冲盐溶液,流动相B:乙腈。进样量1μL。梯度洗脱程序及其他仪器参数设置如表3、4。游离氨基酸标准曲线的制作:将2.50μmol/mL的17种氨基酸混标,稀释到浓度分别为0.02、0.05、0.10、0.20、0.40、0.80μmol/mL的标准溶液系列,按照上述梯度洗脱程序进行测定,制作标准曲线。
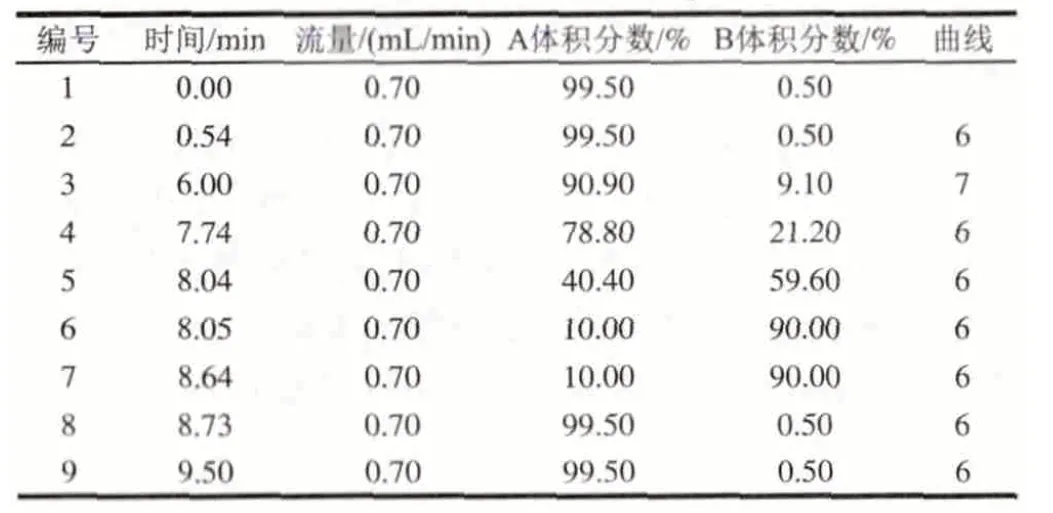
表 3 UPLC梯度洗脱程序Table 3 UPLC Gradient elution procedure
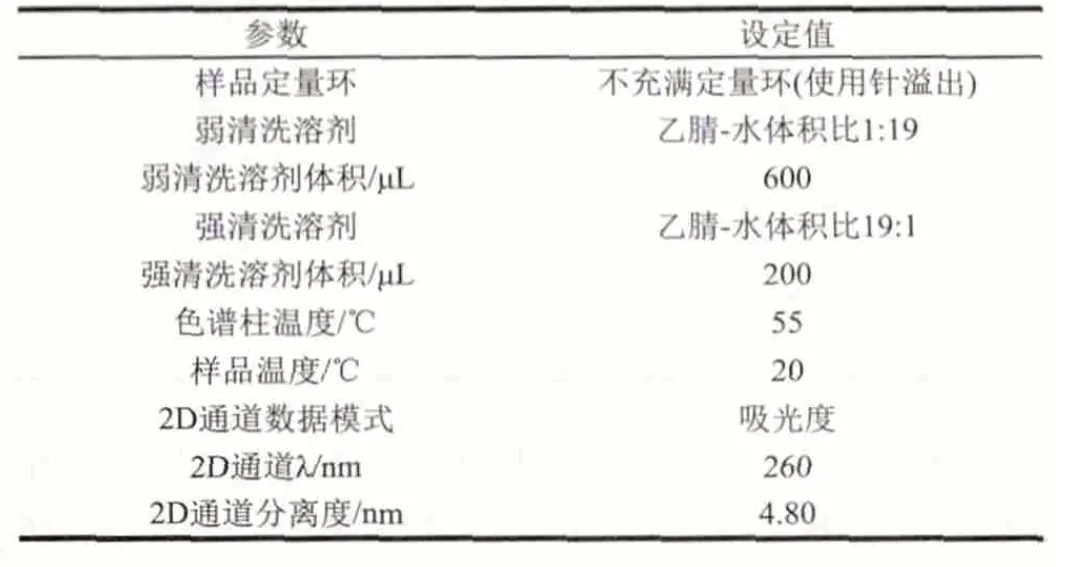
表 4 样品管理器、溶剂管理器及PDA检测器参数Table 4 Parameters of sample manager, solvent manager and PDA detector
2 结果与分析
2.1 酸乳样品蛋白的变化
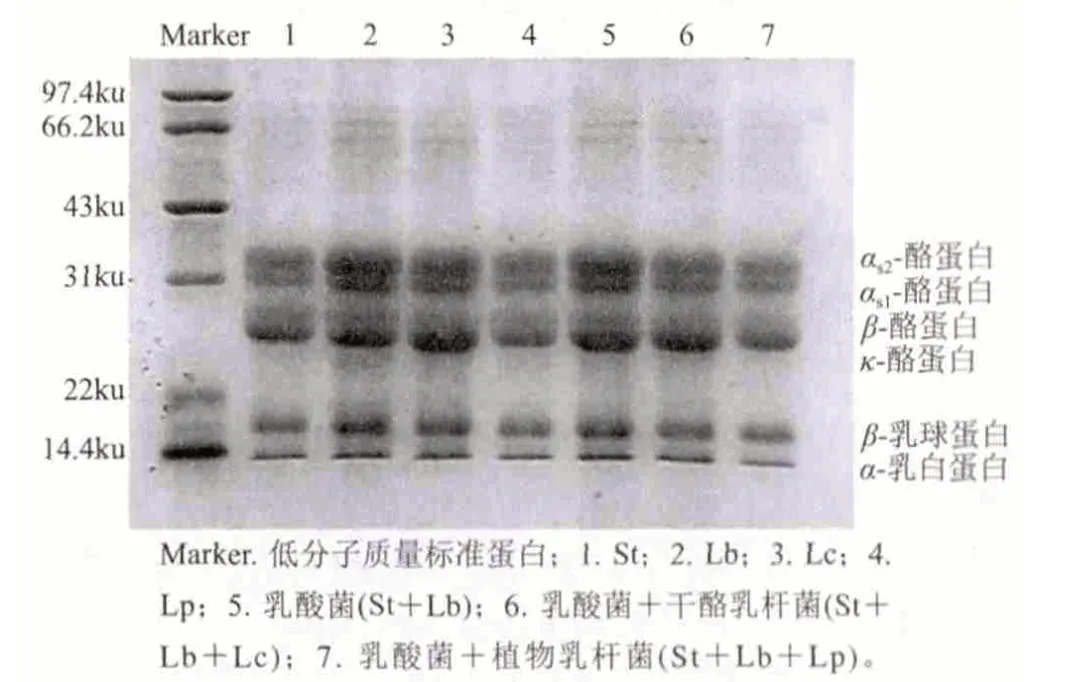
图 1 酸乳样品稀释6倍电泳图Fig.1 SDS-PAGE of 6-fold diluted yogurt samples
SDS-PAGE电泳方法具有重复性高、线性关系良好等优点,普遍用于分离分子质量为20~100ku之间的蛋白质。由图1可知,当酸乳样品稀释6倍时,大分子蛋白分离效果较好,而且从电泳图可以明显的看出无论是单菌种St、Lb、Lc、Lp发酵酸乳,还是混合菌种发酵酸乳St+Lb、St+Lb+Lc、St+Lb+Lp,其大分子蛋白种类都没有变化,但同时也可以看到与普通乳酸菌发酵酸乳的条带相比,添加益生菌的发酵酸乳中的αs2酪蛋白、αs1酪蛋白和β-乳球蛋白条带比较浅,其中St+Lb+Lp发酵酸乳所形成的条带最浅。其蛋白质含量的降低主要是由于发酵剂中蛋白酶将蛋白质逐步降解成多肽、小肽及氨基酸导致,且由于两株益生菌在酸乳发酵过程中代谢活性不同而导致对蛋白质的降解程度有所不同。
2.2 氨基氮含量的变化
12%TCA中的主要成分是中肽、小肽(具有2~20个氨基酸残基)以及少量的氨基酸[11]。它主要是由发酵剂含有的凝乳酶和肽酶共同作用而产生的。在酸乳发酵后期,乳酸菌释放出的蛋白酶进一步降解蛋白质生产小肽和氨基酸,其中氨基酸对酸乳风味的形成起着很重要的作用[12]。
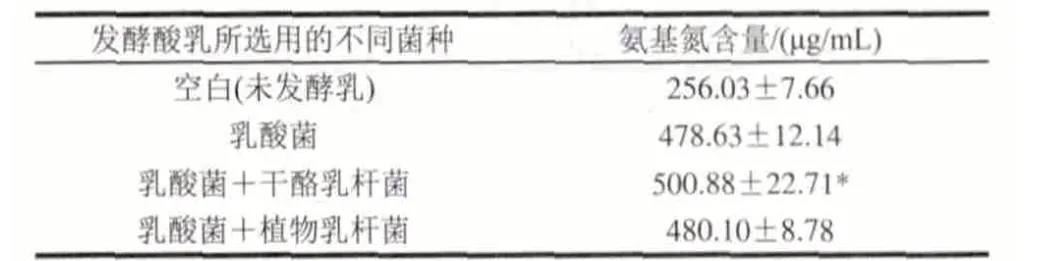
表 5 不同菌种发酵酸乳的氨基氮含量Table 5 Contents of amino nitrogen in yogurt samples fermented by different strains
由表5可知,添加益生菌的发酵酸乳与普通乳酸菌发酵酸乳相比,氨基氮含量有了一定程度的升高,其中添加干酪乳杆菌的酸乳其氨基氮含量有显著增加(P<0.05),达到500.88μg/mL,比乳酸菌酸乳高出4.65%;添加植物乳杆菌的酸乳其氨基氮含量比乳酸菌酸乳高出0.31%。这主要是由于益生菌含有的蛋白酶对多肽产生作用,使其进一步降解为小肽和氨基酸所造成的[13]。
2.3 pH4.6可溶性氮的变化
pH4.6可溶性氮是指多肽类,陈历俊等[7]研究发现,当pH4.6时酪蛋白沉淀,乳清蛋白和蛋白胨对可溶性氮的贡献很小,因此认为pH4.6可溶性氮主要是由于乳酶的作用产生的。但随着发酵、成熟时间的延长,它们便主要由发酵剂中蛋白酶降解蛋白质所产生[14]。
RP-HPLC主要用于分子质量低于5000u,尤其是1000u以下的非极性小分子多肽的分离和纯化[15-16],因其具有分离效果好、分辨率高、重复性好、分析速度快等优点,在多肽的分离纯化和制备中得到广泛应用[17]。目前国外就有报道称发酵乳品中存在由乳酸菌的发酵作用而产生的多肽类物质[18]。
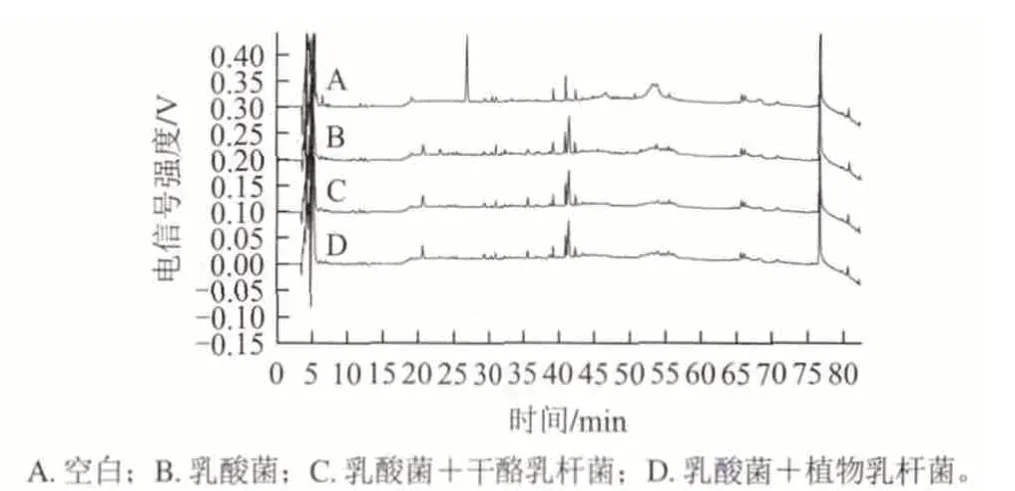
图 2 pH4.6-SN高效液相色谱分析图Fig.2 HPLC analysis of pH4.6-SN in yogurt samples fermented by different strains
由图2可以看出,与乳酸菌发酵酸乳相比,无论是添加干酪乳杆菌还是植物乳杆菌发酵的酸乳,多肽的种类并没有增加,只是部分多肽含量发生了一些变化。当出峰时间为26.943min时,可以明显看到空白样品中有一个比较大的峰,而添加菌种之后的发酵酸乳,此峰不明显甚至消失,说明发酵菌种对酸乳中的此段多肽进行了降解。当出峰时间在20~32min时,可以明显看到添加益生菌的酸乳中多肽含量明显比乳酸菌发酵酸乳的少很多,这可能是由于益生菌将多肽降解为更小的肽段所造成的。总之,添加益生菌的酸乳色谱图与乳酸菌发酵酸乳的色谱图趋势基本一致,说明在酸乳发酵过程中,乳酸菌仍然起主要作用,益生菌只是改变了部分多肽的含量。
2.4 游离氨基酸含量的变化
采用17种游离氨基酸标准样品的峰面积与浓度作标准曲线如表6所示。在酸乳发酵过程中,发酵剂中含有的蛋白酶能降解酸乳中的蛋白质,形成胨、肽、氨基酸等,所产生的一些小肽和氨基酸是酸乳主要风味物质的前体,而氨基酸代谢产生的挥发性物质有助于酸乳形成最终优良的感官品质[19]。Beshkova等[20]对酸奶发酵过程的研究表明,牛奶凝结(发酵4.50h)后,牛奶总氨基酸的70%将以游离氨基酸的形式释放到酸奶中,这是影响酸奶制品风味和质地的重要组成成分。另外研究表明,在混合菌株发酵中,菌株间的共生作用也必须有适量的氨基酸以促进菌株的生长。乳杆菌可产生大量的游离氨基酸,作为氮源,促进乳球菌的生长,其余的则游离于酸乳中[21]。其中Shankar等[22]报道了嗜热链球菌生长需要的氨基酸主要是谷氨酸、组氨酸和甲硫氨酸。

表 6 17种游离氨基酸标准品的标准曲线方程及相关系数Table 6 Standard curve equations and correlation coefficients of 17 free amino acid standards
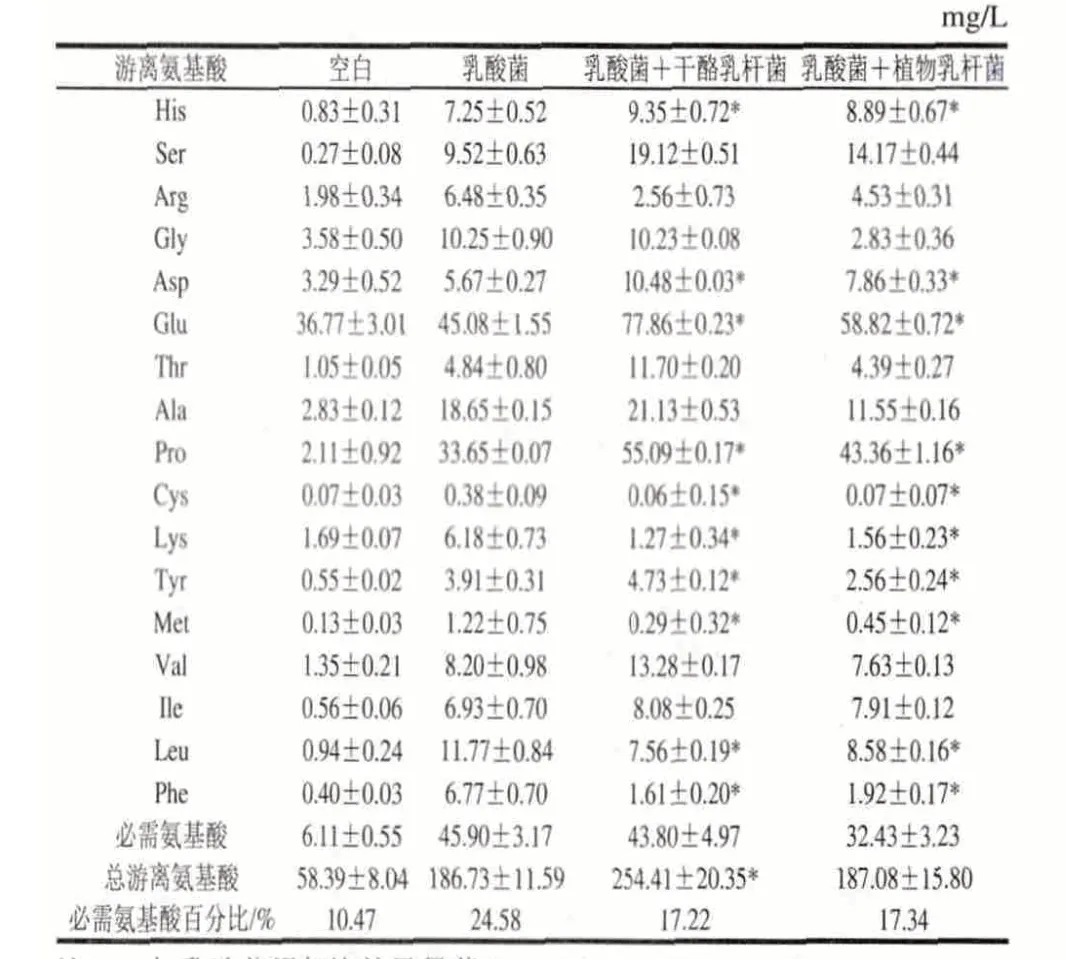
表 7 不同菌种发酵酸乳中的游离氨基酸含量Table 7 Contents of free amino acid in fermented yogurt from different strains
由表7可知,在实验酸奶样品中, 游离氨基酸的总量在58.39~254.41mg/L之间,人体必需氨基酸的含量占游离氨基酸总量的10.47%~24.58%。4种酸乳样品中谷氨酸含量明显高于其他游离氨基酸。与普通酸乳相比,添加益生菌的发酵酸乳其总游离氨基酸含量均有所增加,其中添加干酪乳杆菌的发酵酸乳增加较显著(P<0.05)。游离氨基酸的增加主要是由于发酵剂形成的肽酶作用的结果,肽酶积累导致游离氨基酸数量的增加[23]。
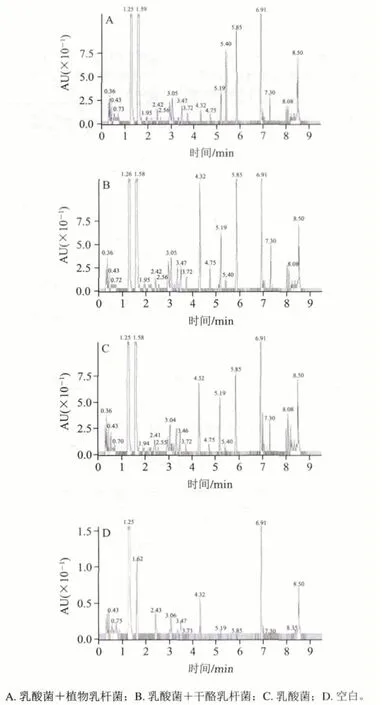
图 3 不同菌种发酵酸乳中的游离氨基酸含量色谱图Fig. 3 Chromatograms of free amino acids in fermented yogurt from different strains
由表7、图3可知,与乳酸菌发酵酸乳相比,添加益生菌的发酵酸乳中,大部分氨基酸含量呈上升趋势,但变化的显著性不同。Ser、Asp、Glu、Pro、Cys、Lys、Tyr、Met、Leu及Phe含量有显著差异(P<0.05)。这可能要归因于益生菌与乳酸菌之间的相互作用,球菌在生长过程中产生的甲酸和二氧化碳对杆菌的生长有促进作用,杆菌在生长过程中产生的一些肽和自由氨基酸是球菌和自身的促生长因子[24-25]。
3 结 论
马嵬等[26]采用SDS-PAGE电泳法和反相高效液相色谱法测定了5种原味发酵型酸奶中乳清蛋白的组成和游离氨基酸含量,为全面了解酸乳的组成特性提供了依据。本实验以响应面优化后的最优生产工艺条件为基础制备益生菌发酵酸乳,并将其与传统乳酸菌发酵酸乳相比,发现益生菌发酵酸乳中αs2-酪蛋白、αs1-酪蛋白和β-乳球蛋白条带比较浅,其中添加植物乳杆菌的发酵酸乳所形成的条带最浅;而pH4.6可溶性氮、氨基氮和游离氨基酸的含量均有所增加,其中添加干酪乳杆菌的发酵酸乳增加显著。与乳酸菌发酵酸乳相比,其多肽的种类并没有增加,只是部分多肽含量发生了一些变化;且益生菌发酵酸乳中大部分氨基酸含量呈上升趋势,但变化的显著性不同。产生这些变化的原因是由于益生菌本身所含有的酶类降解蛋白造成的,且由于益生菌与乳酸菌之间的相互作用造成不同益生菌在酸乳发酵过程中代谢活性的不同,而导致对蛋白的降解程度不同。
[1] DAVIDON R H, DUMCAN S E, HACKNEY C R. Probiotic culture survival and implications in fermented frozen yogurt[J]. Journal of Dairy Science, 2000, 83(4): 666-673.
[2] SHAH N P. Probiotic bactacria: selective enumeration and survival in dairy foods[J]. Journal of Dairy Science, 2000, 83(4): 894-907.
[3] REID G. The scientific basis for probiotic strains of Lactobacterium[J].Journal of Applied and Environmental Microbiology, 1999, 65(9):3763-3766.
[4] 郭本恒. 益生菌[M]. 北京: 化学工业出版社, 2004: 382-383.
[5] DIOP L, GUILLOU S, DURAND H. Probiotic food supplement reduces stress-induced gastrointestinal symptoms in volunteers a double-blind, placebo-controlled, randomized trial[J]. Nutrition Research, 2008, 28: 1-5.
[6] 顾瑞霞. 乳与乳制品的生理功能特性[M]. 北京: 中国轻工业出版社,2000: 329-339.
[7] 陈历俊, 乔为仓. 发酵乳加工与质量控制[M]. 北京: 中国轻工业出版社, 2010: 68-79.
[8] UYENO Y, SEKIGUCHI Y, KAMAGATA Y. Impact of consumption of probiotic lactobacilli-containing yogurt on microbial composition in human feces[J]. International Journal of Food Microbiology, 2008,122: 16-22.
[9] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2002.
[10] CHURCHI F C, SWAISGOOD H E, PORTER D H, et al.Spectrophotometric assay using o-pthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66: 1219-1227.
[11] SOUSA M J, ARD Y, MCSWEENEY P L H. Proteolysis in goat cheese made from raw, pasteurized or pressure treated milk[J].Innovative Food Science and Emerging Technologies, 2002, 3:309-319.
[12] AGBOOLA S O. Influence of Australian native herbs on the maturation of vacuum-packed cheese[J]. Dairy Science, 2002, 35:575-583.
[13] 吴非, 刘晓玲. 混合型大豆干酪成熟中蛋白质降解特性的研究[J].食品研究与开发, 2007, 28(7): 1-4.
[14] 任娟, 张富新, 昝林森. 不同发酵剂对羊奶干酪成熟期间蛋白质降解和感官品质的影响[J]. 食品与发酵工业, 2009, 35(12): 144-147.
[15] DAN N, GANESAN R, FLOOD K G, et al. Determination of enantiomers in a synthetic argininal peptide using capillary zone electrophoresis and high-performance liquid chromatography[J].Journal of Chromatography A, 2000, 891(1): 115.
[16] SANZ-NEBOT V, BENAVENTE F, TORO I, et al. Optimization of HPLC conditions for the separation of complex crude mixtures produced in the synthesis of therapeutic peptide hormones[J].Chromatographia, 2001, 53 (Suppl 1): S167.
[17] 张艳华, 李影, 巨芳, 等. 高效液相色谱分离纯化多肽的研究进展[J]. 中国食物与营养, 2009(9): 34-36.
[18] SMACCHI E, GOBBETTI M. Bioactive peptides in dairy products:synthesis and interaction with proteolytic enzymes[J]. Food Microbiology, 2000, 17: 129-141.
[19] WILLIAMS A G, BEATTIE S H, BANKS J M. Enzymes involved in flavor formation by bacteria isolated from the smear population of surface ripened cheese[J]. International Journal of Dairy Technology,2004, 57: 7-13.
[20] BESHKOVA D M, SIMOVA E D, FRENGOVA G I, et al. Production of amino acids by yogurt bacteria[J]. Biotechnology Progress, 1998,14(6): 963- 965.
[21] 黄文利, 陈卫, 陆英, 等. 益生菌干酪乳杆菌LC-15生长及发酵特性研究[J]. 乳业科学与技术, 2007(6): 282-286.
[22] SHANKAR P A, DAVIES F L. Amino acid and peptide utilization by Streptococcus thermophilus in relation to yoghurt manufacture[J].Journal of Applied B acteriology, 1977, 43: vIII.
[23] ASTON J W, DURWARD I G, DULLEY J R. Proteolysis and flavor development in cheddar cheese[J]. Australian Journal of Dairy Technology, 1983, 38: 55-59.
[24] DRIESSEN F M, KINGMA F, STADHOUDERS J. Evidence that Lactobacillus bulgaricus in yogurt is stimulated by carbon dioxide produced by Streptococcus thermopbilus[J]. Netherlands Milk and Dairy Journal, 1982, 36: 135-139.
[25] HEMME D H, SCHMAL V, AUCLAIR J E. Effect of the addition of extracts of Thermophilic lactobacilli on acid production by Streptococeus thermophilus in milk[J]. Journal of Dairy Research,1981, 48: 139-148.
[26] 马嵬, 金素钰, 郑玉才. 酸奶中游离氨基酸含量及乳清蛋白组成分析[J]. 中国乳品工业, 2006, 34(6): 20-23.
