青养蛋白抗氧化肽的制备及其胃肠道消化性的研究
2013-08-07赵谋明陈小枫任娇艳
顾 敏,赵谋明,王 茜,陈小枫,任娇艳
(华南理工大学轻工与食品学院,广东广州510641)
青养是青蛙的一种,为沼水蛙属(Hylarana)。青养蛋白营养与林蛙相似,含有丰富的氨基酸,尤其是人体必需氨基酸种类齐全,含量高,属低脂肪、低胆固醇的肉类[1]。我国共有青蛙180 余种[2],人们较为熟悉的是林蛙、虎纹蛙等,而青养却很少为人们所知。目前国内外对青蛙的研究,主要集中在皮肤活性肽的提取,鉴定,基因克隆表达等[3],约有20%集中在青蛙大脑活性物质等的研究[4],而对青蛙肉的研究比较少,且多集中在产品方面。而在青蛙类产品中,林蛙油的研究比较多,但是对林蛙肉的研究却不多,主要集中在营养成分的分析[5],及酶解工艺优化等[6],研究的不够深入,此外,未曾查阅到与青养蛋白相关的研究。通过酶法加工青养肉蛋白可以获得具有特殊生理机能的短肽。近年来的研究表明,食物蛋白质酶解产物中的一些短肽除营养功能外,还具有广泛的生理调节功能,如抗疲劳、降血压、降胆固醇、免疫调节、增加骨密度等[7]。食物蛋白质酶解制备活性短肽研究已成为食品科学界和医药学界的关注点。本实验采用碱性蛋白酶、木瓜蛋白酶、胰酶、风味酶四种酶水解青养蛋白,探讨各种酶对酶解产物蛋白质利用率和水解度的影响,并研究各种酶水解产物的理化特性,包括氨基酸组成、分子量分布、DPPH·清除能力、ORAC 差异,筛选出制备青养抗氧化肽的最佳用酶,且在此基础上研究了抗氧化肽的胃肠道消化特性。
1 材料与方法
1.1 材料与仪器
鲜活青养(平均重56 ±3.1g,长12 ±5cm) 购于广州黄沙水产批发市场,脂肪含量为1.13% ±0.04%,蛋白含量为16.91% ±0.44%,去皮去头去内脏洗净后绞成肉糜,置于-20℃冰箱中冷冻,备用;木瓜蛋白酶(6 ×105U/g)、碱性蛋白酶(2000U/mL)、胰酶(1500U/mg)和风味酶(2 × 105U/g) 购于Novozymes(诺维信)公司;凝胶层析标准样品:细胞色素C(12384u),Approprinin(6512.42u、维生素B12(1355u)、谷胱甘肽(612.64u)和 Gly - Gly - Gly(189.17u) 均购于美国Sigma 公司。DPPH 自由基(1,1-Diphenyl-2-Picrylhydrazyl)、荧光素(FL)、抗氧化标准物Trolox、2,2'-偶氮二(2-脒基丙烷)二盐酸盐(AAPH) 均购于Sigma 公司;其他试剂为国产分析化学纯。
MM12 型绞肉机 广东省韶关市食品机械厂;UV-754 分光光度计上海精密科学仪器有限公司;KDN-2C 型定氮仪 上海纤检仪器有限公司;KDN-40 消化炉 上海新嘉电子有限公司;GL-21 M高速冷冻离心机 长沙湘仪离心机仪器有限公司;酶标仪 光谱扫描多功能读数仪 Thermo scientific(芬兰);电子天平 Mettler Toledo 仪器(上海)有限公司;超纯水系统 广州洁圣膜技术有限公司;XW-80A 涡旋混合仪 上海精科实业有限公司;PHS-3C精密pH 计 上海雷磁精密仪器厂;A300 全自动氨基酸分析仪 德国membraPure 公司;Amersham 蛋白质分析纯化系统 美国GE Healthcare 公司。
1.2 酶解工艺流程[8]
青蛙肉糜样品:离子水(1∶1)→加酶(酶量0.15%,酶解4h)→灭酶(95℃,10min)→快速冷却至室温,低温离心(6000r/min,20min)→取上清液→冷冻干燥[8]。
木瓜蛋白酶、碱性蛋白酶和风味酶的酶解温度是55℃,胰酶的酶解温度是37℃;木瓜蛋白酶和风味酶的酶解pH 为自然pH,碱性蛋白酶和胰酶的酶解pH 为8.0。
1.3 模拟胃肠消化道酶系对青养多肽抗氧化活性的影响
体外模拟胃肠消化道酶系的反应参考Cinq-Mars 等人[9]的方法并有所改进,整个模拟过程分两步反应进行:
第一步,模拟胃消化道酶系的消化过程。青养多肽粉复溶于去离子水中配成3%(w/w)的溶液,用1mol/L盐酸调节体系的pH 至2.0。加入胃蛋白酶(加量为青养蛋白含量的4%),适度搅拌,然后在摇床中37℃恒温孵育2h。在此过程中,在0、0.5、1.0、1.5、2.0h分别取样,置于沸水浴中灭酶10min,迅速冷却,离心(6000r/min,15min),冷冻干燥,以测定多肽经胃蛋白酶消化后其抗氧化活性的变化。
第二步,模拟肠消化道酶系的消化过程。青养多肽经过胃消化道酶系消化2h 后,用1.0mol/L 氢氧化钠调pH 至7.5。然后加入胰酶(加量为青养蛋白含量的4%),适度搅拌,然后在摇床中37℃恒温孵育2h。在此过程中,分别在2.5、3.0、3.5、4.0h 处取样,置于沸水浴中灭酶10min,快速冷却,离心(6000r/min,15min),冷冻干燥,以测定多肽经肠消化道后其抗氧化活性的变化。
1.4 实验测定方法
1.4.1 蛋白质利用率的测定 用凯氏定氮法[10]分别测定肉糜原料和酶解液中蛋白氮含量,并按下式计算:

1.4.2 水解度的测定[11]水解度的测定方法采用甲醛滴定法,并按下式计算:
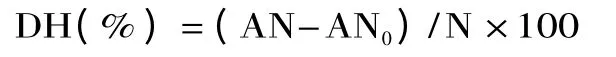
式中,AN 为青养酶解液中游离氨基氮的含量,g/100g;AN0为青养肉糜液酶解前游离氨基氮的含量,g/100g;N 为青养原料中总蛋白氮的含量,g/100g。
1.4.3 肽分子量分布情况 标准肽样品:Globin III(分子量为2512)、GlobinⅡ(分子量为6214)、Globin I(分子量为8519)、Globin I +III(分子量为10700)、Globin I + Ⅱ(分子量14404)、Globin(分子量为16949),美国Amersham 公司。分离柱为Superdexpeptide 30/100GL,预装柱(Vt= 24.0mL,Vo=8.0mL),进样体积为100μL,检测波长设为214nm,最大压力设为1.8MPa。洗脱液为0.25mol/LNaCl,pH7.2 磷酸缓冲液,洗脱流速为0.5mL/min,分子量与保留体积的关系为y =-0.0578x +4.6289,R2=0.99,y 为标准肽分子量的对数,x 为洗脱体积,mL。
1.4.4 氨基酸分析 用A300 全自动氨基酸分析仪进行青养酶解物的氨基酸组成分析。样品用6mol/L的盐酸在110℃条件下消化24h,定容到50mL,取2mL 溶液挥干,接着用稀释液溶解,溶液经0.22μm滤膜过滤后,氨基酸的含量用g/100g 表示。
1.4.5 水解产物清除DPPH·的测定 将2mL DPPH·溶液(0.2mmol/L,溶于95%乙醇)置于试管中,加入2mL 酶解液,振荡混匀,室温暗室反应30min 后,若出现沉淀,6000r/min 离心15min,取上清液在517nm处测其吸光值(Ai),空白为2mL 95%乙醇加入2mL蒸馏水调零,对照为2mL DPPH·溶液加上2mL 蒸馏水在测定波长下的吸光值(Ac),酶解液在测定波长的吸光值为A[12]j。酶解液对DPPH·的清除能力用抑制率R 表示:R(%)=[1-(Ai-Aj)/Ac]×100。
1.4.6 氧自由基吸收能力(ORAC)实验 ORAC 测定方法,参照Blanca Hernndez-Ledesma[13]等人的方法,并作适当修改。在96 孔荧光板各微孔中加入待测样品20μL(将Trolox 用相应的缓冲液适当稀释),接着加入75mmol/L 磷酸盐缓冲液和70nmol/L FL各20μL,并将微孔板置于酶标仪中,在37℃下孵化15min 后,用多道移液器迅速在各孔中加入12mmol/L AAPH 140μL 启动反应,在37℃以激发波长485nm,发射波长520nm,每2min 测定一次各微孔的荧光强度,测定时间设在荧光衰减呈基线后为止,即设2h。
1.5 统计分析
除定量描述分析外,所有实验均重复3 次,实验结果表述为平均值±标准偏差,方差分析采用SPSS软件(11.5 版本,SPSS 公司,美国)中的One-Way ANOVA 进行分析,p <0.05 为统计学上有显著性差异。采用Origin8.0 作图分析。
2 结果与分析
2.1 酶对蛋白质利用率、水解度和抗氧化活性的影响
分别采用木瓜蛋白酶、风味酶、碱性蛋白酶和胰酶水解青养蛋白,四种酶的酶解条件相同,测定各水解产物的蛋白质回收率、水解度和抗氧化活性,结果见图1~图4。由图1 可知,四种酶中木瓜蛋白酶酶解的水解度最高,风味酶次之,胰酶最低,只有7.14%;图2 可知,四种酶中木瓜蛋白酶水解的蛋白质回收率最高,达到61.20%,碱性蛋白酶次之,胰酶最低;由图3 可知,捕获DPPH·的能力,胰酶水解物的能力最强,风味酶次之,其IC50值为6.93mg/mL;由图4 可见,木瓜蛋白酶酶解物的ORAC 值最高,达到801.69μmoL TE/mg,风味酶次之,由于期望蛋白质利用率和抗氧化活性都能达到较好的状态,所以使用风味酶和木瓜蛋白酶复配酶解,按1∶1 的比例添加,酶的使用量分别为0.1%,酶解温度为55℃,酶解结果如图1~图4 中所示,青养蛋白的水解度提高到了18.93% ±0.12%,蛋白回收率相对风味酶也有了较大的提高,DPPH·清除能力相对木瓜蛋白酶水解物提高了,ORAC 值相对风味酶液提高了。
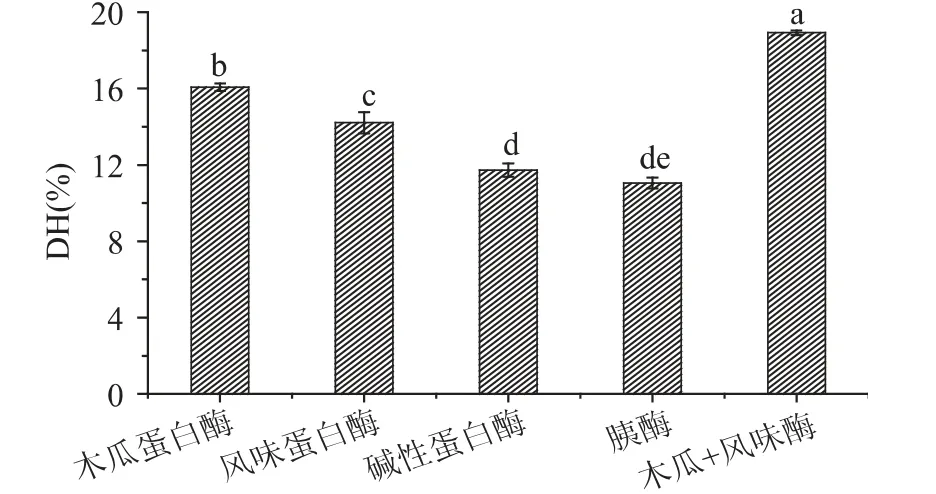
图1 不同酶酶解青养蛋白水解度的比较Fig.1 Comparison of hydrolysis degree of different enzymes

图2 不同酶酶解青养蛋白回收率的比较Fig.2 Comparison of protein recovery of different enzymes
2.2 最佳抗氧化水解物的氨基酸组成及营养评价
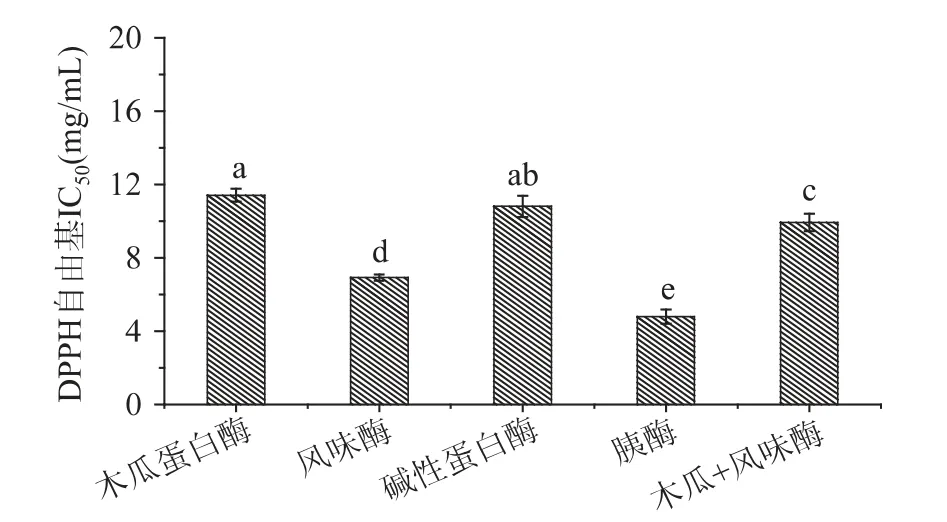
图3 不同酶的水解物捕获DPPH·的能力比较Fig.3 Comparison of scavenging activity on DPPH·of different hydrolysates

图4 不同酶的水解物的ORAC 值比较Fig.4 Comparison of ORAC value of different hydrolysates
青养蛋白抗氧化肽中必需氨基酸与总氨基酸的比值(EAA/TAA)为45.06%,但是由于氨基酸的测定方式采用的是酸水解的模式,色氨酸被酸破坏无法测定,导致必需氨基酸的含量偏低,因此EAA/TAA 的比值应高于45.06%;必需氨基酸与非必需氨基酸的比值(EAA/NEAA)为82.01%,同理,真实的比值应高于82.01%,均超过了FAO/WHO 制定的蛋白质评价氨基酸标准模式,EAA/TAA 为40%,EAA/NEAA 为60%,说明青蛙蛋白抗氧化肽是人体补充必需氨基酸的优质多肽食品。同时,富含具有抗氧化活性的氨基酸,如,Met、Tyr、Phe、His、Lys、Arg、Pro 等[14]。

表1 青养蛋白木瓜蛋白酶和风味酶复配酶解产物氨基酸分析Table 1 Amino acid composition of frog protein hydrolysate using papain and Flavorzyme
2.4 酶解产物的分子量分布
木瓜蛋白酶和风味酶复配酶解青养蛋白产物的分子量分布如图5 所示。图5 表明,多肽组分分子量分布主要集中在3ku 以下,高达73%,分子量高于10ku 的含量为3%,可以看出酶解效果较好,小分子肽为主要成分。据Aleman 等人研究发现,小分子量的肽段具有更好的抗氧化活性[15-16],可能是因为小分子肽更易于与自由基结合,从而中断自由基链式反应,在捕获DPPH·方面,分子大小的影响更为显著,主要是因为自由基分子含有三个苯环,活性中心位于三个苯环间隙中,若抗氧化物质体积大,则无法靠近自由基的活性中心,从而无法阻断自由基反应。因此可以看出青养水解物有作为抗氧化食物的潜力。
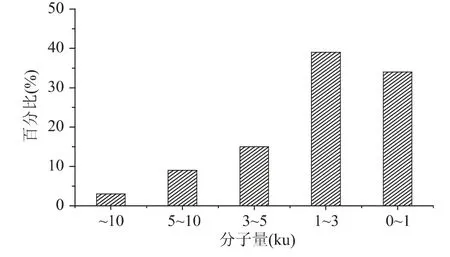
图5 青养蛋白酶解产物的分子量分布Fig.5 Peptide molecular weight distribution of frog protein hydrolysate
2.5 模拟胃肠消化道酶系对青养多肽抗氧化活性的影响
2.5.1 模拟胃肠消化过程中青养多肽清除DPPH·能力的变化 如图6所示,消化0h 时青养多肽对DPPH·自由基的清除率为17.20% ±4.8%。经过胃蛋白酶消化0.5h 后,其清除率提高到51.09% ±2.01%(提高了3 倍),进一步用胃蛋白酶进行消化,清除DPPH·自由基的能力仍在进一步的提升,但1.5h 后,清除率有所下降。在第2.0h 开始模拟肠道消化过程,青养多肽经胰酶消化0.5h 后,清除DPPH·自由基显著下降到19.13% ±0.25%(p <0.05);消化2.0h 后,青养多肽的清除DPPH·自由基能力为16.70% ±1.53%。由酶空白样可以看出,酸碱处理的过程中,清除DPPH·自由基的能力变化不大,可能是因为酸的强度不够,影响较小。因此,推断消化样品抗氧化能力的变化主要是由消化酶所引起的。因为在胃蛋白酶消化过程中,大分子肽链降解为小分子,更多的疏水性氨基酸残基暴露在外[17],使得多肽更容易接近并捕获疏水性的DPPH·自由基。而胰酶消化过程中抗氧化能力的降低可能是因为在胰酶与多肽进一步作用,使得青养多肽进一步被降解,生成更短的小肽和游离氨基酸,产物具有较强的亲水性。青养多肽模拟消化产物极性的增加使得它捕获脂溶性的DPPH·自由基变难[17]。因此,青养多肽的DPPH·自由基清除能力在胰酶消化阶段显著降低。
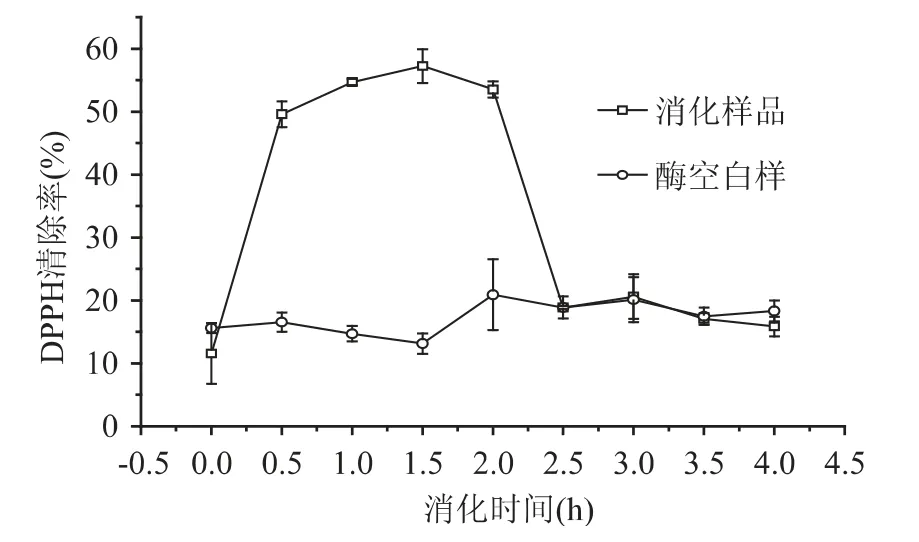
图6 模拟胃肠消化中青养多肽清除DPPH·自由基能力的变化(6mg/mL)Fig.6 Changes in DPPH·radical scavenging activity of frog peptides during sequential in vitro digestion(6 mg/mL)
2.5.2 模拟胃肠消化过程中青养多肽ORAC 值的变化 如图7 所示,消化0h 时,青养多肽的ORAC 值为(511.86 ± 16.30)μmoLTE/mg,经胃蛋白酶消化0.5h 后,其捕获氧自由基能力(ORAC)提高到(618.22 ± 17.52)μmoLTE/mg(提高了21%)(p <0.05),胃蛋白酶继续消化时ORAC 值开始显著下降。1.5~4.0h 之间的消化,ORAC 值无显著变化,基本维持在510μmoLTE/mg 左右(p >0.05)。酶空白样的ORAC 值也维持在450 ~500μmoLTE/mg 之间,只在酸处理0.5~1.0h 之间,ORAC 值有一个显著降低的过程(p <0.05),此后的ORAC 值无显著性差异(p >0.05),可能是因为酸碱的处理时间较短,且强度较小,所以对多肽的影响较小。因此推断,消化样品的ORAC 值在0~0.5h 之间的显著变化,主要是由于胃蛋白酶对青养多肽的降解作用,使得更多的疏水性氨基酸残基暴露在外[17],产物更易于捕获氧自由基。而消化0.5~1.5h 时,ORAC 值显著下降(p <0.05),可能是因为原本青养多肽的分子量不大,再进一步降解,产生的小肽捕获氧自由基的能力不强。这与水解度与抗氧化活性非正相关的观点相符合。

图7 模拟胃肠消化中青养多肽ORAC 值的变化Fig.7 Changes in ORAC value of frog peptides during sequential in vitro digestion
3 结论与讨论
3.1 木瓜蛋白酶和风味酶复配酶解,可以得到较优的酶解产物。相对于单酶,一般复配酶解会提高水解度,因为不同的酶酶切位点有差异。
3.2 复配酶酶解产物的氨基酸分析发现,青养蛋白酶解物具有较高的营养价值,且抗氧化性氨基酸的含量也较高,因此青养蛋白水解物是一个营养丰富且抗氧化活性较好的食物。
3.3 复配酶解所得产物经分子量分析发现,小分子占多数,由于小分子量的肽段具有较好的抗氧化潜能,且易于被人体直接吸收,表明产物可以作为较好的抗氧化剂。
3.4 模拟胃肠道消化过程中,青养多肽的抗氧化活性在0~2.0h 之间活性变化较大,尤其是在0.5~1.0h之间得到的产物,抗氧化活性提高的较多,这可能是胃蛋白酶作用于大分子多肽,适度降解提高了活性;2.5~4.0h 为胰酶消化得到的抗氧化肽的抗氧化活性均低于胃蛋白酶消化产物,且产物之间的活性无显著性差异,表明胰酶对多肽的降解作用不强。对于消化过程中的机理,有待在分子水平上进一步研究。
[1]李妍妍,郑卫星,王日昕.林蛙营养成分的多元分析[J].食品科学,2007,28(12):472-475.
[2]费梁,胡淑慧,叶昌媛,等.中国动物志两栖纲[M].北京:科学出版社发行部,2009.
[3]Conlon J M,Kolodziejek J,Nowotny N. Antimicrobial peptides from the skins of North American frogs[J].Biochimicaet Biophysica Acta,2009,1788:1556-1563.
[4]Chen Wenlin,Yang Xuening,Chen Lingling,et al. Gene cloning and characterization of novel antinociceptive peptide from the brain of the frog,Odorrana grahami[J].Biochimie,2011,93:1110-1114.
[5]赵桂华,梁悦,王宇.中国林蛙肉的营养成分分析与评价[J].营养学报,2007,29(6):623-624.
[6]孔繁东,杜娟,祖国仁.微生物酶水解林蛙肉蛋白质及产物抗氧化活性初探[J].中国酿造,2009,1:76-79.
[7]赵桂华.中国林蛙肉的生物酶解、营养分析及功能评级的分析[D].大连:辽宁师范大学2008.
[8]任娇艳,赵谋明,崔春.基于响应面分析法的草鱼蛋白酶解工艺[J].华南理工大学学报:自然科学版,2006,34(3),95-100.
[9]Cinq-Mars CD,Hu C,Kitts DD,et al.Investigations into Inhibitor type and mode,simulated gastrointestinal digestion,and cell transport of the angiotensin I-converting enzyme-inhibitory peptides in pacific hake(Merluccius productus)fillet hydrolysate[J]. Journal of Agriculture and Food Chemistry,2008,56,410-419.
[10]大连轻工业学院,华南理工大学.食品分析[M].北京:轻工业出版社,1994:223.
[11]Mahmoud M L,Malone W I,Cordle C T. Enzymatic hydrolysis o f casein.Effect of degree of hydrolysis on antigenicity and physical properties[J].Journal of Food Science,1992,57(5):1223-1229.
[12]李琳,赵谋明,张黎.利用人工神经网络优化制备鳙鱼抗氧化肽[J].四川大学学报:工程科学版,2006,38(1):80-85.
[13]Hernndez - Ledesma B,Amigo L,Recio I,et al.ACE-Inhibitory and Radical - Scavening Activity of Peptides Derived fromβ- Lactoglobulin. Internations with Ascorbic Acid[J]. Journal of Agriculture and Food Chemistry,2007,55:3392-3397.
[14]Prippa A H,Isakssonb T,Stepaniak L,et al. Quantitative structure activity relationship modelling of peptides and proteins as a tool in food science[J]. Trends in Food Science and Technology,2005,16:484-494.
[15]Alemán A,Giménez B,Pérez-Santín E,et al.Contribution of Leu and Hyp residues to antioxidant and ACE - inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chemistry,2011,125:334-341.
[16]Nalinanon S,Benjakul S,Kishimura H,et al.Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadfin bream treated with pepsin from skipjack tuna[J].Food Chemistry,2011,124:1354-1362.
[17]Zhu LJ,Chen J,Tang XY,et al. Reducing,radical scavenging,and chelation properties of in vitro digests of Alcalase-treated zein hydrolysate[J].Journal of Agriculture and Food Chemistry,2008,56:2714-2721.
