基于不同靶基因的荧光定量PCR 快速检测蜡样芽孢杆菌的研究
2013-08-07张志鸿谭强来王力均刘成伟游兴勇许恒毅
张志鸿,甘 蓓,谭强来,王力均,刘成伟,游兴勇,许恒毅,* ,魏 华
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学中德联合研究院,江西南昌330047;3.江西省产品质量监督检测院,江西南昌330029;4.江西省疾病预防控制中心,江西南昌330000)
蜡样芽孢杆菌(Bacillus cereus)是一种能产芽孢的革兰氏阳性菌,广泛分布于空气、污水和各类生熟食品中[1]。目前,从多种食品中分离出该菌,包括炒米饭、肉类、乳类和鱼等,是常见的食源性致病菌,极有可能危害人们的健康。自1950 年在挪威首次报道蜡样芽孢杆菌可能引起人类食物中毒后,中毒事件在欧洲和北美频繁发生[2];在我国,蜡样芽孢杆菌引起的中毒事件同样严重,在1993~2003 十年间,蜡样芽孢杆菌中毒者高达1758 人[3]。蜡样芽孢杆菌引起的食物中毒类型主要分为腹泻和呕吐症状,其中腹泻主要与某些菌株分泌肠毒素相关,而呕吐主要是因某些菌株产生呕吐毒素引起[4]。目前,针对蜡样芽孢杆菌肠毒素引起的食源性疾病研究较多,检测方法比较成熟并已经商业化,而关于蜡样芽孢杆菌呕吐毒素的研究相对较少[5]。然而,呕吐型蜡样芽孢杆菌引发的食物中毒,尤其是米饭类的中毒事件时有发生。在美国,食用炒米饭发生中毒的主要原因是其中污染了产呕吐毒素的蜡样芽孢杆菌[6]。2006年,在德国,17 个小孩因误食被蜡样芽孢杆菌污染的米饭出现集体呕吐症状[7];2008 年,美国母子三人因食用了室温放置1d 后再加热的米饭而出现呕吐症状,并导致其中一个1 岁的男孩死亡,最后证实为产呕吐毒素的蜡样芽孢杆菌污染所导致的食物中毒[8]。因此,建立一种快速、灵敏的方法检测食品中产呕吐毒素蜡样芽孢杆菌至关重要。当前蜡样芽孢杆菌的常规检测方法主要是传统分离培养法,整个过程耗时耗力,而且容易造成大量错误识别以及低估食源性疾病爆发的程度[9]。荧光定量PCR 于1995 年由美国PE 公司推出,因该技术实现了PCR 从定性到定量的飞跃,且与常规PCR 技术相比,具有特异性更强、灵敏度更高、重复性好和能定量检测等优点而被迅速应用到致病菌的快速检测领域[10]。本研究同时针对编码蜡样芽孢杆菌呕吐毒素合成酶的基因cesB[4]和旋转酶B 亚基的基因gyrB[11]设计特异性引物,结合荧光定量PCR 快速准确的优点,首次建立了一种基于不同靶基因的快速定量检测污染食品中产和不产呕吐毒素蜡样芽孢杆菌的方法。
1 材料与方法
1.1 实验材料
产呕吐毒素蜡样芽孢杆菌(emetic Bacillus cereus,JDZ102Y 与P20063L)、不产呕吐毒素蜡样芽孢杆菌(non - emetic B. cereus,DA0016L、DA96L、FX0076LY、FX0088Y、JA0056、JA0125LY、JJ0374LY、JJ0398、JX0060Y、JX0067Y、NC0001L、NC0084LY、P20078L、PX0026L1、SRX00 和YS0024L) 江西省疾病预防控制中心;粘质沙雷氏菌(CMCC41002)、副溶血性 弧 菌 (PVPA0155 )、普 通 变 形 杆 菌(CMCC49101)、藤黄微球菌(CMCC28001)、大肠杆菌 O157 ∶H7 (NCTC12900)、铜绿假单胞杆菌(CMCC10104)、沙门氏菌(ATCC13076)、金黄色葡萄球菌(CMCC26001) 本实验室保存;0.01mol/L PBS、2 ×TaqMix、ROX Reference Dye、SYBR Primer Ex Taq等 日本TaKaRa 公司;其它试剂均为国产分析纯。
ABI 7900HT 实时荧光定量PCR 仪 Applied Biosystems,USA;凝胶成像系统Bio-Rad USA;普通PCR 仪 Eppendorf,Germany;高速离心机 Eppendorf,Germany。
1.2 实验方法
1.2.1 菌悬液的制备 挑取产呕吐毒素蜡样芽孢杆菌JDZ102Y 的单菌落接种于5mL LB 液体培养基,37℃、180r/min 培养12h。培养结束后,移取1mL 菌液于1.5mL 无菌离心管中,12000 ×g 离心5min,弃上清,PBS(0.01mol/L pH7.4)洗涤两次后,等体积PBS重悬,制得菌悬液备用。
1.2.2 活菌计数 对1.2.1 制备的菌悬液进行系列十倍梯度稀释,选取不同梯度的稀释菌液100μL 分别均匀涂布于LB 平板,37℃倒置培养24h 后,统计平板上长出的菌落数。
1.2.3 基因组DNA 的提取 将1.2.1 制备的菌悬液沸水浴10min,使细菌裂解、DNA 释放,随后迅速冷却至室温,12000 ×g 离心5min,上清转移至新的1.5mL无菌离心管,-20℃保存备用。
1.2.4 引物的设计与合成 根据GenBank 所收录的cesB 序列(ID:AY691650.1)和 gyrB 序列(ID:CP000001.1),通过BLAST 比对,找出蜡样芽孢杆菌的特异性序列;分别采用Primer 6.0 软件设计特异性引物,交由英潍捷基(上海)贸易有限公司合成(引物序列见表1)。

表1 引物序列及扩增产物长度Table 1 The sequence of primers and the length of amplification products
1.2.5 引物特异性的验证 按照1.2.1 方法对所有菌株进行培养,按照1.2.3 方法提取基因组DNA。分别对所有菌株进行PCR,以验证表1 中引物的特异性。PCR 体系为10μL:5μL 2 ×Taq Mix,0.2μL 上、下游引物,2μL 模板,补加去离子水至10μL。PCR 反应条件为:95℃预变性10min;94℃变性30s,58℃退火30s,72℃延伸30s,进行30 个循环,再72℃终延伸10min。PCR 产物用经过GoldView 核酸染色的1.5%的琼脂糖凝胶进行电泳。用GelDoc XR 凝胶成像系统成像。
1.2.6 荧光定量PCR
1.2.6.1 标准曲线的建立 取1.2.1 制得菌悬液进行系列十倍梯度稀释,取6 个连续梯度浓度的菌液,按照1.2.3 方法提取基因组DNA,采用上述两对引物分别进行荧光定量PCR。总反应体系为20μL:10μL 2×SYBR Primer Ex Taq,上、下游引物各0.8μL,0.4μL ROX Reference Dye,2μL 模板,补加去离子水至20μL。阴性对照为2μL 去离子水代替模板加入反应体系。扩增反应条件:95℃30s;95℃5s、58℃1min,进行40 个循环;95℃15s、60℃15s、95℃15s。
1.2.6.2 人工污染食品中蜡样芽孢杆菌的检测 从当地超市购买新鲜米饭,经传统平板计数法检测证明无蜡样芽孢杆菌污染。称取25g 米饭样品于225mL LB 培养基,加入已知浓度的产呕吐毒素的蜡样芽孢杆菌,使得米饭培养基混合液样品中细菌最终浓度分别为100、101、102、103、104和105CFU/g。混合液900 ×g 离心1min,去掉米饭残渣,取1mL 上清液于1.5mL 无菌离心管中,12000 ×g 离心5min,弃上清,PBS 洗涤两次后,等体积无菌水重悬,按照1.2.3方法提取基因组DNA。
2 结果与讨论
2.1 活菌计数
待涂布的LB 平板上长出清晰单菌落,统计菌落数,换算取平均值。结果表明1.2.1 制得菌悬液的浓度为1.2 ×108CFU/mL。
2.2 引物特异性验证
以各菌株的基因组DNA 作为模板,分别用能编码蜡样芽孢杆菌产呕吐毒素合成酶的结构基因cesB和蜡样芽孢杆菌具有高度特异性的DNA 旋转酶的B亚基的基因gyrB 设计引物,利用常规PCR 技术对引物进行特异性分析,琼脂糖凝胶电泳结果显示,采用cesB 引物,只有JDZ102Y 和P20063L 这两株产呕吐毒素的蜡样芽孢杆菌能扩出154bp 的特异性条带,其它蜡样芽孢杆菌无扩增条带;采用gyrB 引物,所有的蜡样芽孢杆菌均能扩出114bp 的特异性条带,而非蜡样芽孢杆菌以及阴性对照均无扩增条带,见表2。表明所设计的引物对蜡样芽孢杆菌具有很强的特异性,能区分出产呕吐毒素还是不产毒蜡样芽孢杆菌,与其它非蜡样芽孢杆菌无交叉,因此,这两对特异性引物可用来构建荧光定量PCR 方法。本研究选用产呕吐毒素的蜡样芽孢杆菌JDZ102Y 进行后续实验。
表2 菌株及引物特异性验证Table 2 Bacteria strains and the specificity of primers
2.3 不同引物扩增的标准曲线的建立
将1.2.1 所获得菌悬液进行系列稀释,取含101、102、103、104、105、106CFU/mL 的稀释液按1.2.3 方法提基因组DNA,取2μL 进行定量PCR 扩增,根据菌落计数的结果可以推算出稀释液的浓度分别为1.2×107、1.2 ×106、1.2 ×105、1.2 ×104、1.2 ×103和1.2 ×102CFU/mL,以此菌液提基因组DNA 进行荧光定量PCR 实验,则PCR 体系中模板的浓度分别为1.2 ×106、1.2 ×105、1.2 ×104、1.2 ×103、1.2 ×102和1.2 ×101CFU/mL。建立Ct 值与模板浓度的标准曲线,如图1。采用cesB 引物的标准曲线的回归方程为:Y =-3.3347X +34.102,相关系数为0.9956,扩增效率为99.4%。;采用gyrB 引物的标准曲线的回归方程为:Y =-3.3354X +35.341,相关系数为0.9972,扩增效率为99.5%两条标准曲线的斜率分别为-3.3347和-3.3354,在-3.1 ~-3.5 的合理范围内。从图1 可知,利用纯培养提取的相同浓度的模板,基于不同靶基因进行的荧光定量PCR 所获得的Ct 值相差不大,靶基因cesB 和gyrB 扩增效率均高于99%,相关系数都大于0.99,说明荧光定量PCR 扩增接近理想扩增,该方法对样品测定结果准确,可用于对实际污染样品的检测。

图1 基于不同引物扩增的标准曲线Fig.1 The standard curve based on different primers
2.4 人工污染实际样品中蜡样芽孢杆菌的检测限
为了模拟受污染天然食品的检测,取不同梯度稀释的蜡样芽孢杆菌接种到米饭样品中,提基因组DNA,进行荧光定量PCR 检测。根据Ct 值和图1 不同引物扩增的标准曲线计算出不同引物条件下检测出的菌液浓度。每次实验进行三次重复,结果如表3所示。米饭中蜡样芽孢杆菌污染浓度为100CFU/g时,荧光定量PCR 不能检测出该菌;污染浓度超过101CFU/g 菌液时,荧光定量PCR 能获得相应的Ct值,能检测出对应浓度的蜡样芽孢杆菌。从实际样品获取的同一模板,两组引物进行的荧光定量PCR检测结果相似,然而当米饭中污染浓度为105CFU/g时,采用cesB 引物进行扩增,得到的平均Ct 值为20.68,再结合图1,每个模板的Ct 值与起始拷贝数的对数之间存在线性关系,利用此线性关系可以定量计算出污染米饭中蜡样芽孢杆菌的浓度为1.06 ×105CFU/g,而采用gyrB 引物进行的扩增,得到的平均Ct 值为22.16,再根据标准曲线计算出的米饭污染浓度为8.95 ×104CFU/g;基于靶基因gyrB 进行的荧光定量PCR 所获得的Ct 值大于靶基因cesB 引物获得的Ct 值,可能与食品基质对gyrB 扩增效率造成一定影响有关,然而,它们的检测灵敏度是一致的,只有食品基质中蜡样芽孢杆菌的浓度高达105CFU/g时,基于gyrB 靶基因的检测浓度为8.95 ×104CFU/g,而基质中菌的浓度为101、102、103、和104CFU/g 均能定量检测出来对应浓度,结果表明检测效率较高。本研究基于不同靶基因进行的荧光定量PCR 均能检测到米饭中101CFU/g 的蜡样芽孢杆菌。Ombui[12]利用多重PCR 技术对蜡样芽孢杆菌污染的米饭进行检测所获得检测限为4 × 104CFU/g,Lim 等[13]利用nheA、groE 和ces 构建的荧光定量PCR 对蜡样芽孢杆菌污染的豆酱检测时的检测限为(7.0 ± 0.2)×102CFU/g,说明本研究构建的基于不同靶基因的检测方法检测灵敏度比Lim 及Ombui 等的要高。
3 结论
蜡样芽孢杆菌是一种常见的食源性致病菌,目前已被挪威和荷兰认定为食品中最容易检出的病源微生物[14]。蜡样芽孢杆菌引起的食物中毒大多是由于食物热加工处理和冷藏不当而引起芽孢大量繁殖,而中毒对象以小孩为主[7,15]。产呕吐毒素蜡样芽孢杆菌引起食物中毒反应较快(0.5~5h)[3],而症状一般比较温和,加之与其它病菌引起的中毒症状非常相似,因此该菌引起的食物中毒往往容易被人们所忽视、甚至发生误诊[16]。随着我国乳品工业、快餐、学生套餐和婴儿食品等的快速发展,蜡样芽孢杆菌对这些食品的威胁很大,有可能引起大规模中毒事件的爆发[17],因此,建立一种快速、准确检测蜡样芽孢杆菌的方法至关重要。
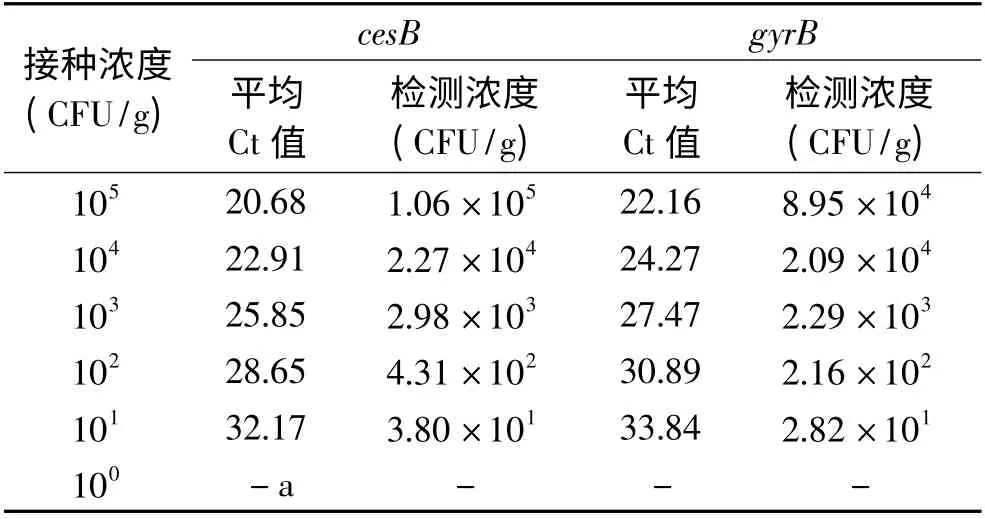
表3 污染米饭中蜡样芽孢杆菌的检测Table 3 Detection of B.cereus in rice
本研究构建的荧光定量PCR 方法具有特异性强、灵敏度高和能准确定量等优点。对不同浓度污染的米饭进行检测,当米饭中蜡样芽孢杆菌浓度为100CFU/g 时,该方法检测不到菌;当污染浓度超过101CFU/g 时,该方法能有效检测,且能对污染的菌液浓度进行准确定量,检测限能达到101CFU/g。通过基于不同靶基因对蜡样芽孢杆菌进行检测,能快速灵敏地识别产呕吐毒素或者不产毒蜡样芽孢杆菌,全程时间仅需3h(包括取样、前期处理和荧光定量PCR),比分别对产呕吐毒素和不产毒蜡样芽孢杆菌进行检测缩短了检测周期,为食品污染的检测和蜡样芽孢杆菌中毒的快速反应提供技术支持。
[1]Rosenbaum A,Papaliodis D,Alley R M,et al.Bacillus cereus Fasciitis:A unique pathogen and clinically challenging sequela of inoculation[J].American Journal of Orthopedics,2013,42(1):37-39.
[2]Granum P E,Lund T.Bacillus cereus and its food poisoning toxins[J].FEMS Microbiology Letters,2006,157(2):223-228.
[3]仪淑敏,李远钊,张培正,等.蜡样芽孢杆菌在营养肉汤和维也纳香肠中的生长模型及控制[J].食品工业科技,2007,28(9):72-75.
[4]Ehling-Schulz M,Fricker M,Grallert H,et al.Cereulide synthetase gene cluster from emetic Bacillus cereus:structure and location on a mega virulence plasmid related to Bacillus anthracis toxin plasmid pXO1[J].BMC Microbiology,2006,6(1):1-11.
[5]Ehling-Schulz M,Fricker M,Scherer S.Bacillus cereus,the causative agent of an emetic type of food-borne illness[J].Molecular Nutrition & Food Research,2004,48(7):479-487.
[6]刘志勇,赵雪涛,陆敏.Real-time PCR 测定食品中蜡样芽胞杆菌的数量[J].中国卫生检验杂志,2012,22 (8):1858-1863.
[7]Fricker M,Messelhäuβer U,Busch U,et al.Diagnostic realtime PCR assays for the detection of emetic Bacillus cereus strains in foods and recent food- borne outbreaks[J]. Applied and Environmental Microbiology,2007,73(6):1892-1898.
[8]Shiota M,Saitou K,Mizumoto H,et al.Rapid detoxification of cereulide in Bacillus cereus food poisoning[J].Pediatrics,2010,125(4):951-955.
[9]Dzieciol M,Fricker M,Wagner M,et al.A novel diagnostic real- time PCR assay for quantification and differentiation of emetic and non-emetic Bacillus cereus[J].Food Control,2012,32(2013):176-185.
[10]刘仲敏,郑鸣,王永芬,等.食源性沙门氏菌实时定量PCR 检测研究[J].食品工业科技,2007,28(8):233-236.
[11]Yamada S,Ohashi E,Agata N,et al.Cloning and nucleotide sequence analysis of gyrB of Bacillus cereus,B.thuringiensis,B.mycoides,and B.anthracis and their application to the detection of B.cereus in rice[J].Applied and Environmental Microbiology,1999,65(4):1483-1490.
[12]Ombui J N,Gitahi J N,Gicheru M M.Direct detection of Bacillus cereus enterotoxin genes in food by multiplex polymerase chain reaction[J].International Journal of Integrative Biology,2008,2(3):172-181.
[13]Lim J S,Kim M R,Kim W,et al. Detection and differentiation of non-emetic and emetic Bacillus cereus strains in food by real-time PCR[J].Journal of the Korean Society for Applied Biological Chemistry,2011,54(1):105-111.
[14]Beattie S H,Williams A G. Detection of toxins[M].Encyclopedia of Food Microbiology,2000,141-149.
[15]Dierick K,Van Coillie E,Swiecicka I,et al.Fatal family outbreak of Bacillus cereus-associated food poisoning[J].Journal of Clinical Microbiology,2005,43(8):4277-4279.
[16]王振国,刘金华,肖成蕊,等.利用PCR 技术检测致病性蜡样芽孢杆菌的研究[J].生物技术,2005,15(5):45-47.
[17]周帼萍,袁志明.蜡状芽孢杆菌(Bacillus cereus)污染及其对食品安全的影响[J].食品科学,2007,28(3):357-360.
