紫蛇尾胶原蛋白提取工艺的研究
2013-08-07姜斌汪秋宽何云海任丹丹
姜斌,汪秋宽,何云海,任丹丹
(大连海洋大学辽宁省水产品加工及综合利用重点实验室,辽宁大连116023)
紫蛇尾胶原蛋白提取工艺的研究
姜斌,汪秋宽,何云海,任丹丹
(大连海洋大学辽宁省水产品加工及综合利用重点实验室,辽宁大连116023)
以紫蛇尾Ophiopholismirabilis为原料检测其基本成分,并用盐酸对紫蛇尾进行脱钙处理,通过L9(34)正交试验对其胶原蛋白的提取工艺进行了优化。结果表明:紫蛇尾含水分51.80%,灰分42.91%,蛋白质1.68%,脂肪0.29%,总糖0.03%;酶促溶性胶原蛋白 (PSC)提取工艺的优化条件为脱钙后的紫蛇尾干粉 (g)与提取液 (mL)的固液比为1∶15,胃蛋白酶加酶量3%,17℃下提取4 d,PSC得率为52.65%。对纯化后的酸促溶性胶原蛋白 (ASC)和PSC进行紫外扫描分析,结果显示,ASC、PSC的最大吸收波长均在235 nm左右。对PSC的氨基酸组成分析表明,脯氨酸和羟脯氨酸的含量分别为10.1%和2.13%,是较典型的Ⅰ型胶原蛋白。
紫蛇尾;酸处理时间;酶促溶性胶原蛋白;紫外分析
紫蛇尾Ophiopholismirabilis属于棘皮动物、蛇尾纲、鄂蛇尾亚目、辐蛇尾科[1]。目前对紫蛇尾的研究主要集中在生态学分类和再生机制方面,而对其活性物质的研究比较少[2]。国内外对胶原蛋白的研究报道较多,且已取得了一定的进展,尤其是鱼类胶原蛋白, 包括从鲫[3]、 鲤[4]、 鲽[5]、 海参[6-7]、 鱿鱼[8]、 海蜇[9-10]等提取胶原蛋白, 大部分是从鱼皮[11-14]、 鱼骨[15-16]、 鱼鳞[17]等水产品加工废弃物中提取胶原蛋白。胶原蛋白的提取方法有多种, 主要有酸提法[18]、 热水提法[19]、 酶提法[20]。近年来,海星[21-22]也因其含有胶原蛋白和皂苷等生物活性物质而被国内外学者关注,但尚未见对紫蛇尾胶原蛋白的研究报道。为此,本研究中对紫蛇尾的营养成分及其胶原蛋白提取工艺进行优化,旨在开拓高附加值紫蛇尾胶原蛋白加工产品的新途径。
1 材料与方法
1.1 材料
试验所用紫蛇尾由大连獐子岛渔业集团股份有限公司提供。胃蛋白酶购于Solarbio公司。
主要仪器与设备有FD-4冷冻干燥机、UV-754分光光度计和GL-21M冷冻离心机。
1.2 方法
1.2.1 紫蛇尾原料的预处理 将紫蛇尾原料浸泡于浓度为0.4 mol/L的盐酸溶液中[22],进行搅拌,每日更换溶液一次,共浸泡3 d。然后用清水漂洗至中性,将漂洗后的紫蛇尾体壁浸泡于浓度为0.3 mol/L的NaOH溶液中进行搅拌,共处理6 h,且每隔2 h更换一次碱液,结束后漂洗至中性。以上操作均在4℃以下进行,以防止胶原蛋白在提取过程中变性[23]。用真空冷冻干燥样品,并用粉碎机粉碎成粉末备用。
1.2.2 胶原蛋白的提取及纯化 称取紫蛇尾预处理样品60 g,按照固液比为1∶20的比例加入浓度为0.5 mol/L的乙酸-乙酸钠溶液中。在10℃下提取2 d后进行离心,取上清并向上清液中缓慢加入NaCl,使其终浓度达到0.5 mol/L,在4℃下静置24 h,使蛋白析出。然后在4℃下以10 000 r/min离心30 min,将沉淀溶于0.5 mol/L的乙酸溶液中透析脱盐,再次进行离心。最后将沉淀冷冻干燥,即得纯度较高的酸溶性胶原蛋白 (ASC)。
等量称取9份紫蛇尾粉,用ASC提取工艺进行酶促溶性胶原蛋白(PSC)的提取。将上述第一步所得溶液离心后,向沉淀中加入浓度为0.5 mol/L的乙酸提取液。以提取时间、温度、胃蛋白酶加酶量和样品 (g)与提取液 (mL)的比 (简称固液比)为试验因素,设计4因素3水平 (表1)的酶解正交试验L9(34),其操作方法与ASC提取步骤相同,即得纯度较高的PSC。

表1 PSC正交试验因素水平表Tab.1 The factor and level table in the orthogonalexperiment of PSC
1.2.3 紫外光谱分析 将纯化后的样品溶于0.5 mol/L乙酸溶液中,在200~400 nm波长处对其紫外吸收进行测定。
1.2.4 氨基酸组成分析 取一定量的胶原蛋白样品,在减压充氮条件下,用6 mol/L HCl于110℃下水解24 h。采用日立835-50型氨基酸分析仪对样品进行检测。
2 结果与分析
2.1 紫蛇尾的基本组成成分
从表2可见,紫蛇尾中灰质成分含量很高,其干基中含量为89.04%,其他含量相对较少。海燕中灰分为 42.04%[21],海盘车中灰分含量为66.39%[24],紫蛇尾中的灰质含量远高于海盘车与海燕。这使紫蛇尾的脱钙预处理与其他两种原料有很大差异。
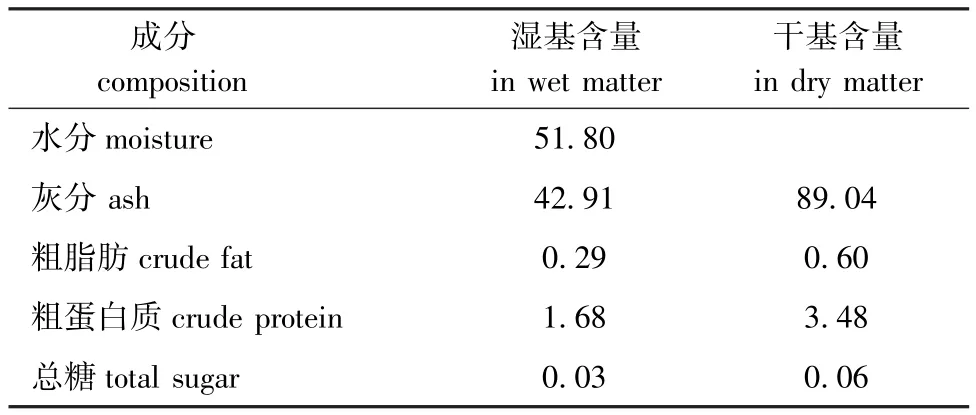
表2 紫蛇尾的基本组成成分Tab.2 The approximate composition in brittle-starw/%
2.2 酸溶性胶原蛋白的提取率
在酸溶性胶原蛋白提取过程中,以0.5 mol/L乙酸-乙酸钠为提取液,紫蛇尾样品与提取液的固液比为1∶20,在10℃下提取2 d,ASC得率为0.025%。
2.3 酶促溶性胶原蛋白提取工艺的优化
从表3可见,不同的正交试验参数组合所得的PSC的差异很大,9个试验组中,9号试验组的PSC提取率最高,为52.65%。极差分析结果表明,各个因素对PSC提取率影响的主次顺序为A>C>B>D,最佳提取条件为A3B3C2D1,正好与正交试验中的最佳试验组合9号一致,即最佳提取组合条件为提取时间4 d、加酶量3%、温度17℃、固液比1∶15,在此条件下PSC的提取率为52.65%。
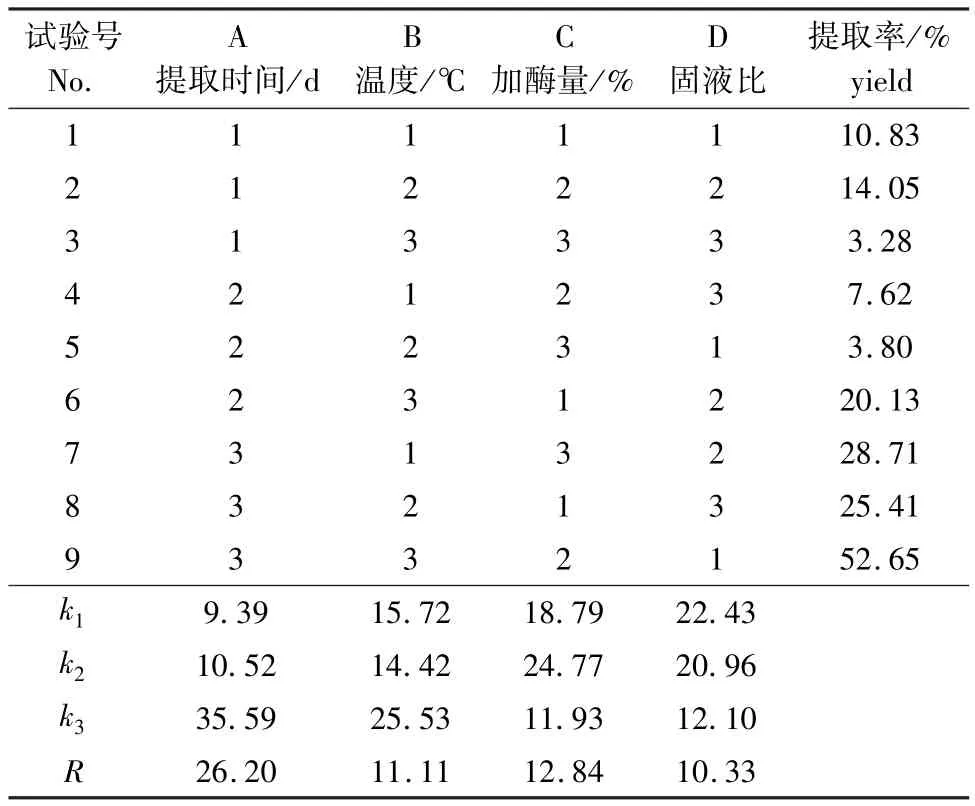
表3 提取PSC的正交试验设计方案及试验结果Tab.3 The results of the orthogonal experiment of PSC
2.4 ASC和PSC的紫外光谱扫描
在波长为200~400 nm时,对所提取的ASC、PSC进行紫外光谱扫描,结果见图1。由图1可见,ASC、PSC的最大吸收波长均为235 nm,这符合I型胶原蛋白的紫外吸收特征,这表明本试验中提取到的胶原蛋白为纯度较高的 I型胶原蛋白[21-22]。
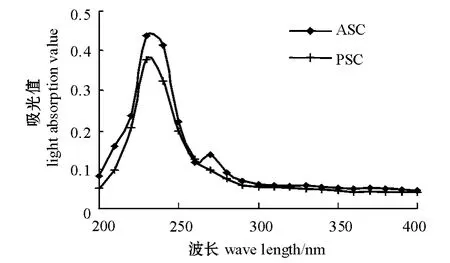
图1 ASC、PSC紫外吸收光谱Fig.1 The UV spectra of ASC and PSC
2.5 胶原蛋白氨基酸的组成
按照本试验所得最佳提取工艺条件制备获得PSC的氨基酸组成如表4所示,氨基酸总量为95.03%,其中甘氨酸、谷氨酸、丙氨酸、脯氨酸的含量比较高,分别为 24.90%、12.40%、9.59%、10.10%。羟脯氨酸和脯氨酸是胶原蛋白特有的氨基酸[25-26],从以上数据显示来看,脯氨酸的含量占胶原蛋白总量的10.10%,这符合胶原蛋白的氨基酸组成特点[27-30];羟脯氨酸的含量占氨基酸总量的2.13%,羟脯氨酸的含量与胶原蛋白的变性温度有关,含量越高变性温度越高,胶原蛋白维持三股螺旋结果的能力越强,羟脯氨酸是脯氨酸在转译后由脯氨酸羟基化作用产生的[18]。苏氨酸占3.56%,丝氨酸占5.15%,苏氨酸和丝氨酸可逐渐转化成羟脯氨酸,以适应较高温度的生活环境。本试验结果表明,PSC胶原蛋白的氨基酸种类丰富,其中包括7种人体必需氨基酸 (赖氨酸、蛋氨酸、亮氨酸、异亮氨酸、苏氨酸、缬氨酸和苯丙氨酸),2种人体半必需氨基酸 (精氨酸和组氨酸),以及8种其他氨基酸 (谷氨酸、丙氨酸、羟脯氨酸、甘氨酸、天冬氨酸、脯氨酸、丝氨酸和酪氨酸),这与刘石生等[19]的研究结果一致。
3 讨论
本研究中对紫蛇尾胶原蛋白提取进行了初步研究。从紫蛇尾中提取出ASC和PSC,确定了PSC的最佳反应条件。紫蛇尾含水量为51.80%,其干基中灰分含量为89.04%,粗脂肪含量为0.60%,粗蛋白质含量为3.48%,总糖含量为0.06%。紫蛇尾中的灰质含量远高于海盘车与海燕[21,24]。这使紫蛇尾的脱钙预处理与其他两种原料有很大差异。潘洪民等[17]报道的提取鱼鳞胶原蛋白的最佳工艺务件为:固液比1∶25,脱钙时间3 h,提取时间1.5 d,脱钙酸浓度为0.4 mol/L,在此条件下,胶原蛋白提取率为1.142%。这与紫蛇尾的脱钙条件也有很大差异,本试验中,ASC提取率为0.025%,说明紫蛇尾中酸溶性胶原蛋白含量很少。提取酶溶性胶原蛋白的正交试验结果显示,影响PSC提取率的因素主次顺序为提取时间>加酶量>温度>固液比。极差分析得到,制备PSC的最佳反应条件为:提取4 d、加酶量为3%、提取温度为17℃、固液比为1∶15。最佳反应条件下PSC提取率为52.65%,较郝林华等[24]报道的多棘海盘车体壁胶原蛋白的提取率略低,这与紫蛇尾的蛋白含量低于多棘海盘车的蛋白含量有关。对 ASC和PSC紫外光谱分析显示,所提取的海蛇尾ASC和PSC的最大吸收波长均为235 nm,符合Ⅰ型胶原蛋白的紫外特征吸收,表明ASC和PSC均为典型的Ⅰ型胶原蛋白。刘远平等[21]报道的海燕体壁胶原蛋白的ASC和PSC的最大吸收波长也为235 nm,与本研究结论一致;辛菲等[31]报道的关于鲅鱼皮酸溶性胶原蛋白的紫外吸收波长为230 nm,与本研究的结果稍有差异。本研究中,PSC的氨基酸组成显示,甘氨酸、谷氨酸、丙氨酸和脯氨酸的含量较高,分 别 为 24.90%、12.40%、9.59% 和10.10%,脯氨酸的含量占胶原蛋白总量的10.10%,这与牛皮、猪皮、鲤鱼鳞、罗非鱼皮等胶原蛋白中的脯氨酸含量[25]相近,符合胶原蛋白的氨基酸组成特点。
[1] 黄宗国.中国海洋生物种类与分布[M].北京:海洋出版社, 2008:713-717.
[2] 杨柳青.戴太阳镜的海蛇尾[J].科学之友,2006(12):53.
[3] 聂小宝,潘洪民,程丽林,等.鲫鱼鱼鳞胶原蛋白提取工艺的研究[J].山东农业科学,2012,44(1):109-111.
[4] 潘冰青,刘光明,曹敏杰,等.鲤鱼胶原蛋白的过敏原性研究[J].集美大学学报,2011,16(5):341-345.
[5] 王群,郑海涛,葛尧,等.酶法制备鲽鱼鱼皮胶原蛋白肽及其清除超氧阴离子自由基的研究[J].中国农学通报,2011,27 (14):87-93.
[6] 肖枫,曾名勇,董士远,等.海参胶原蛋白的研究进展[J].水产科学,2005,24(6):39-41.
[7] 叶继锋,陈秀美,戴伟伟,等.海参胶原蛋白的提取及其基本成分的分析[J].光谱实验室,2011,28(6):3196-3199.
[8] 许庆陵,郭恒斌,曾庆祝.鱿鱼皮胶原蛋白制备技术研究[J].科学研究,2008,29(9):59-63.
[9] Morishige A,Sughara T,Nishimoto S.Immunostimulatory effects of collagen from jellyfish in vivo[J].Cytotechnology,2011,63(5): 481-492.
[10] 丁进锋,苏秀榕,张春丹,等.海蜇胶原蛋白提取工艺及促愈合作用研究[J].食品科学,2010,31:19-23.
[11] Boonprab K,Satiankomsorakrai J,Khamthong N.Optimum fish for fish glue processing for fish skin value added and the glue character[J].Journal of Agricultural Science and Technology,2011 (B1):1211-1215.
[12] Muralidharan N,Shakila R J,Sukumar D,et al.Skin,bone and muscle collagen extraction from the trash fish,leather jacket (Odonus niger)and their characterization[J/OL].Journal of Food Science and Technology,2011,DOI10.1007/s13197-011-0440-y.
[13] 艾超,黄灿灿,李致瑜,等.鱼皮胶原蛋白提取工艺的研究进展[J].农产品加工学刊,2012(5):93-94.
[14] 刘朝霞,陈海光,黄东雨.鱼皮胶原蛋白的提取及其应用[J].广东农业科学,2011,20:100-102.
[15] Suárez M D,Abad M,Ruiz-Cara T,etal.Changes inmuscle collagen content during postmortem storage of farmed sea bream (Sparus aurata):influence on textural properties[J].Aquaculture International,2005,13(4):315-325.
[16] 吴缇,陈舜胜.斑点叉尾鮰鱼骨胶原蛋白的提取与特性研究[J].食品工业科技,2009(3):263-266.
[17] 潘洪民,聂小宝,程丽林,等.武昌鱼鱼鳞胶原蛋白提取工艺的研究[J].安徽农业科学,2012,40(1):111-115.
[18] 陈丽丽,赵利,刘华.有机酸提取鮰鱼皮胶原蛋白的工艺研究[J].食品与机械,2010,26(5):118-121.
[19] 刘石生,易美华,黄文艳.热水提取罗非鱼鱼鳞胶原蛋白的研究[J].现代食品科技,2006,22(4):139-141.
[20] 程波,吴洁,张玉蓉.酶法提取人工养殖鲟鱼皮中胶原蛋白的工艺研究[J].食品研究与开发,2009,30(3):1-4.
[21] 刘远平,张琳琳,张慧怡,等.海燕体壁胶原蛋白提取工艺的初步研究[J].大连海洋大学学报,2011,26(1):54-57.
[22] 张琳琳,汪秋宽.海燕酸脱除液中各元素含量的分析[J].大连海洋大学学报,2012,27(1):86-88.
[23] 刘庆慧,王彩理.鱼鳞胶原蛋白研究[J].海洋水产研究, 2000,12(3):57-61.
[24] 郝林华,李八方.多棘海盘车体壁胶原蛋白的研究[J].中国水产科学,1999,6(2):18-21..
[25] 宋芹,董小萍,郁小兵.部分哺乳动物和鱼类胶原蛋白中氨基酸的组成和含量的比较[J].现代食品科技,2008,24:1239-1242.
[26] 李鹏,李瑞伟,王浩,等.尼罗罗非鱼鱼皮胶原蛋白及其美拉德反应产物成分分析[J].江西水产科技,2008(3):12-16.
[27] 杨树奇,曾少葵,周春霞,等.3种鱼皮的基本成分及氨基酸组成分析[J].广东海洋大学学报,2010,30+:97-100.
[28] Liu Zunying,Su Yicheng,Zeng Mingyong.Amino acid composition and functional properties of giant red sea cucumber(Parastichopus califomicus)collagen hydrolysates[J].China Oceanic and Coastal Sea Research,2011,10(1):80-84.
[29] 林炜,穆畅道,朱梅湘.利用皮边角料提取食品级胶原蛋白/多肽(Ⅰ)——氨基酸组成分析和分子量测定[J].中国皮革, 2003,32:5-8.
[30] Williams JR,Gong H.Biological activities and syntheses of steroidal saponins:the shark-repelling pavoninins[J].Lipids,2007, 42(1):77-86.
[31] 辛菲,李华.鲅鱼皮酸溶性胶原蛋白提取及分子特性的初步研究[J].新疆农业科学,2012,49(1):122-126.
Extraction of collagen from brittle star Ophiopholis mirabilis
JIANG Bin,WANG Qiu-kuan,HE Yun-hai,REN Dan-dan
(Key Laboratory of Fishery Product Processing and Utilization of Liaoning Province,Dalian Ocean University,Dalian 116023,China)
The approximate composition of brittle star Ophiopholis mirabilis was analyzed and the extraction technology of pepsin-soluble collagen(PSC)was optimized from the brittle star powder decalcified by HCL in an orthogonal experiment.The results showed that the brittle star powder contained moisture of 51.80%,ash of 42.91%, crude protein of 1.68%,crude fat of 0.29% and sugar of 0.03%.The orthogonal experiment indicated that the optimal extraction of pepsin soluble collagen(PSC)was carried out under the conditions of addition of pepsin at a rate of 3%,and hydrolyzing temperature of 17℃ for 4 days.The ratio of the powder and extracting solution was found to be 1∶15 with PSC yield of 52.65%.The UV spectrotography of the extracted acid soluble collagen (ASC)and PSC revealed that the maximal absorbance of both collagens was at 235 nm,indicating that both ASC and PSC were typical I type collagen.
Ophiopholis mirabilis;acid treatment time;pepsin-soluble collagen(PSC);UV analysis
S986
A
2095-1388(2013)05-0498-04
2013-01-30
国家科技成果转化项目 (2008GB2B000061)
姜斌 (1987-),男,硕士研究生。E-mail:390219748@qq.com
汪秋宽 (1962-),女,教授。E-mail:wqk320@dlou.edu.cn
