人为干扰对闽江河口短叶茳芏湿地N2O排放的影响
2013-08-03张永勋曾从盛黄佳芳王维奇福建师范大学地理科学学院福建福州350007福建师范大学亚热带湿地研究中心福建福州350007福建师范大学湿润亚热带生态地理过程省部共建教育部重点实验室福建福州350007
张永勋,曾从盛,3*,黄佳芳,王维奇,3 ,仝 川,3 (1.福建师范大学地理科学学院,福建 福州 350007;2.福建师范大学亚热带湿地研究中心,福建 福州 350007;3.福建师范大学湿润亚热带生态-地理过程省部共建教育部重点实验室,福建 福州 350007)
人类活动排放温室气体导致的气候变暖已成为重大的全球性问题之一.自工业革命以来,化石燃料燃烧和土地利用变化等[1]行为方式已造成全球大气中CO2、CH4和N2O的平均含量分别上升了35%、48%和28%[2].虽然N2O的增加速率低于CO2和CH4,但是其增温潜势在百年尺度上是CO2的298倍,成为导致全球变暖的重要温室气体之一[2].定量研究生态系统的 N2O排放及其规律已成为目前研究的热点.
河口地区是陆地系统、淡水系统和海洋系统交互作用的地区,是人类活动影响最强烈的地区之一[3].河流沿岸区位条件优越,人口密集,人类活动排放大量的营养物质被河水携带到河口地区,导致河口沉积物养分十分丰富.河口潮间带受潮汐作用不断的淹水排干交替,土壤环境不断发生变化,与此同时,硝化反硝化作用也交替占主导作用,而这2个过程都是产生N2O气体的重要过程[4-6].此外,河口潮间带是直接接纳沉积物和养分的区域,特别是N素的输入直接参与了硝化反硝化作用[7-8],使其成为 N2O产生的重要源区[9].有研究表明,全球人为排放的N2O有1/3来自河流河口和近岸等环境[10].河口地区地形、土壤、气候和水文条件优越,适宜于多种生物生存,是一个多样性较高的生态系统[11],但由于环境的生存限制因素少,易受外来物种入侵,使其成为最易受到外界干扰的脆弱生态系统类型之一[12].河口潮间带是受到人为干扰最为严重的地区之一.因此,河口湿地生态系统已经成为国内外学者关注的热点地区[13].
国外关于河口湿地N2O排放研究较早,而国内相对较晚[14].目前国内在胶州湾河口[15],黄河口[16],长江口[17],珠江口[18]等河口开展了相关研究,而作为典型的亚热带河口-闽江河口还是研究空白.近几年闽江河口受外来种互花米草(Spartina alterniflora Loisel)入侵严重,而且随着经济的发展闽江河口海域水体呈富营养化趋势[19],此外,当地渔民捕捉螃蟹和湿地放牧等踩踏行为也造成了部分湿地植被死亡形成裸地.基于这些现状,本研究选取具有代表性的闽江河口潮间带鳝鱼滩短叶茳芏(Cyperus malaccensis var.brevifolius)湿地为研究对象,探讨外来种互花米草入侵、养分输入和踩踏等人为干扰对河口潮间带短叶茳芏湿地N2O排放的影响,对揭示N循环规律和准确评估河口湿地生态系统N2O排放具有重要的理论和现实意义,也为更全面估测我国温室气体的排放提供科学基础数据.
1 材料与方法
1.1 研究区概况
闽江河口潮间带鳝鱼滩湿地(26°00′36″~26°03′42″ N, 119°34′ 12″~119°40′40″ E),位于闽江口南部梅花水道南岸,琅歧岛东南部(图 1),主要是由河水从上游携带泥沙淤积而成的天然洲滩湿地,面积约 3120hm2.该区属中亚热带与南亚热带过渡的湿润季风气候区,年均气温19.3,℃年降水量约1346mm,降水多发生在3~9月,潮汐属正规半日潮[20].据多年观测,夏秋季潮位高(9月最高,大潮日到小潮日高潮时实验地皆可淹水),冬春季潮位低(3、4月最低,仅大潮日高潮时实验地才可淹水).建群种主要有短叶茳芏、芦苇(Phragmites australis)、藨草(Scirpus triqueter L.)和互花米草等挺水植物.实验样地选择在鳝鱼滩湿地中部(119°37′31″E,26°01′46″N),位于高潮与中潮带过渡区,植被主要由芦苇、咸草和互花米草入侵斑块组成.本研究选择的各实验样点距离较近,自然环境基本一致.
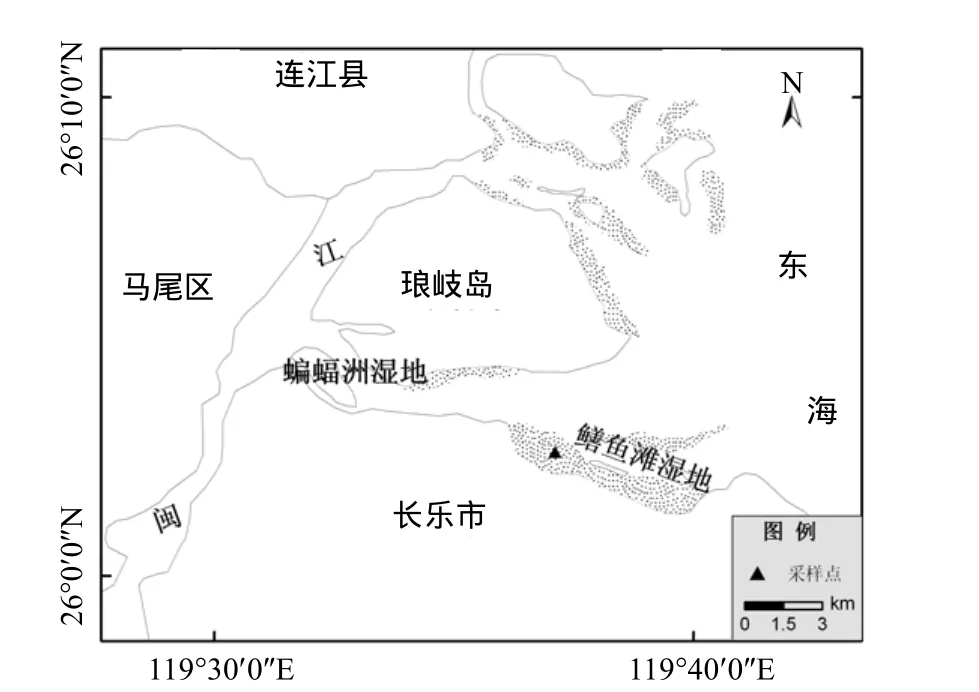
图1 闽江河口鳝鱼滩湿地位置Fig.1 The location of Shanyutan wetland in Minjiang River estuary
1.2 研究方法
1.2.1 野外采样设计 采用静态暗箱(浮箱)-气相色谱法,在互花米草入侵湿地、短叶茳芏湿地和踩踏形成的裸露湿地分别选取实验点位并设置 4个重复.由于互花米草和短叶茳芏生长期植株多在 1.2m 以上,静态箱设计为顶箱、中箱和底座 3个部分组成,由PVC材料制作.其规格分别为:中箱和顶箱长、宽和高分别为 35,35,120cm和35,35,20cm;底座设计规格有2种:一种用于测定裸露湿地和互花米草入侵湿地, 其长、宽和高分别为35,35,20cm,且每个侧面中间部分由下缘向上挖去15cm,上缘留5cm宽,四个棱留5cm宽;一种用于测定养分输入短叶茳芏湿地的干扰实验[以NH4NO3和(NH4)2HPO4混施表征氮磷输入,参照闽江河口水体富营养化实际状况(N含量为0.414~0.55mg/L; P含量为0.017~ 0.086mg/L)[21-23],考虑实验地农业废水排入的影响和潮汐涨落对实验地的反复淹水等因素,按农业施肥标准:氮磷肥比例 3:2,一次输入量分别为 165kg N/hm2和110kg P/hm2[24],春、秋季皆在第 1d和第4d首次观测前,将称量好的肥料倒入容器,以1000mL蒸馏水充分溶解,施入底座内土壤],其长、宽和高分别为35,35,50cm,以防止养分过快流失.底座在第1次采样前10d左右埋入实验样地(全部埋入,顶部与地面齐平),整个观测期均固定在采样点,顶箱和中箱外覆绝热材料,顶部安装 1个小风扇混合箱内气体.浮箱用 PVC管制作而成,高和垂直截面直径分别为35,25cm.为防止测试过程中人为踩踏干扰,搭建栈桥使采样时均在栈桥上进行.
采样时间选择在大潮月2011年9月26日到10月2日(农历8月29到9月初6)和小潮月2012年3月23日到3月27日(农历3月初2到3月初6)大潮日到小潮日白天进行(潮汐涨落及观测时间见表 1).根据涨落潮时间及天气变化情况,在淹水前2h内、淹水过程中(用浮箱法在涨、落潮过程中各测 1次)和潮水排干后 3h内, 测定互花米草入侵斑块N2O排放通量.无淹水情况下,高潮前2h、高潮时和高潮后2h测定.输入养分的短叶茳芏湿地和裸露湿地在淹水前2h内和潮水排干后3h内(无淹水情况下,高潮前2h和高潮后2h)测定.静态箱顶箱盖上后,立刻用注射器抽取箱内气体,每隔15 min采集1次,共抽气 3次,每次采样量为 60mL;有淹水情况下,涨潮和落潮过程中,用浮箱在短叶茳芏和互花米草湿地测定水-气界面N2O通量,涨潮和落潮过程中均选在淹水约30~70cm时段内采集气样,以探讨涨潮和落潮过程对气体排放的影响.采集的气样装入铝箔采样袋(大连德霖气体包装有限公司生产)带回实验室分析,同时采集地下水和潮水(距浮箱 50cm 范围内)样品,装入100mL的乳白色塑料瓶密封带回实验室分析.同步测定环境因子,其中土壤 (0~10cm) 的氧化还原电位(Eh)和pH值用IQ150便携式pH/氧化还原电位/温度计测得,盐度和土温由 2265FS便携式电导盐分/温度计测得.
1.2.2 室内样品测定与通量计算 将采集的气样在实验室用日本岛津公司生产的气相色谱仪(GC-2014)分析.N2O检测器为ECD(电子捕获检测器),参数设置分别为检测器温度320,℃柱箱温度70,℃载气温度70,℃载气为高纯氦气,流速为30mL/min,用中国计量科学研究院生产的0.306×10-6, 0.353×10-6和0.414×10-6N2O标准气体进行标定和校准.N2O气体通量的计算采用式(1).
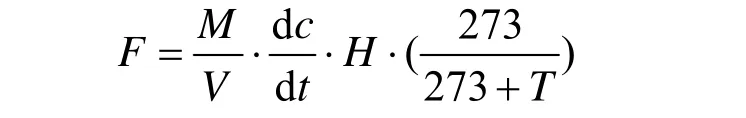
式中:F为N2O排放通量[μg/(m2·h)];M为N2O气体的摩尔质量;V为标准状态下1摩尔气体的体积;H为箱高;dc/dt为单位时间内气体浓度的变化率;T为箱内温度.
地下水和潮水在实验室用荷兰SKALAR公司生产的SAN++连续流动分析仪分析.
1.2.3 数据处理方法 运用EXECL 2003数据分析中描述统计功能对观测数据进行统计分析计算N2O通量,其中,春、秋季和总观测均值用每日观测时间中,淹水时长比和非淹水时长比作为权重(表 1),求加权平均值.运用图表功能对实验数据作图分析,运用单因素方差分析功能对不同干扰方式下的湿地观测数据与对照进行差异性分析和统计检验.
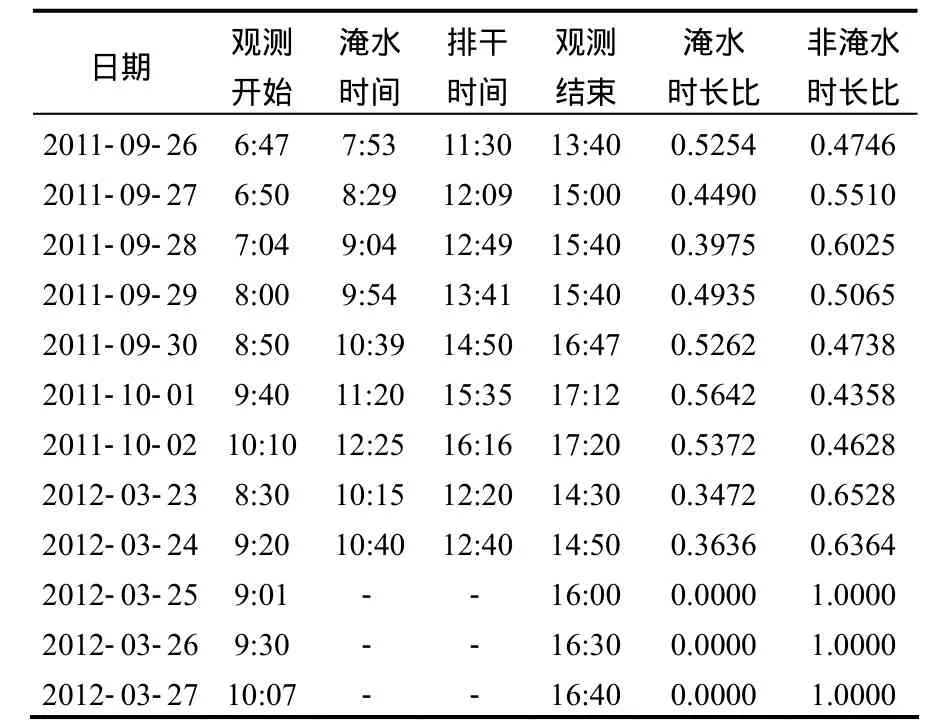
表1 潮汐涨落和观测时间Table 1 Tide fluctuation time and observation time
2 结果与分析
2.1 互花米草入侵对短叶茳芏湿地N2O排放的影响
2.1.1 互花米草入侵斑块湿地N2O通量 秋季,互花米草入侵斑块湿地在整个观测期,高潮时皆被潮水淹没(属1年中的大潮月).涨潮前、涨潮过程、落潮过程和落潮后N2O通量分别为(-23.02±13.02),(9.68±2.1),(10.13±1.55) 和 (46.6±4.47)μg/(m2·h), 在秋季,大潮到小潮白天观测的平均通量为10.79μg/(m2·h);从观测日不同潮汐阶段N2O排放变化趋势看(图2),除9月29日和10月2日涨潮前略高于涨落潮过程,其他各观测日,互花米草入侵斑块湿地N2O排放在不同潮汐阶段变化趋势相同.
春季,互花米草入侵斑块湿地在大潮日被潮水淹没,中小潮日无潮水淹没.被潮水淹没时,涨潮前、涨潮过程、落潮过程和落潮后互花米草入侵斑块湿地 N2O 通量分别为(10.65±2.30),(3.70±1.40), (0.27±3.36)和(15.73±0.33) μg/(m2·h),淹水时平均通量为 9.19μg/(m2·h);无潮水淹没时,高潮前、高潮时和高潮后,N2O通量分别为(31.5±4.90),(26.4±9.82)和 (32.63±28.6)μg/(m2·h),无淹水时平均通量为 30.18μg/(m2·h),在春季,大潮到小潮白天观测的平均通量为21.78μg/(m2·h).从观测日不同潮汐阶段N2O排放变化趋势看(图3),有淹水的2个观测日变化趋势相同,即落潮后排放最高,涨潮前次之,涨落潮过程中较低.无淹水的3个观测日,3月25日3次观测呈上升趋势,3月26日和3月27日呈现下降趋势.
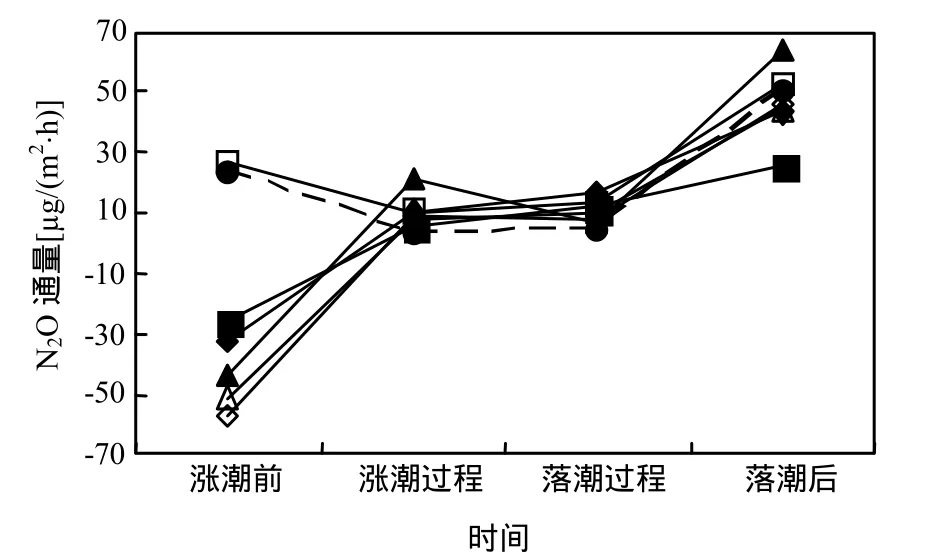
图2 秋季互花米草入侵湿地N2O排放Fig.2 N2O flux from invasive Spartina alterniflora wetland in autumn
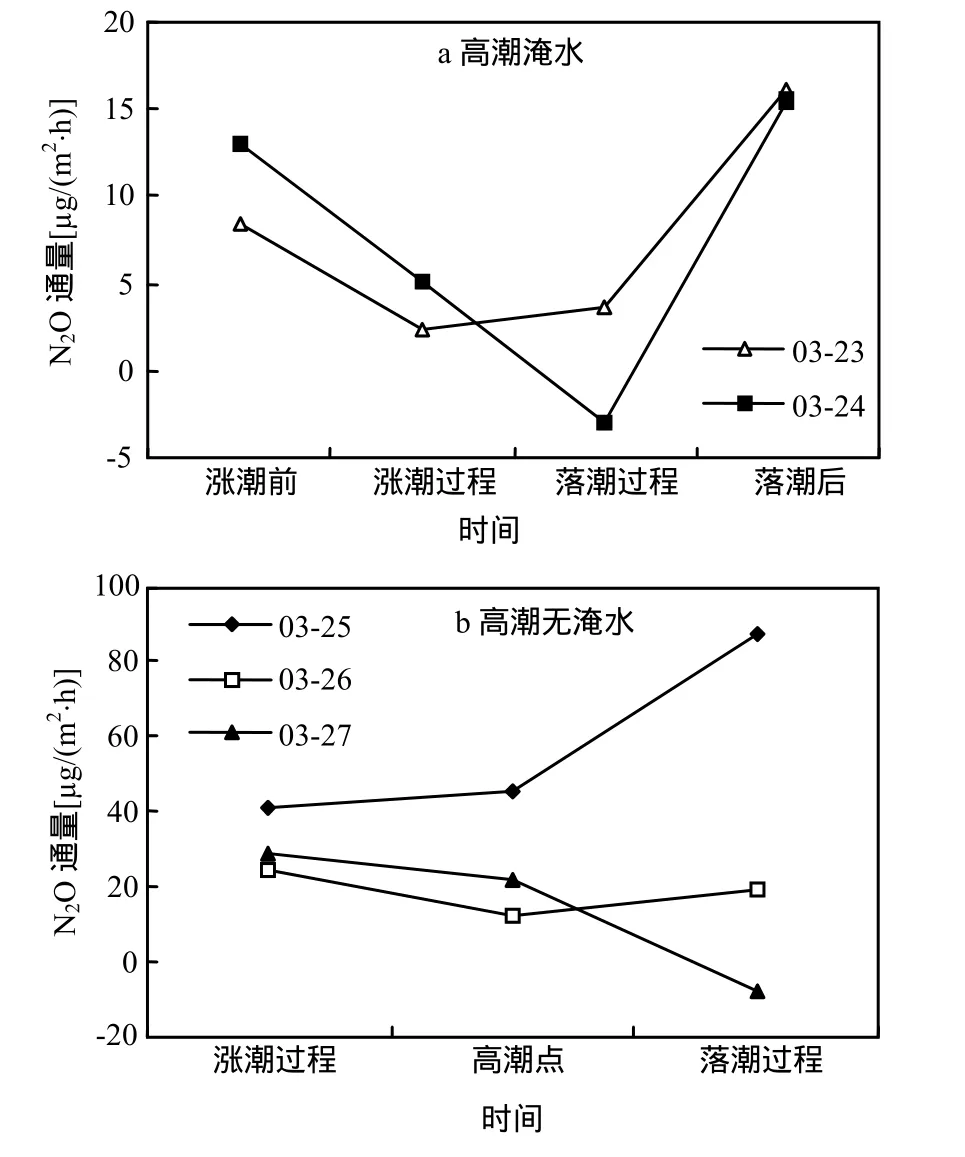
图3 春季互花米草入侵湿地N2O排放Fig.3 N2O flux from invasive Spartina alterniflora wetland in spring
总体上,观测期内,互花米草入侵斑块湿地N2O通量均值为15.37μg/(m2·h),春季淹水时低于秋季淹水时,但差别不大,而无淹水时明显高于淹水时,说明潮水浸淹降低了N2O排放.
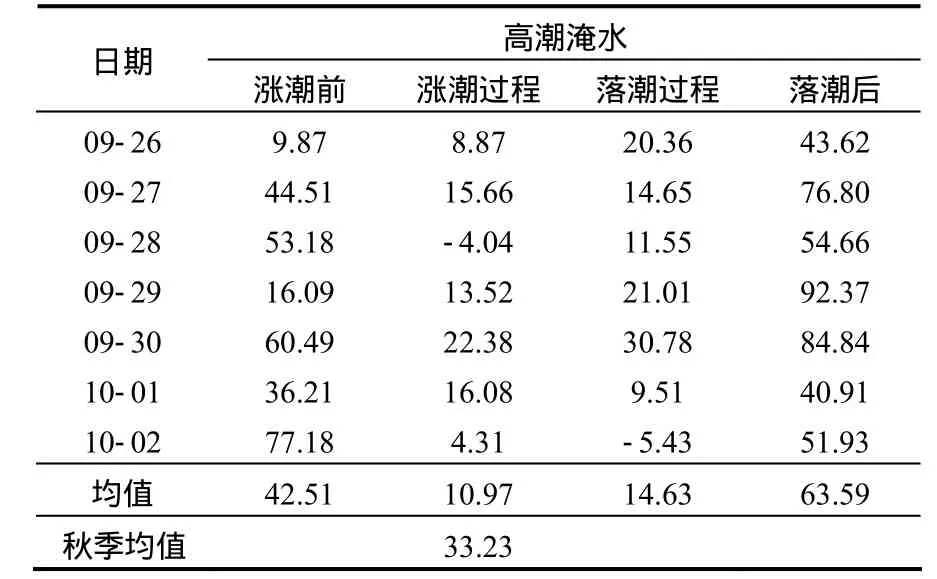
表2 短叶茳芏湿地秋季N2O通量[μg/(m2·h)]Table 2 Flux from C.malaccensis wetland in autumn[μg/(m2·h)]
2.1.2 互花米草入侵对短叶茳芏湿地N2O排放影响分析 外来种互花米草入侵降低了短叶茳芏湿地N2O通量.在秋季,互花米草入侵斑块湿地平均N2O通量低于短叶茳芏湿地,差异性极显著(P<0.01)(图2、表2),而在潮汐的不同阶段影响不同,涨潮前,互花米草入侵斑块湿地极显著低于短叶茳芏湿地 N2O 通量(P<0.01),涨潮过程、落潮过程与落潮后也低于短叶茳芏湿地,但差异性均不显著(P>0.05);春季,互花米草入侵斑块湿地N2O平均通量极显著高于短叶茳芏湿地(P<0.01)(图3、表3).分别对高潮淹水和高潮无淹水的两类潮日分析得出:高潮淹水时,互花米草入侵斑块湿地N2O通量低于短叶茳芏湿地,但差异性不显著(P>0.05),潮汐的各个阶段,除涨潮阶段互花米草入侵斑块湿地N2O通量略高于短叶茳芏湿地,其他阶段都低于短叶茳芏湿地,但各阶段差异性皆不显著(P>0.05).高潮无淹水时,互花米草入侵斑块湿地 N2O通量极显著高于短叶茳芏湿地(P<0.01),潮汐各阶段,前者都高于后者,高潮时,二者差异性显著(P<0.05),其他阶段二者差异性皆不显著(P>0.05).从观测数据分析来看,互花米草入侵对短叶茳芏湿地N2O通量的影响与潮汐作用密切相关,与季节关系不明显,但由于本研究仅对春、秋季中一个大潮到小潮变化过程进行观测,季节与互花米草入侵对短叶茳芏湿地N2O通量的影响的确切关系仍需进一步观测来证实.
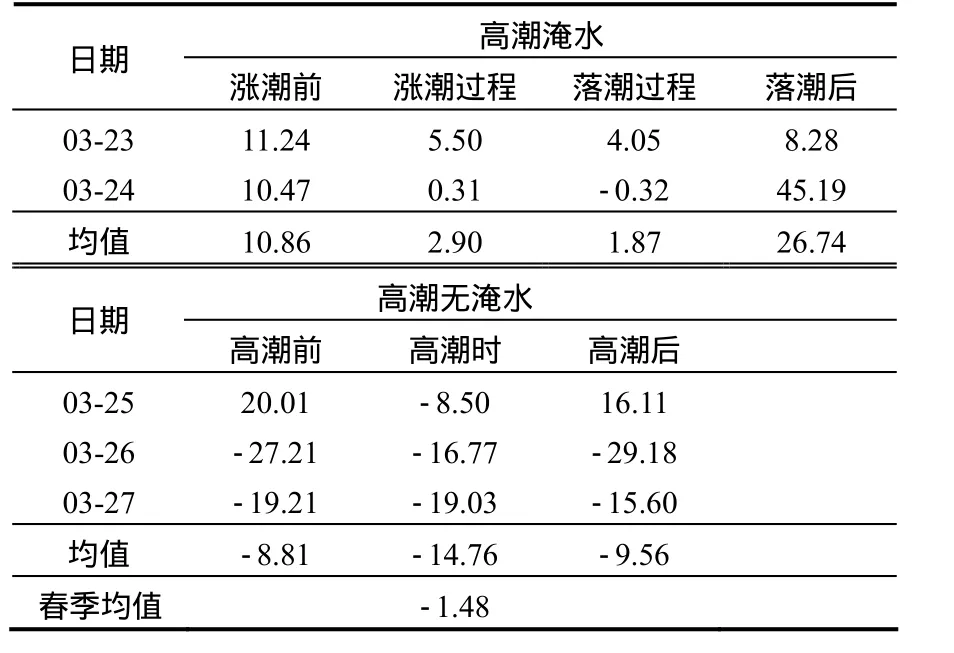
表3 短叶茳芏湿地春季N2O通量[μg/(m2·h)]Table 3 Flux from C.malaccensis wetland in spring[μg/(m2·h)]
2.2 养分输入后短叶茳芏湿地N2O通量的变化特征
秋季,养分输入后,观测期内短叶茳芏湿地N2O排放平均值为163.72μg/(m2·h),高于对照约5倍(图4a);春季,养分输入后,观测期内高潮淹水时和高潮无淹水时,短叶茳芏湿地N2O排放平均值分别为 227.62μg/(m2·h)和 1178.64μg/(m2·h),远高于对照的 18.0 和-9.18μg/(m2·h)(图 4b).从输入养分后N2O通量变化看,高潮淹水时,养分输入后马上观测,短叶茳芏湿地 N2O通量明显高于对照,在秋季,排放峰值出现在施入当天落潮后,在春季,排放峰值出现在施入后第2d落潮后,而高潮无淹水时,养分输入后马上观测,N2O排放远高于对照,且随着时间的推移迅速上升,养分输入后第1d午后N2O排放迅速增加,第2d上午有所下降,午后再次上升,并达到观测期最大值.总体上,养分输入极显著增加了短叶茳芏湿地短期N2O排放(高潮淹水时,P<0.01;高潮无淹水时,P<0.01),高潮淹水时,N2O排放峰值出现较高潮无淹水时早,N2O排放通量远低于高潮无淹水时.
2.3 踩踏干扰对短叶茳芏湿地N2O排放影响
2.3.1 踩踏形成的裸露湿地N2O通量 由图5可知,在秋季,踩踏形成的裸露湿地,在涨潮前和落潮后,7个观测日中各有排放和吸收.涨潮前,10月2日的N2O通量最小[-28.8μg/(m2·h)],9月30日的最大[128.91μg/(m2·h)],平均通量为 27.25 μg/(m2·h),变异系数为 2.09.落潮后,10月 2日的N2O通量最小[-68.81μg/(m2·h)],9月30日的最大[62.86μg/(m2·h)],平均通量为 0.28μg/(m2·h),变异系数为 53.16,在秋季大潮到小潮白天观测的总平均通量为 14.06μg/(m2·h);在春季,五个观测日中踩踏而成的裸露湿地对N2O皆为吸收.高潮淹水时,涨潮前和落潮后,均成弱吸收状态,此时N2O平均通量为-4.43μg/(m2·h);高潮无淹水时,高潮前和高潮后N2O通量呈现无规律变化,3月25日高潮前N2O通量高于高潮后,而3月26日和3月27日高潮前低于高潮后,高潮无淹水时N2O平均通量为-32.87μg/(m2·h),在春季大潮到小潮白天观测的平均通量为-21.31μg/(m2·h).在春秋季,踩踏形成的裸露湿地 N2O总平均通量为-0.76μg/(m2·h).
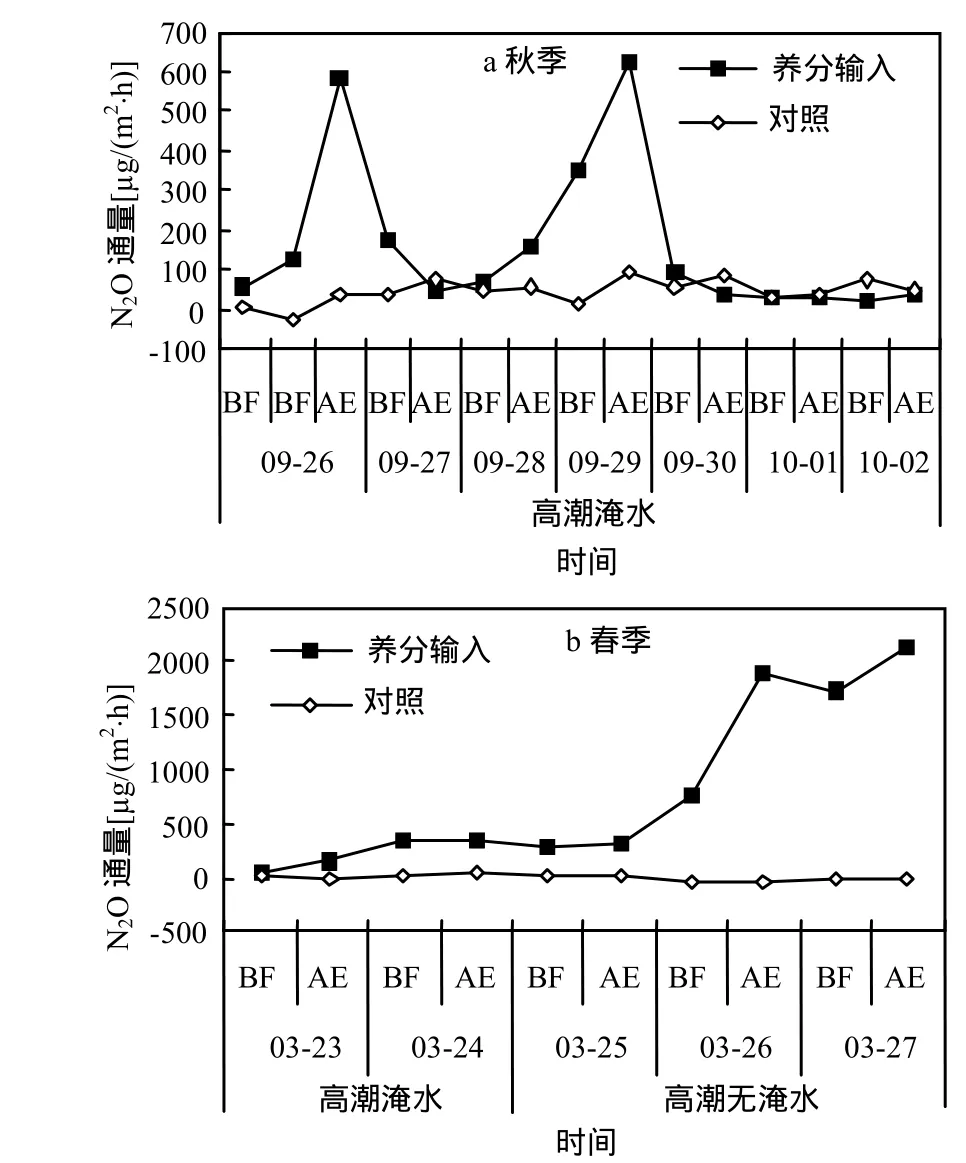
图4 输入养分的短叶茳芏湿地N2O排放Fig.4 N2O emission from C.malaccensis wetland after adding nutrient
总体上,闽江河口鳝鱼滩潮间带短叶茳芏湿地在踩踏干扰下,秋季的观测值高于春季,秋季一个大潮到小潮白天为N2O的弱源,春季为N2O的汇;高潮有潮水淹没时,踩踏形成的裸露湿地N2O通量高于无潮水淹没时.
2.3.2 踩踏干扰对短叶茳芏湿地N2O排放影响分析 方差分析表明,在秋季,观测期内踩踏形成的裸露湿地平均N2O通量低于短叶茳芏湿地,差异性显著(P<0.05)(图5a、表2).从不同潮汐阶段看,涨潮前,裸露湿地N2O通量低于短叶茳芏湿地,但差异性不显著(P>0.05),落潮后仍低于短叶茳芏湿地,差异性极显著(P<0.01);春季,观测期内裸露湿地 N2O平均通量显著低于短叶茳芏湿地(P<0.05)(图5b、表3),分别对高潮淹水和高潮无淹水的两类潮日分析得出:高潮淹水时,裸露湿地N2O 通量显著低于短叶茳芏湿地(P<0.05),高潮无淹水时,也低于短叶茳芏湿地,但差异性不显著(P>0.05).综合而言,踩踏降低短叶茳芏湿地 N2O通量,但是因植物的生长季节和潮汐环境的差异而影响程度不同.
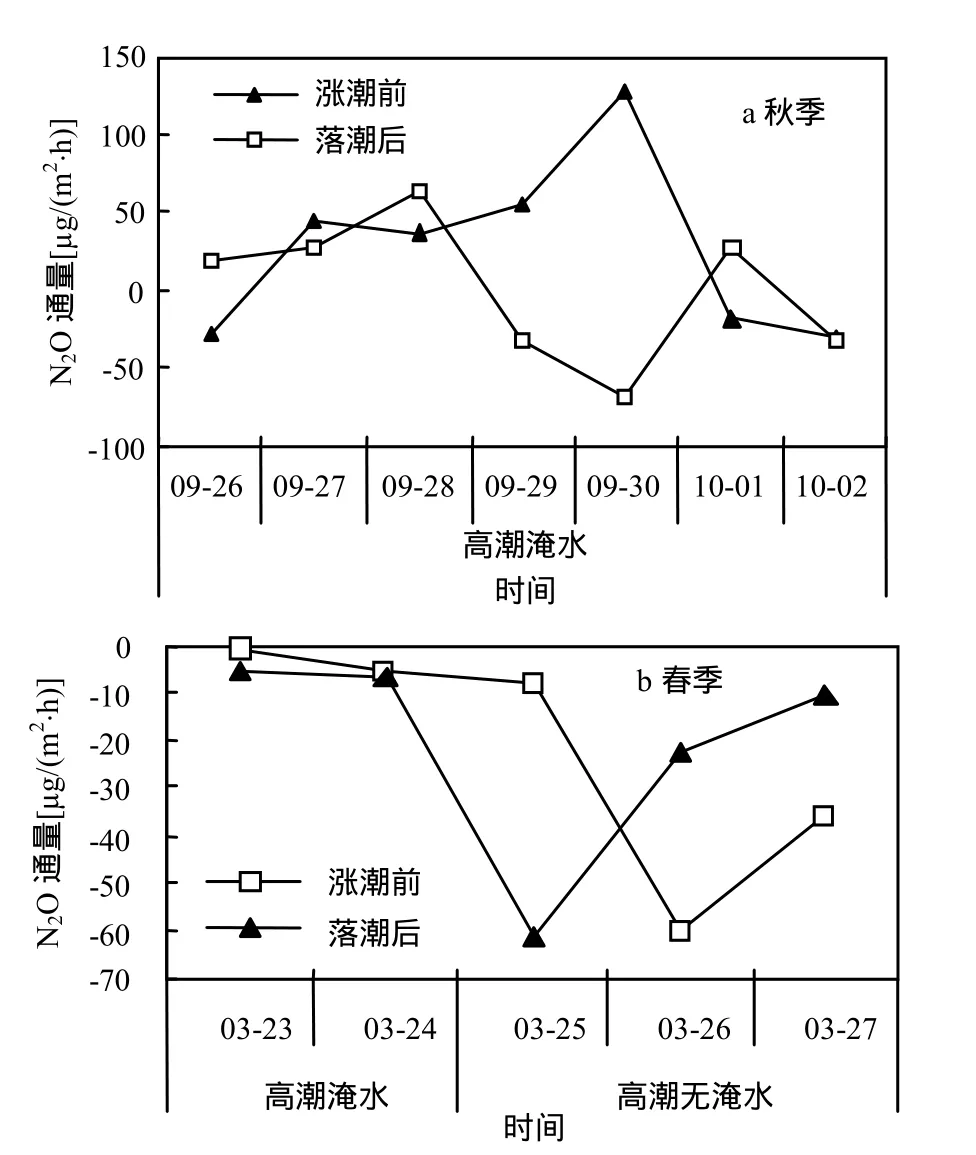
图5 裸露湿地N2O通量Fig.5 N2O flux from bare wetland
3 讨论
3.1 互花米草入侵对短叶茳芏湿地N2O通量的影响
在不同的环境及植物生长期条件下,互花米草入侵对短叶茳芏湿地 N2O通量的影响不同.9月末互花米草和短叶茳芏皆处于生长季,植株高度高,同时此月份闽江河口恰处大潮月,湿地每日皆受潮汐涨落而淹水排干交替.这一时期互花米草入侵导致N2O通量降低,可能是因为互花米草生物量远大于短叶茳芏[25],其生长需要更多的 N素,减少了硝化反硝化的 N 源.同时,互花米草斑块湿地pH(6.00)低于短叶茳芏湿地(6.11),也不利于 N2O的排放[26-28].3月末,互花米草处于分蘖期[29],而此时短叶茳芏刚刚进入生长期,植株的高度和密度远低于互花米草,因此,互花米草植株的N2O传输能力和产生能力皆高于后者[30-31],土壤微生物活性也可能高于后者[32].其次,淹水时潮水中及非淹水时的土壤水中,互花米草湿地还原态 N(铵态 N均值分别为 0.5975,0.3731mg/L)高于短叶茳芏湿地(均值分别为 0.2492,0.2933mg/L),而氧化态 N 离子(硝态氮和亚硝态氮均值分别为 0.9111,0.0661mg/L)低于短叶茳芏湿地(均值分别为 1.0553,0.2670mg/L),同时,土壤氧化还原电位也低于短叶茳芏湿地(均值分别为58.26,67.79mV)[33],这些环境条件导致 3月末互花米草湿地N2O通量高于短叶茳芏湿地.
3.2 养分输入对短叶茳芏湿地N2O通量的影响
本研究表明,养分输入极显著增加了短叶茳芏湿地短期N2O排放,这一结果与Serena等[34]在美国罗利河河口潮间带及张丽华等[35]在中国三江平源淡水沼泽湿地 N添加研究结果一致.对比高潮淹水时与高潮无淹水时养分添加后短叶茳芏湿地N2O排放情况,可以得出,潮水对养分输入增加短叶茳芏 N2O排放具有明显的削弱作用.形成以上规律的原因可能是:首先,河口湿地是N、P受限的生境[36],N2O的产生受到N源量的限制,养分输入使土壤中硝化或反硝化过程获得充足的N源,为 N2O 的产生创造根本条件[37].同时适当的N/P比适合植物的吸收,且可能激发土壤微生物的活性,使硝化和反硝化速率提高.其次,在高潮有潮水淹没时,由于潮水的涨落,使养分快速进入土壤参与反应,所以在养分输入当天退潮后 N2O排放达到最大值,每次潮汐过程潮水带走一部养分,使得在随后几天观测中 N2O通量迅速下降并回到对照水平.而高潮无潮水淹没时,养分输入后,没有潮水的稀释削减作用,有效N源多,加之在土壤温度(图6)等环境因子的综合影响下,N2O通量呈波动上升的趋势.可见,养分输入明显增加了N2O排放,可以认为河水富营养化会在一定程度上增加N2O 排放,加强水质管理,防治水体富营养化,具有重要环境意义.本研究仅对养分输入对河口潮间带环境下短叶茳芏湿地 N2O通量短期影响作了探讨,长期影响是否与人工湿地[35]和淡水沼泽湿地[38]影响相同,需进一步研究.
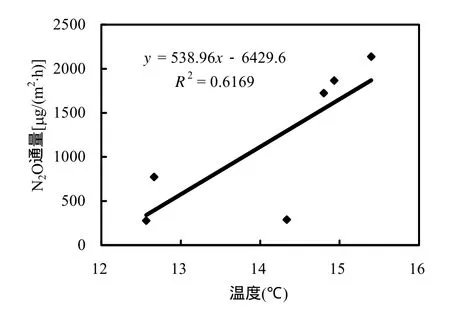
图6 高潮无淹水时温度与N2O通量关系Fig.6 Relation between temperature and N2O flux at exposed in high tide date
3.3 踏踩干扰对短叶茳芏湿地N2O通量的影响
N2O产生主要源于湿地土壤的硝化、反硝化作用[39],踏踩干扰造成短叶茳芏湿地硝化、反硝化作用的环境发生变化[40],从而改变了短叶茳芏湿地N2O排放的规律.本研究结果表明,踏踩降低了短叶茳芏湿地N2O排放,其原因可能有以下几个方面:植物对生长环境具有改造作用,植物根系对土壤中N等营养元素除具有吸收,同时通过分泌各物质,形成特定理化性质和微生物过程,营造稳定的土壤环境[41-42],而当踩踏致使植物消失后,这一稳定环境遭到破坏,营养元素含量和性质在潮水涨落影响下波动较大,从而导致N2O排放波动也较大,这一现象在植物生长季表现尤其明显(秋季裸露湿地N2O排放变异系数为3.67,短叶茳芏湿地为 0.45),而在高潮无潮水淹没时期,则无明显差别.踩踏造成短叶茳芏湿地土壤的理化性质发生变化.踩踏干扰形成的裸露湿地电导率(4.25mS/cm)低于短叶茳芏湿地(3.14mS/cm),氧化还原电位(44.33mV)略低于短叶茳芏湿地(52.65mV),而 pH 值(6.34)高于短叶茳芏湿地(6.05),这些理化性质的变化减少了 N2O排放[26-28],此外,湿地因踩踏而压实也可导致 N2O排放减少[43].踩踏导致地表植株死亡分解,而植物体消失切断了土壤中产生的N2O向大气中传输的重要通道[44],也可导致 N2O 通量降低.高潮淹水时,裸露湿地N2O通量高于无淹水时,可能因为淹水时,潮水带来大量的养分,为硝化反硝化提供较多的 N 源,而无淹水缺少来源,所以,无淹水时总是处于 N2O 的吸收状态.此外,观测发现,裸露湿地有大量的螃蟹和其他动物的洞穴,而有植被湿地的洞穴数量较少,已有研究表明,滨海生态系统中,大型动物打的洞穴的穴壁促进 N2O排放[45],而闽江河口湿地生态系统,动物洞穴是否促进N2O排放,有待进一步研究.
4 结论
4.1 观测期内,互花米草入侵斑块湿地 N2O 通量,均值为 15.37μg/(m2·h),低于短叶茳芏湿地的18.77μg/(m2·h).秋季,互花米草入侵斑块湿地平均N2O通量极显著低于短叶茳芏湿地;春季,互花米草入侵斑块湿地N2O平均通量极显著高于短叶茳芏湿地,春季高潮淹水时,互花米草入侵斑块湿地N2O通量低于短叶茳芏湿地,但不显著,高潮无淹水时,互花米草入侵斑块湿地N2O通量极显著高于短叶茳芏湿地.
4.2 养分输入极显著增加了短叶茳芏湿地 N2O通量.秋季,输入养分的短叶茳芏湿地N2O通量平均值为 163.72μg/(m2·h),春季,高潮淹水时和高潮无淹水时,分别为 227.62μg/(m2·h)和 1178.64μg/(m2·h),高潮淹水时,N2O 排放峰值出现较高潮无淹水时早,N2O排放通量远低于高潮无淹水时.
4.3 踩踏形成的裸露湿地 N2O平均通量为-0.76μg/(m2·h),踩踏降低了短叶茳芏湿地N2O通量,秋季和春季高潮淹水时,降低幅度显著,春季高潮无淹水时降低幅度不显著.
4.4 潮汐在不同种干扰方式对短叶茳芏湿地N2O通量影响程度中起重要作用.
[1]赵 媛.论能源开发利用对全球性环境问题的影响 [J].世界地理研究, 2000,9(4):89-94.
[2]IPCC.Climate Change 2007: Synthesis report [R].Cambridge:Cambridge University Press, 2007.
[3]Doody J P.‘Coastal squeeze’ – an historical perspective [J].Journal of Coastal Conservation, 2004,10:129-138.
[4]Wrage, N G L.Velthof, M.L van Beusichem.Role of nitrifier denitrification in the production of nitrous oxide [J].Soil Biology and Biochemistry, 2001,33(12/13):1723-1732.
[5]Firestone M K, Davidson E A.Microbiological basis of NO and NO2production and consumption in soil [C]//Exchange of trace gases between terrestrial ecosystems and the atmosphere.Chichester, England: John Wiley and Sons, 1989:7-21.
[6]Williams E J.Hurchinson G L.Fehsefeld F C NOx and N2O emissions from soil [J].Global Biogeochem Cycles, 1992,6(4):351-388.
[7]Nedwell D B, Jickells T D, Trimmer M, et al.Nutrients in estuaries [J].Advances in Ecological Research, 1999,29:43-92.
[8]胡正华,张 寒,陈书涛,等.氮沉降对林带土壤N2O和CH4通量的影响 [J].中国环境科学, 2011,31(6):892-897.
[9]Sybil S P, Carolien K, Renée S V.Globaldistribution of N2O emissions from aquatic systems: naturalemissions and anthropogenic effects [J].Chemosphere-Global Change Science,2000,2(3/4):267-279.
[10]Liikanen A, Silvennoinen H, Karvo A, et al.Methane and nitrous oxide fluxes in two coastal wetlands in the northeastern Gulf of Bothnia, Baltic Sea [J].Boreal Environment Research,14:351-368.
[11]王东启,陈振楼,王 军,等.夏季长江河口潮间带反硝化作用和N2O的排放与吸收 [J].地球化学, 2006,35(3):271-279.
[12]Zedler J B, Kercher S.Causes and consequences of invasive plants in wetlands: opportunities, opportunists, and outcomes [J].Critical Reviews in Plant Sciences, 2004,23(5):431-452.
[13]钦 佩.海滨湿地生态系统的热点研究 [J].湿地科学与管理,2006,2(1):7-11.
[14]孙志高,牟晓杰,王玲玲.滨海湿地生态系统 N2O 排放研究进展[J].海洋环境科学, 2010,29(1):159-164.
[15]杨 晶,张桂玲,赵玉川,等.胶州湾河口潮滩沉积物中 N2O的产生和释放及其影响因素 [J].环境科学学报, 2011,31(12):2723-2732.
[16]王玲玲,孙志高,牟晓杰,等.黄河口滨岸潮滩湿地 CO2、CH4和N2O通量特征初步研究 [J].草业学报, 2011,20(3):51-61.
[17]李 勇,刘 敏,陆 敏, 等.崇明东滩芦苇湿地氧化亚氮排放[J].环境科学学报, 2010,30(12):2526-2534.
[18]徐继荣,王友绍,殷建平,等.珠江口入海河段 DIN形态转化与硝化和反硝化作用 [J].环境科学学报, 2005,25(5):686-692.
[19]曹宇峰.2002~2006年福建省闽江口以南近岸海域水质状况评价 [J].海洋环境科学, 2009,28(增1):39-42.
[20]刘剑秋,曾从盛,陈 宁.闽江河口湿地研究 [M].北京:科学出版社, 2006.
[21]李 斌.福建省地表径流N、P流失系数的测算 [J].武夷科学,2009,25(12):58-63.
[22]郑小宏.闽江口海域氮磷营养盐含量的变化及富营养化特征[J].台湾海峡,29(1):42-46.
[23]遆超普,颜晓元.基于氮排放数据的中国大陆大气氮素湿沉降量估算 [J].农业环境科学学报, 2010,29(8):1606-1611.
[24]氮肥和磷肥对稻田 N2O排放的影响 [J].中国环境科学,2005,25(5):540-543.
[25]王维奇,徐玲玲,曾从盛,等.闽江河口湿地互花米草入侵机制[J].自然资源学报, 2011,26(11):1900-1907.
[26]Weier K L, Gilliam J W.Effect of acidity on nitrogen mineralization and nitrif i cation in Atlantic Coastal Plain soils [J].Soil Science Society of America Journal, 1986,50(5):1210-1214.
[27]Bandibas J, Vermoesen A, Degroot C J, et al.The effect of different moisture regimes and soil characteristics on nitrous oxide emission and consumption by different soils [J].Soil Science, 1994,158(2):106-114.
[28]Godde M, Conrad R.Inf l uence of soil properties on the turnover of nitric oxide and nitrous oxide by nitrif i cation and denitrif i cation at constant temperature and moisture [J].Biology and Fertility of Soils, 2000,32(2):120-128.
[29]张林海.闽江河口湿地优势植物净初级生产力及N、P养分动态[D].福州:福建师范大学, 2008:21-34.
[30]李玥莹,陈冠雄,徐 慧,等.苗期玉米、大豆在土壤-植物系统N2O排放中的贡献 [J].环境科学, 2003,24(6):38-42.
[31]陈冠雄,徐 慧,张 颖,等.植物—大气 N2O 的一个潜在排放源[J].第四纪研究, 2003,23(5):504-511.
[32]胡亚林,汪思龙,颜绍馗.影响土壤微生物活性与群落结构因素研究进展 [J].土壤通报, 37(1):170-176.
[33]封 克,殷士学.影响氧化亚氮形成与排放的土壤因素 [J].土壤学进展, 1995,23(6):35-41.
[34]Moseman-Valtierra S, Gonzalez R, Kroeger K D, et al.Short-term nitrogen additions can shift a coastal wetland from a sink to a source of N2O [J].Atmospheric Environment, 2011,45(26):4390-4397.
[35]张丽华,宋长春,王德宣,等.外源氮对沼泽湿地CH4和N2O通量的影响 [J].生态学报, 2007,27(4):1442-1449.
[36]Turunen J, Tahvanainen A, Tolonen K, et al.Carbon accumulation in West Siberian Mires, Russia Sphagnum peatland distribution in North America and Eurasia during the past 21,000 years [J].Global Biogeochemical Cycles, 2001,15(2):285-296.
[37]Hou A X, Chen G X.Effect of different nitrogen fertilizers on N2O emission from soil [J].Chinese Journal of Applied Ecology,1998,9(2):176-180.
[38]Hannu Nykänen, Harri Vasander, Jari T, Huttunen, et al.Effect of experimental nitrogen load on methane and nitrous oxide fl uxes on ombrotrophic boreal peatland [J].Plant and Soil, 2002,242:147-155.
[39]刘秀红,杨 庆,吴昌永,等.不同污水生物脱氮工艺中 N2O释放量及影响因素 [J].环境科学学报, 2006,26(12):1940-1947.
[40]张永勋,曾从盛,王维奇.天然湿地 N2O 产生机理及排放异质性研究进展 [J].亚热带水土保持, 2011,23(4):50-57.
[41]旷远文,温达志,钟传文,等.根系分泌物及其在植物修复中的作用 [J].植物生态学报, 27(5):709-717.
[42]弋良朋,张 辉.滨海4种盐生植物根际土壤酶活性特征与主要养分的关系 [J].生态环境学报, 2011,20(2):270-275.
[43]Russer R, Flessa H, Schilling R, et al.Soil compaction and fertilization effects on nitrous oxide and methane fluxes in potato fields [J].Soil Science Society of America Journal, 1997,62(6):1587-1595.
[44]Yu K W, Wang Z P, Chen G X.Nitrous oxide and methane transport through rice plants [J].Biology and Fertility of Soils,1997,24(3):341-343.
[45]Blackburn T H, Henriksen K.Nitrogen cycling in different types of sediments from Danish waters [J].Limnology and Oceanography, 1983,28(3):477-493.
