乳酸乳球菌肽聚糖锚钩蛋白原核表达载体的构建与表达
2013-08-02李鹏成乔绪稳郑其升侯继波
李鹏成, 孙 冰, 乔绪稳, 郑其升, 侯继波
(江苏省农业科学院,国家兽用生物制品工程技术研究中心,江苏 南京 210014)
乳球菌外壳-蛋白锚定系统是一种新型的疫苗 载运系统。乳球菌外壳实际上是经过热酸处理后得到的球形肽聚糖基质(Gram-positive enhancer matrix,GEM),表面通过一种肽聚糖锚钩蛋白(Protein anchor,PA)实现装载抗原蛋白,可用于多种(细菌、寄生虫、病毒)抗原递送[1-3]。该系统由食品级遗传元件组成,生物安全性好,此外,不需要抗原纯化,可极大降低制造成本,现已成为生物制品等领域的研究热点,应用前景广阔。
肽聚糖锚钩蛋白PA来自乳酸乳球菌主要自溶素AcmA的C-端[4]。AcmA是乳酸乳球菌的一种主要肽聚糖水解酶,主要与细胞分离和稳定期细胞消融有关,参与细胞分裂和稳定期时的菌体自溶过程[5]。AcmA一般由1个具有催化活性的N-末端结构域和1个具细胞壁锚定活性的C-末端结构域(cA结构域)组成。天然的cA结构域包含3个被异源性序列间隔开的LysM(Lysin motif),每个LysM由45个氨基酸残基组成,且高度同源,也被称为重复序列(Repeats)。研究发现,乳酸乳球菌AcmA突变菌株中2个LysM同样具有锚定活性[6]。
目前,肽聚糖锚钩蛋白PA大肠杆菌原核表达相关研究国内外尚未见报道。因此,本试验拟以锚钩蛋白PA为研究对象,分别设计2个与3个LysMs,应用PCR技术扩增得到乳酸乳球菌LysMs基因片段;然后构建pET-32a(+)-2(3)LysMs原核表达载体,将其转化大肠杆菌BL-21(DE3),进行诱导表达,最后进行融合蛋白的纯化及锚定活性鉴定。为今后该蛋白多克隆抗体制备及与目的抗原的融合表达等相关研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与载体 乳酸乳球菌MG1363,购自中国微生物菌种保藏管理委员会普通微生物中心;大肠杆菌工程菌DH5α、BL21(DE3)均为国家兽用生物制品工程技术研究中心实验室保存,pET32a(+)原核表达载体也为该实验室保存。
1.1.2 工具酶及主要试剂 反转录酶、随机引物与d(T)引物;限制性内切酶 Xho I、EcoR I及其反应缓冲液;PCR反应所需的Ex Taq酶、R Taq酶、dNTP、Ex Taq buffer、PCR buffer、镁 离 子;pMD18-T载体,T载体连接Buffer;DNA连接酶,DNA连接Buffer;Mini BEST胶回收试剂盒;琼脂糖凝胶电泳与SDS-PAGE凝胶电泳Marker与buffer均购自大连TaKaRa公司,其他试剂均为国产分析纯。GM17培养基与LB培养基均由本实验室自行配制。
1.2 方法
1.2.1 LysMs基因的扩增 提取乳酸乳球菌MG1363细菌总RNA,然后应用随机引物与d(T)引物反转录获得cDNA,最后应用PCR方法扩增获取目的基因。
引物设计:根据GenBank数据库中乳酸乳球菌MG1363的AcmA及质粒pET32a(+)的载体序列,设计特异性PCR引物,引物由上海英骏生物技术有限公司合成。设计引物如下,2LysMs序列上游引物:5'-CCGGAATTCACTACTTATACCGTCAA ATC-3';下游引物:5'-CCGCTCGAGCTATGAAACAATAAGATTTTGA-3'。3LysMs序列上游引物:5'-CCGGAATTCACTACTTATACCGTCAAATC-3';下游引物:5'-CCGCTCGAGTTATTTTATTCGTAGA TACTGAC-3'(下划线为限制性酶切位点)。
以上扩增的目的基因上游引物加入的酶切位点均为EcoR I,下游引物加入的酶切位点均为Xho I。PCR反应条件为:95℃预变性5 min;94℃变性30 s,48℃退火30 s,72 ℃延伸90 s,共30个循环;72℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳,用UVP凝胶成像系统分析。
1.2.2 LysMs基因的克隆 参考分子克隆的方法将PCR回收产物与pMD18-T载体以适当比例混合,加入连接酶I(Solution I)于16℃反应2 h,转化连接产物至DH5α感受态细胞中,均匀涂布于含相应抗生素(100 μg/ml)的LB平板,37℃培养过夜。挑取白色单菌落扩大培养后,用SDS碱裂解法小量提取质粒[pMD18-T-2(3)LysMs]。经Xho I和EcoR I限制性双酶切鉴定,初步鉴定为阳性的克隆送上海英骏生物技术有限公司进行测序鉴定。
1.2.3 原核表达载体的构建及表达菌株的获得 用Xho I和EcoR I分别双酶切经鉴定正确的pMD18-T-2(3)LysMs重组质粒和 pET-32a(+)表达载体,回收目的基因和载体片段,加入 T4 DNA连接酶,16℃水浴连接过夜,构建重组质粒pET-32a(+)-2LysMs与 pET-32a(+)-3LysMs,将连接产物转入BL21(DE3)感受态细胞中,并涂布于含氨苄(100 μg/ml)的 LB平板,37℃过夜培养。挑取白色单菌落扩大培养后,用SDS碱裂解法小量提取质粒,经双酶切鉴定正确,即获得阳性表达菌株。
1.2.4 重组质粒在大肠杆菌中的诱导表达 将含有pET-32a(+)-2LysMs与pET-32a(+)-3LysMs重组质粒的BL21表达宿主菌,37℃培养过夜后,取此培养物按1%体积比接种于加入氨苄的LB培养基中,37℃振摇培养。培养2~3 h,OD600为0.5时,加入终浓度为1 mmol/L的IPTG,37℃继续振摇培养,分别于诱导后 0 h、1 h、2 h、3 h、4 h、5 h、6 h 各取 1 ml菌液;同时用未插入目的基因的pET32a质粒转化BL21大肠杆菌,获得空载体对照菌。将取样菌液处理后,12%SDS-PAGE电泳分析。
1.2.5 融合蛋白表达形式鉴定 取方法1.2.4中确定最佳诱导时间诱导的重组表达菌10 ml,离心收集菌体,将1/10菌液体积的PBS重悬沉淀,冰浴下超声波破碎菌体,离心收集上清和沉淀,经12%SDS-PAGE分析,观察蛋白质的分布情况。
1.2.6 融合蛋白的纯化与复性 试验发现目的蛋白主要出现于沉淀部分,提示目的蛋白以不溶性包涵体形式存在。沉淀加入洗涤液Ⅰ(1 mol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L EDTA,0.5%Triton-100)室温作用20 min,12 000 r/min离心 10 min,弃上清,再加入洗涤液Ⅱ(1 mol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L EDTA,3 mol/L尿素,0.5%Triton-100)室温作用20 min,12 000 r/min离心10 min。洗涤后的包涵体用变性液(1 mol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L EDTA,6 mol/L盐酸胍,5%甘油,5 mmol/L DTT)溶解,12 000 r/min离心10 min取上清。
融合蛋白的复性采用透析复性法。以变性液稀释上清,使蛋白质终浓度≤100 μg/ml,将稀释液转移到透析袋中,依次在含有 4 mol/L、2 mol/L、1 mol/L、0 mol/L盐酸胍的复性缓冲液(20 mmol/L Tris-Cl,500mmol/L NaCl,1mmol/L GSH,0.1 mmol/L GSSG,pH 8.0)中透析复性24 h,并加入0.5 mol/L L-精氨酸。最后在PBS缓冲液中透析2次,每次4 h。经聚乙二醇(PEG20000)浓缩至适当体积,4℃、12 000 r/min离心10 min后,取上清,进行SDS-PAGE电泳分析。
1.2.7 GEM颗粒的制备 乳酸乳球菌MG1363在新鲜GM17培养基中30℃振荡培养过夜,6 000 r/min下离心5 min,收集菌体,灭菌纯水洗涤1次,然后用1/5体积0.1 mol/L的HCl重悬,煮沸30 min,PBS洗涤 3次,计数,以 2.5×109为 1 U,-80℃保存备用。
1.2.8 融合蛋白与GEM颗粒的结合及鉴定 将500 μl(1 mg/ml)复性的目的蛋白与1 U GEM颗粒室温孵育30 min,6 000 r/min下离心5 min,收集沉淀。PBS洗涤3次,经Western-blot鉴定其结合效果。Western-blot试验步骤:取收集的沉淀用适量PBS重悬后12%SDS-PAGE电泳,然后将蛋白转移至PVDF膜上;5%脱脂乳室温封闭1 h,加鼠His单克隆抗体(1∶10 000),4℃过夜;TBST洗膜3次,每次10 min,再加HRP标记的山羊抗鼠IgG(1∶10 000),膜室温孵育2 h,TBST洗膜3次,每次10 min,最后应用DAB显示蛋白质条带。
2 结果
2.1 PCR 扩增
GM1363菌体总RNA进行RT-PCR反应后,产物经1%琼脂糖凝胶电泳,获得2LysMs特异性条带,大小为363 bp(图1A);获得3LysMs特异性条带,大小为585 bp(图1B)。回收片段经公司测序,与GenBank数据库比对,序列结果完全一致。

图1 LysMs基因的PCR扩增Fig.1 PCR amplification of the LysMs gene
2.2 重组表达质粒鉴定
重组表达质粒pET-32a(+)-2LysMs与pET-32a(+)-3LysMs经Xho I和EcoR I分别限制性双酶切,结果如图2所示,其中约5 900 bp为酶切载体大小,363 bp与585 bp为DNA目的片段大小。

图2 pET32a(+)-LysMs阳性质粒酶切鉴定Fig.2 Identifications of recombinant plasmid pET32a(+)-LysMs by enzyme digestion
2.3 融合蛋白的诱导表达
如图3所示,含有 pET-32a(+)-2LysMs、pET-32a(+)-3LysMs与 pET-32a(+)的 BL21菌体经IPTG诱导后收集菌体,经12%SDS-PAGE电泳分析,诱导的pET-32a(+)菌体有一处不同于未转入质粒的细菌的特异性条带,即载体蛋白质的大小约为20 000。含有pET-32a(+)-2LysMs的菌体表达32 000大小的特异性条带,即肽聚糖锚钩融合蛋白。表明含有2个LysMs的肽聚糖锚钩蛋白相对分子量约为12 000。从IPTG不同诱导时间发现,pET-32a(+)-2LysMs菌体表达的融合蛋白表达量在1~2 h达到最大值,之后目的蛋白量逐渐减少。含有pET-32a(+)-3LysMs的菌体经同样方法诱导后未见融合蛋白表达。本试验独立重复3次,结果一致。
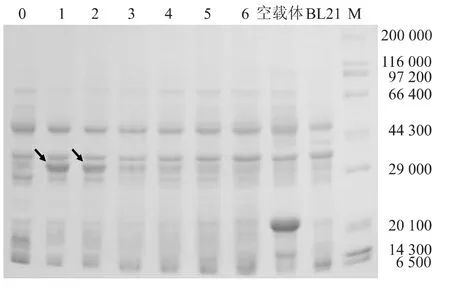
图3 重组pET-32a(+)-2LysMs表达产物的SDS-PAGE结果Fig.3 SDS-PAGE of recombinant pET-32a(+)-2LysMs expressed in E.coli
2.4 融合蛋白表达形式
将含有pET-32a(+)-2LysMs菌体IPTG诱导后收集菌体超声破碎后,分别收集上清和沉淀,SDSPAGE分析,可见沉淀中有明显的融合蛋白特异性条带,而上清中无特异性条带(图4),表明融合蛋白主要以包涵体形式表达。
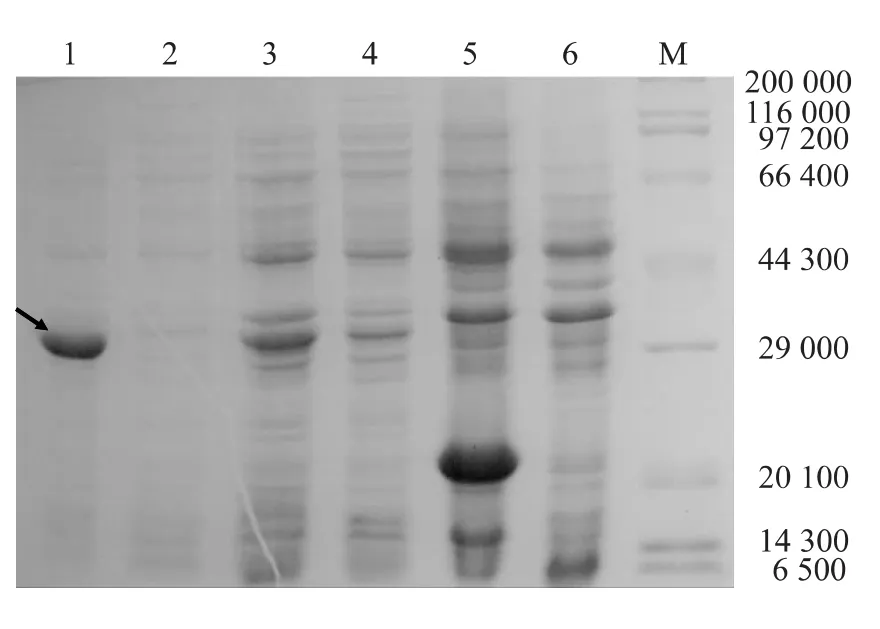
图4 pET-32a(+)-2LysMs原核表达产物的分布Fig.4 Prokaryotically expressed protein of pET-32a(+)-2LysMs in E.coli
2.5 融合蛋白的复性及锚定活性鉴定
融合蛋白经盐酸胍复性,12%SDS-PAGE分析得到较纯的PA融合蛋白(图5)。经Western blot鉴定,复性后的PA融合蛋白可与GEM颗粒结合,表明该蛋白质具有良好的锚定活性(图6)。
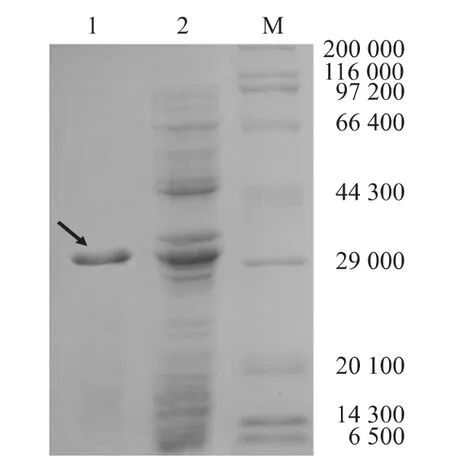
图5 pET-32a(+)-2LysMs原核表达产物的纯化Fig.5 Purification of prokaryotically expressed protein of pET-32a(+)-2LysMs in E.coli

图6 融合蛋白与GEM颗粒结合Western blot鉴定Fig.6 The anchoring between the fusion protein and GEM(gram-positive enhancer matrix)identified by Western blot
3 讨论
目前,已报道的用于表达PA融合蛋白的宿主菌只有乳酸乳球菌一种[3,6-8]。肽聚糖锚钩蛋白PA来自乳酸乳球菌自溶素AcmA的C-端结构域,该结构域的3个LysMs序列重复单元之间的间隔序列,是由丰富的丝氨酸、苏氨酸与天冬氨酸组成[9]。研究发现,乳酸乳酸菌细胞中的蛋白酶HtrA可以对这些间隔氨基酸进行剪切从而降解AcmA的C-端结构域。此外,AcmA缺失乳球菌可使细菌形成长链,增加宿主菌PA的表达量[3]。因此,国外构建的表达PA宿主菌大都为HtrA与AcmA双缺失的乳酸乳球菌[3,6-8]。应用自身宿主菌表达 PA蛋白可确保PA具有更高的锚定活性。然而,由于乳酸乳球菌属于革兰氏阳性菌,外源基因的转化表达较难,其次蛋白表达产量也较低。因此,基因操作技术更为成熟的大肠杆菌表达系统能否表达PA融合蛋白,成为本试验提出的新命题。
本试验中分别构建了pET-32a(+)-2LysMs与pET-32a(+)-3LysMs原核表达载体,但研究发现仅有pET-32a(+)-2LysMs表达载体在表达宿主菌BL-21大肠杆菌中得到表达,而pET-32a(+)-3LysMs重组质粒宿主菌经各种条件优化诱导,也未能表达目的蛋白。乳酸乳球菌HtrA缺失株作为宿主菌,可以防止宿主HtrA对PA的剪切,确保正常分泌;而大肠杆菌体内可能存在HtrA相似的酶类,可剪切间隔序列中的氨基酸,致使3个LysMs重复结构域的目的蛋白被降解而得不到表达。此外,通常原核表达形成包涵体形式的目的蛋白,在5 h内表达量都很高。而本试验中pET-32a(+)-2LysMs重组质粒转化宿主菌诱导后,目的蛋白的表达量在1~2 h时最多,之后逐渐减少,这是否与间隔序列被逐渐破坏,目的蛋白不断被降解有关尚未可知。2个LysMs重复序列表达出的目的蛋白肽链较短,比3个LysMs序列少了一个间隔序列,为什么该目的蛋白没有被完全降解?这些问题都有待进一步研究。
对融合蛋白的表达形式分析后,结果表明,所表达的PA融合蛋白主要以不溶性的包涵体形式存在。经变性复性后的PA蛋白可与GEM颗粒相结合,表明大肠杆菌原核表达获得的PA融合蛋白同样具有肽聚糖锚定活性。包涵体形式便于表达产物的纯化,本研究也获得了较纯的PA融合蛋白。包涵体的缺点是需要超声破碎菌体,再经裂解、洗涤、变性、复性等复杂处理才可得到可溶性蛋白[10-11]。
本研究成功构建了 pET-32a(+)-2LysMs与pET-32a(+)-3LysMs原核表达载体,诱导大肠杆菌获得了较纯的含有2个LysMs的、具有良好锚定活性的PA融合蛋白质,为今后PA蛋白多克隆抗体制备及与目的抗原的融合表达等相关研究奠定了基础。
[1]AUDOUY S A,VAN SELM S,VAN ROOSMALEN M L,et al.Development of lactococcal GEM-based pneumococcal vaccines[J].Vaccine,2007,25(13):2497-2506.
[2]BUIST G,STEEN A,KOK J,et al.LysM,a widely distributed protein motif for binding to(peptido)glycans[J].Mol Microbiol,2008,68(4):838-847.
[3]VAN ROOSMALEN M L,KANNINGA R,EL KHATTABI M,et al.Mucosal vaccine delivery of antigens tightly bound to an adjuvant particle made from food-grade bacteria[J].Methods,2006,38(2):144-149.
[4]OKANO K,ZHANG Q,KIMURA S,et al.System using tandem repeats of the cA peptidoglycan-binding domain from Lactococcus lactis for display of both N-and C-terminal fusions on cell surfaces of lactic acid bacteria[J].Appl Environ Microbiol,2008,74(4):1117-1123.
[5]BUIST G,KARSENS H,NAUTA A,et al.Autolysis of Lactococcus lactis caused by induced overproduction of its major autolysin,AcmA[J].Appl Environ Microbiol,1997,63(7):2722-2728.
[6]BOSMA T,KANNINGA R,NEEF J,et al.Novel surface display system for proteins on non-genetically modified gram-positive bacteria[J].Appl Environ Microbiol,2006,72(1):880-889.
[7]RAMASAMY R,YASAWARDENA S,ZOMER A,et al.Immunogenicity of a malaria parasite antigen displayed by Lactococcus lactis in oral immunisations[J].Vaccine,2006,24(18):3900-3908.
[8]HU S,KONG J,KONG W,et al.Characterization of a novel LysM domain from Lactobacillus fermentum bacteriophage endolysin and its use as an anchor to display heterologous proteins on the surfaces of lactic acid bacteria[J].Appl Environ Microbiol,2010,76(8):2410-2418.
[9]STEEN A,BUIST G,HORSBURGH G J,et al.AcmA of Lactococcus lactis is an N-acetylglucosaminidase with an optimal number of LysM domains for proper functioning[J].FEBS J,2005,272(11):2854-2868.
[10]TSUMOTO K,EJIMA D,KUMAGAI I,et al.Practical considerations in refolding proteins from inclusion bodies[J].Protein Expr Purif,2003,28(1):1-8.
[11]CLARK E D.Protein refolding for industrial processes[J].Curr Opin Biotechnol,2001,12(2):202-207.
