外加营养源作用下砖红壤中五氯酚还原转化的 生物化学作用机制
2013-07-29陈曼佳刘承帅吴伟坚童辉李芳柏
陈曼佳,刘承帅,吴伟坚,童辉,李芳柏*
1. 中国科学院广州地球化学研究所,广东 广州 510640;
2. 广东省农业环境综合治理重点实验室,广东省生态环境与土壤研究所,广东 广州 510650;3. 中国科学院大学,北京 100039
五氯酚(pentachlorophenol,PCP)是自然界中普遍存在的高毒、难降解的持久性有机氯污染物,在过去的30年中,五氯酚被广泛应用于杀虫、杀菌、防腐等生产生活领域[1-2]。PCP的大规模使用已经造成了湿地、水体、土壤等大范围的污染,并威胁到人类的健康[3-5]。
氯酚在缺氧土壤环境中经历着缓慢的自然还原转化过程[6-7],包括非生物和生物转化过程。氯酚在土壤中的非生物转化通常是由各种潜在氧化还原剂引起,尤其是含低价态铁及其铁氧化物等自然矿物界面[6]。微生物在土壤地球化学过程中扮演着极其重要的角色。早在1986年,Valo和Salkinoja-salonen报道了Rhodococcus chlorophenolicus对土壤中苯氧基苯酚和多氯苯氧基苯甲醚进行还原脱氯[8]。土壤中氯酚还原转化通常既发生生物转化,又同时伴随着非生物转化[9-10]。在厌氧土壤环境中,非生物和生物过程可能共同促进氯酚的还原转化过程。
在厌氧富铁红壤中,吸附态Fe(Ⅱ)被认为是PCP还原转化的活性物种[11-13]。但是,在土壤环境中的铁大部分是以含铁土壤矿物组成成分的形式存在,很难直接作用于PCP的还原转化。在厌氧条件下,土壤氧化铁能够通过还原性有机酸 [14-15]和异化铁还原微生物驱动等作用产生大量的土壤矿物吸附态Fe(Ⅱ)物种[16],从而促进土壤中有机氯污染物的还原转化。
玄武岩砖红壤是广东省热带地区代表性土壤,其铁氧化物和有机质的含量都较高[17],因此,玄武岩砖红壤中PCP具有活跃的环境地球化学过程,同时,其中的微生物群落结构也与PCP转化具有密切关系。但是,与之相关砖红壤中PCP转化的微生物作用过程机制,还需进一步研究。
因此,本研究以玄武岩发育的砖红壤为基质,在中性厌氧环境下,系统研究PCP还原转化过程及其微生物群落结构的变化,在此基础上深入探讨红壤体系对PCP的消减能力及反应机制,为促进土壤中有机氯污染物的还原转化提供理论依据。
1 材料与方法
1.1 供试土壤
供试土壤样品为玄武岩砖红壤,采自广东省雷州市唐家镇(20°51′N, 109°53′E),按多点采样的方式采集深度为0~15 cm的土壤,土壤样品在实验室自然风干后,去除动植物残体,过0.180 mm筛。供试土壤的理化性质经常规分析方法分析:土壤pH 4.79,有机质含量25.1 g/kg,总铁137.27 g/kg,络合态铁0.076 g/kg,无定形铁1.879 g/kg,游离态铁16.97 g/kg。
1.2 实验设计
实验设计见表1,反应体系为0.5 g土壤(干质量),PCP、哌嗪-1,4-双(2-乙烷磺酸)(PIPES)、乳酸和蒽醌-2,6-磺酸钠(AQDS)的初始浓度分别为0.019、30、10和0.2 mmol·L−1。通过PIPES缓冲溶液将pH值控制在7.0左右。反应体系在20.2 mL的西林瓶中进行,高纯氮气充气30 min排氧,然后用橡胶塞压紧并用铝盖密封。样品置厌氧培养箱中(30 ± 1)℃静置培养,每隔一定时间取样,测定样品中目标物、吸附态Fe(Ⅱ)、氧化还原电位、胞外电子传递数量以及微生物群落结构。每个样品设置3个重复,文中所示数据均为数据平均值。

表1 实验设计条件 Table 1 Experimental design
1.3 实验方法
反应体系样品中目标物PCP采用1:1 (V:V)乙醇水溶液进行提取后[18],高效液相色谱(HPLC)测定;吸附态Fe(Ⅱ)由0.5 mol·L−1盐酸提取[16],其浓度采用分光光度计测定,活性铁物种的氧化还原电位(Ep)采用循环伏安法(CV)与传统的三电极体系测试[19],胞外电子传递数量采用微生物燃料电池(MFC)的方法进行测定[19]。具体的测试方法及过程见参考文献[20]。土壤灭菌处理采用γ射线辐照灭菌(60Co源,辐照剂量为50 kGy)[21]。
1.4 微生物群落结构分析方法
1.4.1 土壤DNA提取
土壤DNA提取采用MO BIO公司的PowerSoilTMDNA试剂盒进行提取,具体步骤参照试剂盒说明书进行。
1.4.2 细菌16S rRNA片段的PCR扩增和纯化
采用通用引物扩增细菌16S rRNA。正向引物为27F(5′-AGAGTTTGATCMTGGCTCAG-3′),反向引物为1492R(5′-GGTTACCTTGTTACGACTT-3′),其中正向引物5′用6-羧基二乙酸荧光素(FAM)标记,用于末端限制性片段长度多态性分析(T-RFLP)实验。引物由上海生工生物工程股份有限公司合成标记。PCR的反应体系如下:总体积25 μL,其中Ex Taq DNA聚合酶(TAKARA)1 U,聚合酶缓冲溶液2.5 μL,dNTP Mix 2 μL,正反向引物各0.4 μmol·L−1,模板50 ng,补充无菌水至25 μL。PCR反应条件如下:94 ℃ 4 min,30个循环为:94 ℃ 1 min;55 ℃ 1 min;72 ℃ 1.5 min;72 ℃最终延伸10 min。PCR产物用纯化试剂盒(OMEGA)纯化,具体方法流程按照说明书进行。
1.4.3 末端限制性片段长度多态性分析(T-RFLP)试验
末端荧光标记的PCR纯化后产物用MspI(TAKARA)限制性内切酶进行消化,反应体系为20 μL,其中酶8 U,10 × buffer 2 L,DNA 200 ng,37 ℃下消化3 h,然后升温至70 ℃将酶灭活20 min。酶切产物的T-RFLP分析由上海基康生物技术有限公司完成。T-RFLP图谱中限制性片段(T-RF)在50 ~ 550 bp,丰度小于1%的T-RFs不计入计算。T-RFs定性分析采用网站在线分析(http://trflp.limnology.wisc.edu/index.jsp),选择在线分析中的PAT(The T-RFLP Phylogenetic Assignment Tool)工具。
2 结果与讨论
2.1 PCP转化动力学
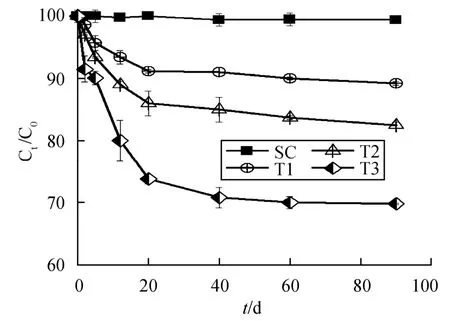
图1 不同反应条件下PCP还原转化动力学 Fig. 1 Reductive transformation kinetics of PCP
PCP在玄武岩砖红壤中的还原转化动力学如图1所示。由图可知,在灭菌体系中(SC处理),PCP没有发生还原转化。其他3个体系中,PCP的还原转化速率依次为T3>T2>T1。在只有PIPES作为缓冲溶液的体系下(T1处理),反应90 d之后,大约有10.8%的PCP发生转化,其转化一级动力学常数k为4.5 × 10−3d−1(R2= 0.943)。结果说明了土壤中的微生物对PCP的还原转化起着决定性作用。有文献[22-24]报道,通过生物刺激的作用,可以提高土壤中土著微生物的活性,从而进一步提高有机氯污染的脱氯转化。在本研究中,当添加外加营养源乳酸作为电子供体时(T2处理),PCP转化速率得到提高,17.5%的PCP发生转化(k = 7.3 ×10−3d−1,R2= 0.947)。当同时添加乳酸和电子介体AQDS时(T3处理),PCP的转化速率进一步提高,30.2%的PCP发生转化(k = 14.3×10−3d−1,R2= 0.958)。结果表明,在外加营养源作用下,供试砖红壤中微生物活性提高,同时,电子介体能提高反应体系中电子传递速率,从而提高PCP的还原转化速率。
2.2 吸附Fe(Ⅱ)生成动力学
Li等[11-12]研究表明,土壤中铁物种的地球化学循环过程能影响PCP还原转化过程,还原性Fe(Ⅱ)物种能够显著促进PCP还原转化率。本研究供试土壤样品具有较高的总铁以及各种形态的铁含量,因此本研究系统考察了PCP降解过程中活性铁物种的生成动力学,进一步研究铁物种对PCP转化的影响。图2为反应过程中产生的吸附态Fe(Ⅱ)浓度变化。从图中可以看出,在灭菌体系中,产生的吸附态Fe(Ⅱ)最高浓度只有0.18 mmol·L−1。而随着反应时间的增加,T1-T3体系中,吸附态Fe(Ⅱ)浓度呈现持续上升趋势,说明添加电子供体乳酸能促进吸附态Fe(Ⅱ)物种的形成,而加入电子介体AQDS能进一步提高体系当中Fe(Ⅱ)生成量。
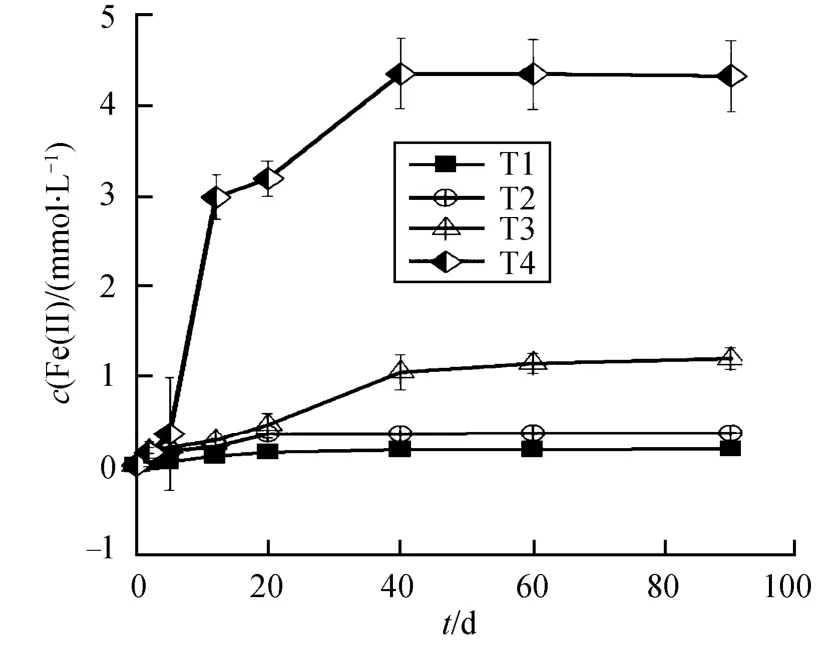
图2 PCP还原转化过程中吸附态Fe(Ⅱ)生成动力学 Fig. 2 Adsorbed Fe(Ⅱ) generation during the PCP transformation
2.3 反应体系中氧化还原电位的变化
采用循环伏安法测定了T1-T3反应体系中前10天活性铁物种的氧化还原电位Ep,结果如图3所示。T1体系中,在反应后期Ep值没有明显变化;而T2和T3体系中,随着反应时间的增加,其Ep值不断变小。这表明在T2和T3体系中,活性Fe(Ⅱ)物种的数量不断增多,反应体系的还原能力持续提高。Glass等[25]指出,土壤的氧化还原电位越低,土壤有机氯污染物的还原转化速度越快,而还原态的Fe物种是影响淹水土壤中氧化还原状态的重要因素之一。由此可见,T3处理中生成的吸附态Fe(Ⅱ)具有较强的还原能力,这也是T3体系中具有较高的PCP还原转化效率的主要原因。
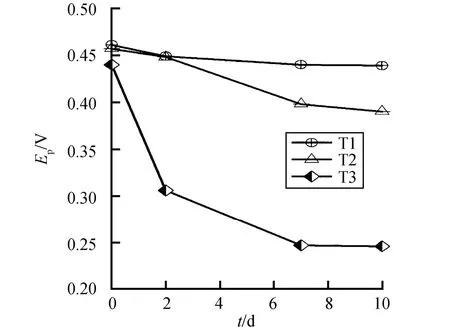
图3 PCP还原转化过程中氧化还原电位变化 Fig. 3 Change of redox potential (Ep) generated during the PCP transformation processes
2.4 PCP转化过程中土壤微生物群落结构变化

图4 4个不同处理下土壤微生物的T-RFLP分析结果 Fig. 4 T-RFLP analysis of bacteria in four treatments
前面研究结果表明,在PCP还原脱氯过程中,土壤样品中微生物起到重要的作用。因此,本研究采用T-RFLP方法对反应7 d的T1-T3体系中微生物群落结构进行解析。实验过程设计不加PCP的处理(CK处理)供试土壤作为对照,研究PCP对微生物群落结构变化的影响。采用MspⅠ进行酶切,酶切产生的片段类型统计结果如图4所示,其中片段丰度小于5%的所有片段归为一类(图中others所示),丰度大于10%定义为该处理条件下的优势种群。CK处理下,共检测到14个T-RF片段;T1-T3处理,分别检测到10、7和4个T-RF片段。具体每个T-RF代表物种类型及丰度如表2所示。
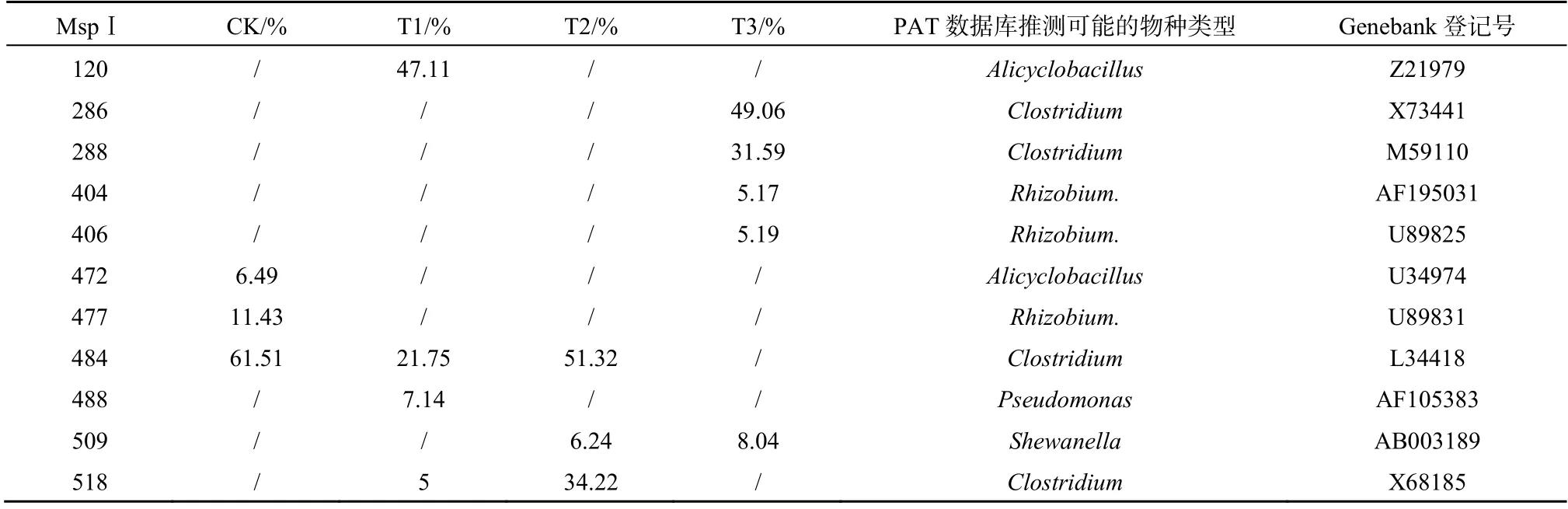
表2 T-RFLP图谱分析不同处理下土壤细菌主要种群 Table 2 Dominating bacteria based on T-RFLP profiles by PAT T-RFLP program
CK处理下,微生物群落结构的多样性最高,其优势种群为477 bp和484 bp,分别与根瘤菌和梭菌末端片段一致;T1处理下,其优势种群为120 bp和484 bp,分别与脂肪酸芽孢杆菌和梭菌末端片段一致;T2处理下,其优势种群为484 bp和518 bp,均与梭菌末端片段一致;T3处理下,其优势种群为286 bp和288 bp,均与梭菌末端片段一致。由此可以推测,在供试土壤样品中,梭菌是绝对优势种群,尤其是添加乳酸和AQDS之后,其含量超过30%;由表2同时可知,T2处理中的片段509 bp与希瓦氏菌(典型铁还原菌)片段一致。结果说明,在外加营养源作用下,与对照处理相比,铁还原菌丰度增加。对4个处理下微生物群落结构进行主成分分析(PCA)发现[26],在研究的4个不同处理条件下,其微生物群落结构存在明显差异(图5),第一主成分主要把添加PCP的样品点与对照试验点分开。T1-T3处理,其差异性主要表现在第二主成分。
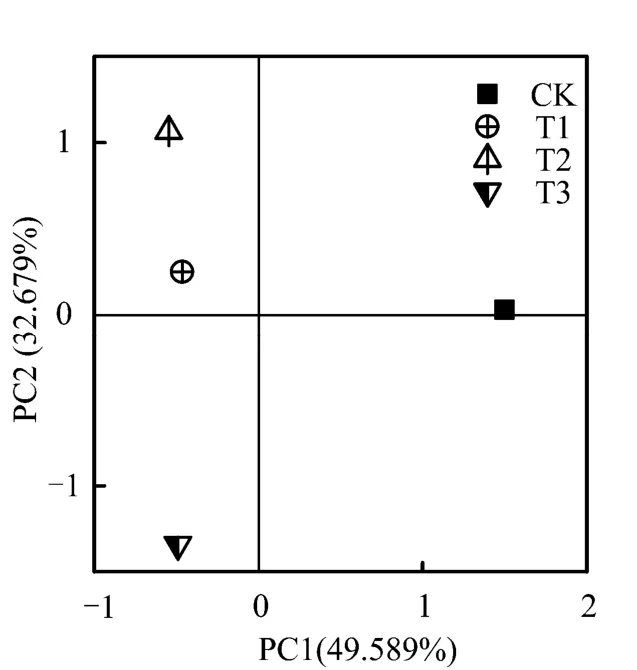
图5 4个不同处理下微生物群落结构主成分分析 Fig. 5 Principal component analysis of microbial community in the four treatments
3 结论
在玄武岩砖红壤中,存在一定丰度的希瓦氏菌,厌氧条件下,氧化铁能被还原形成吸附态Fe(Ⅱ)物种,吸附态Fe(Ⅱ)是土壤有机氯还原转化的重要活性物质[11-12,27]。乳酸作为电子供体,为微生物提供可利用碳源[22],外加乳酸时,土壤中的希瓦氏菌的丰度有所增强,促进了土壤中吸附态Fe(Ⅱ)的形成,从而提高了PCP的还原转化率。
醌基类物质如腐殖质和AQDS作为电子介体,能提高体系的电子转移速率[28]。因此,砖红壤反应体系中加入AQDS能显著提高PCP的还原转化率。
玄武岩砖红壤中PCP还原转化的活性物质是吸附态Fe(Ⅱ),希瓦氏菌是土壤中吸附态Fe(Ⅱ)生成的驱动者。添加乳酸和AQDS促进了吸附态Fe(Ⅱ)的生成,从而加速PCP的还原转化。
[1] HONG H C, ZHOU H Y, LUAN T G, et al. Residue of pentachlorophenol in fresh water sediments and human breast milk collected from the Pearl River Delta, China[J]. Environment International, 2005, 31(5): 643-649.
[2] RODENBURG L A, DU S, FENNELL D E, et al. Evidence for widespread dechlorination of polychlorinated biphenyls in groundwater, landfills, and wastewater collection systems[J]. Environmental Science Technology, 2010, 44(19): 7534-7540.
[3] PERSSON Y, LUNDSTEDT S, ÖBERG L, et al. Levels of chlorinated compounds (CPs, PCPPs, PCDEs, PCDFs and PCDDs) in soils at contaminated sawmill sites in Sweden[J]. Chemosphere, 2007, 66(2): 234-242.
[4] AHLBORG U G, THUNBERG T M. Chlorinated phenols: occurrence, toxicity, metabolism, and environmental impact[J]. CRC Critical Reviews in Toxicology, 1980, 7(1): 1-35.
[5] 关卉,杨国义,李丕学,等. 雷州半岛典型区域土壤有机氯农药污染探查研究[J]. 生态环境,2006,15(2):323-326.
[6] 陶亮,周顺桂,李芳柏. 土壤有机氯脱氯转化的界面交互反应[J]. 化学进展, 21(4):791-800.
[7] HE J, MA W H, SONG W J, et al. Photoreaction of aromatic compounds at alpha-FeOOH/H2O interface in the presence of H2O2: evidence for organic-goethite surface complex formation[J]. Water Research, 2005, 39(1):119-128.
[8] VALO R, SALKINOJA-SALONEN M S. Microbial transformation of polychlorinated phenoxy phenols[J]. Journal of General and Applied Microbiology, 1986, 32(6):505-517.
[9] LOVLEY D R. Dissimilatory Fe (Ⅲ) and Mn (Ⅳ) reduction[J]. Microbiological Reviews, 1991, 55(2):259.
[10] HUGHES A S, VANBRIESEN J M, SMALL M J. Identification of structural properties associated with polychlorinated biphenyl dechlorination processes[J]. Environmental Science Technology, 2009, 44(8):2842-2848.
[11] LI F B, WANG X G, LIU C S, et al. Reductive transformation of pentachlorophenol on the interface of subtropical soil colloids and water[J]. Geoderma, 2008, 148(1):70-78.
[12] LI F B, WANG X G, LI Y T, et al. Enhancement of the reductive transformation of pentachlorophenol by polycarboxylic acids at the iron oxide-water interface[J]. Journal of Colloid Interface Science, 2008, 321(2): 332-341.
[13] 李芳柏, 王旭刚, 周顺桂, 等 红壤胶体铁氧化物界面有机氯的非生物转化研究进展[J]. 生态环境. 2006, 15(6): 1343-1351.
[14] 徐仁扣. 土壤中氧化铁的有机还原溶解动力学[J]. 热带与亚热带土壤科学, 1994,3(2): 71-76.
[15] 王旭刚, 孙丽蓉, 曾芳, 等. 五氯酚在土壤胶体界面的还原转化[J]. 环境科学研究, 2009, 22(4): 438-443.
[16] FREDRICKSON J K, GORBY Y A. Environmental processes mediated by iron-reducing bacteria[J]. Current Opinion in Biotechnology, 1996, 7(3): 287-294.
[17] 刘安世. 广东土壤[M]. 北京: 科学出版社,1993: 105-120.
[18] KHODADOUST A P, SUIDAN M T, ACHESON C M, et al. Solvent extraction of pentachlorophenol from contaminated soils using water-ethanol mixtures[J].Chemosphere 1999, 38(11): 2681-2693.
[19] FENG C H, LI F B, MAI H J, et al. Bio-electron-Fenton process by microbial fuel cell for wastewater treatment[J]. Environmental Science Technology, 2010, 44(5): 1875-1880.
[20] CHEN M J, SHIH K M, HU M, et al. Biostimulation of indigenous microbial communities for anaerobic transformation of pentachlorophenol in paddy soils of south china[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 2967-2975.
[21] McNAMARA N P, BLACK H I J, BERESFORD, et al. Effects of acute gamma irradiation on chemical, physical and biological properties of soils[J]. Applied Soil Ecology, 2003, 24:117-132.
[22] BRAHUSHI F, DORFLER U, SCHROLL R, et al. Stimulation of reductive dechnlorination of hexachlorobenzene in soil by inducing the native microbial activity[J]. Chemosphere, 2004, 55(2): 1477-1484.
[23] FREEBORN R A, WEST K A, BHUPTHIRAJU V K, et al. Phylogenetic analysis of TCE-dechlorinating consortia enriched on a variety of electron donors[J]. Environmental Science Technology, 2005, 39(21): 8358-8368.
[24] DOONG R, CHEN T, WU Y. Anaerobic dechlorination of carbon tetrachloride by free-living and attached bacteria under various electron-donor conditions[J]. Applied Microbiology and Biotechnology, 1997, 47(3): 317-323.
[25] GLASS B L. Relation between the degradation of DDT and the iron redox system in soils[J]. Journal of Agricultural and Food chemistry, 1972, 20(2): 324-327.
[26] DOLLHOPF S L, HASHSHAM S A, TIEDJE J M. Interpreting 16S rDNA T-RFLP data: application of self-organizing maps and principal component analysis to describe community dynamics and convergence[J]. Microbial Ecology, 2001, 42(4): 495-505.
[27] 李晓敏,李永涛,李芳柏,等. 有机氯脱氯转化的铁还原菌与铁氧化物界面的交互反应[J]. 科学通报, 2009, 54(13): 1880-1884.
[28] AULENTA F, MAIO V D, FERRI T, et al. The humic acid analogue antraquinone-2,6-disulfonate (AQDS) serves as an electron shuttle in the electricity-driven microbial dechlorination of trichloroethene to cis-dichloroethene[J]. Bioresource Technology,2010, 101:9728-9733.
