钙离子浓度对两种蕨类植物光合作用的影响
2013-07-29罗绪强王世杰张桂玲王程媛杨鸿雁廖昕荣
罗绪强,王世杰,张桂玲,王程媛,杨鸿雁,廖昕荣
1. 贵州师范学院地理与旅游学院,贵州 贵阳550018;2. 中国科学院地球化学研究所环境地球化学国家重点实验室, 贵州 贵阳550002;
3. 贵阳学院化学与材料工程学院, 贵州 贵阳550005
钙素是植物生长发育所必需的矿质营养元素,在植物体内发挥着重要的生理功能[1-2]。但是,植物体内较高的Ca2+浓度会影响植物的光合作用和生长速率,严重的还会破坏细胞器而致植物死亡[3-4]。另外,细胞质中过多的游离态Ca2+可与PO43-形成沉淀,干扰与磷代谢有关的生理过程,抑制呼吸作用,或因妨碍正常的信号传导而影响植物生长[5-6],这可能是许多植物在土壤高Ca2+地区难以正常生长的原因之一。
石灰土作为喀斯特地区分布最广的非地带性土壤,是其下伏碳酸盐岩风化的产物。由于对母岩的继承性,土壤Ca2+含量普遍较高。据报道,同为常绿落叶阔叶混交林下,石灰土Ca2+浓度是酸性土的3倍以上[7]。喀斯特地区石灰土的高钙含量已成为影响该区植物生理特征及植物多样性最重要的环境因素之一[8]。
本文分别选取石灰土专属种柳叶蕨(Cyrtogonellum Ching)和酸性土专属种薄叶双盖蕨(Diplazium pinfaense Ching) 2种蕨类植物为研究对象,模拟石灰土高Ca2+浓度的环境特征,用具有不同Ca2+浓度梯度的营养液对2种蕨类植物进行培养,根据其净光合速率、蒸腾作用、气孔导度、胞间CO2浓度等光合指标特性,探讨钙离子胁迫对两种蕨类植物光合作用的影响,并比较分析了柳叶蕨和薄叶双盖蕨对土壤高Ca2+环境的生理响应特征。以期为喀斯特喜钙植物适生机制的理解及退化生态系统植被恢复的物种选择提供基础数据和理论支持。
1 材料与方法
1.1 材料来源
实验样品材料石灰土专属种柳叶蕨 (Cyrtogonellum Ching)和酸性土专属种薄叶双盖蕨(Diplazium pinfaense Ching)为野外(贵州茂兰国家级自然保护区)采集植物孢子,室内培养成株。
1.2 材料培养与处理
实验于室温室内进行。采用60目石英砂作为培养基,霍格兰氏(Hoagland’s)营养液配加阿农(Arnon)微量元素混合液作为母液,通过改变配加硝酸钙调节和配置不同营养液Ca2+浓度,配成Ca2+浓度分别为4、30、100、200 mmol·L-1的4种营养液,其中4 mmol·L-1的Ca2+浓度用以模拟酸性土中交换态钙含量,100 mmol·L-1用以模拟石灰土中交换态钙平均含量,并用0.1 mol·L-1的盐酸及氢氧化钠溶液将营养液pH值控制在6~6.5。于温度23~27 ℃,湿度70%、光照强度15( ± 5 ) μmol·m-2·s-1条件下砂培2种植物。每种营养液设置4次重复,于室内测定植株的各项光合作用指标参数。
1.3 测定指标及方法
采用美国LI-COR公司生产的LI-6400i便携式光合仪,对不同Ca2+浓度培养液培养的两种蕨类植物进行净光合速率( Pn, μmol·m-2·s-1)、蒸腾速率 ( Tr, mmol·m-2·s-1)、气孔导度( Gs, mol·m-2·s-1)、胞间CO2浓度( Ci, μmol·mol-1)等光合作用参数的测定。测定时间为09:00~18:00,每小时测定1次。每次测定2片叶,每片叶记录5组数据,取平均值。
1.4 数据处理
采用SPSS、Origin等软件对实验数据进行统计分析和制图。
2 结果与分析
2.1 Ca2+浓度对2种蕨类植物净光合速率的影响
2.1.1 不同Ca2+浓度对2种蕨类植物净光合速率 Pn的影响
由表1可见,当Ca2+浓度低于100 mmol·L-1时,柳叶蕨的Pn略高于薄叶双盖蕨的Pn,而当Ca2+浓度为200 mmol·L-1时,薄叶双盖蕨的Pn高于柳叶蕨的Pn。同时,随Ca2+浓度升高,柳叶蕨的Pn减小,而薄叶双盖蕨的Pn整体上呈先增大后减小趋势。

表1 不同Ca2+浓度下2种蕨类植物日间 净光合速率均值(μmol·m-2·s-1 ) Table 1 The net photosynthetic rate ( μmol·m-2·s-1 ) of the two ferns’ leaves under different calcium concentration in medium level
4个浓度梯度上,两植物全日最大净光合速率Pn(max)均出现在正午12:00。从表1可知,柳叶蕨在Ca2+浓度为30 mmol·L-1时的日Pn(max)达到最高值,为1.57 μmol·m-2·s-1,说明其在Ca2+浓度为30 mmol·L-1时有最佳的生长状态。薄叶双盖蕨在Ca2+浓度为4 mmol·L-1时的日Pn(max)值最高,为1.41 μmol·m-2·s-1,显示薄叶双盖蕨在低Ca2+浓度(4 mmol·L-1)时有最佳的生长状态,该浓度与通常情况下酸性土中交换态钙浓度基本一致[9]。
2.1.2 2种蕨类植物净光合速率( Pn )与胞间CO2浓度( Ci )的日变化关系
植物胞间CO2浓度作为光合作用的底物,其浓度能够在一定程度上反映光合作用的强度。由图1可见,柳叶蕨和薄叶双盖蕨叶片Pn与Ci均呈显著中度负相关关系(P<0.01),其相关系数分别为-0.712和-0.804。显示二者光合作用降低均受到一定的非气孔限制,净光合速率的降低可能是由叶肉细胞光合活性下降引起的[10]。
2.2 不同Ca2+浓度下2种蕨类植物的其他生理参数特征
2.2.1 蒸腾速率( Tr )日变化
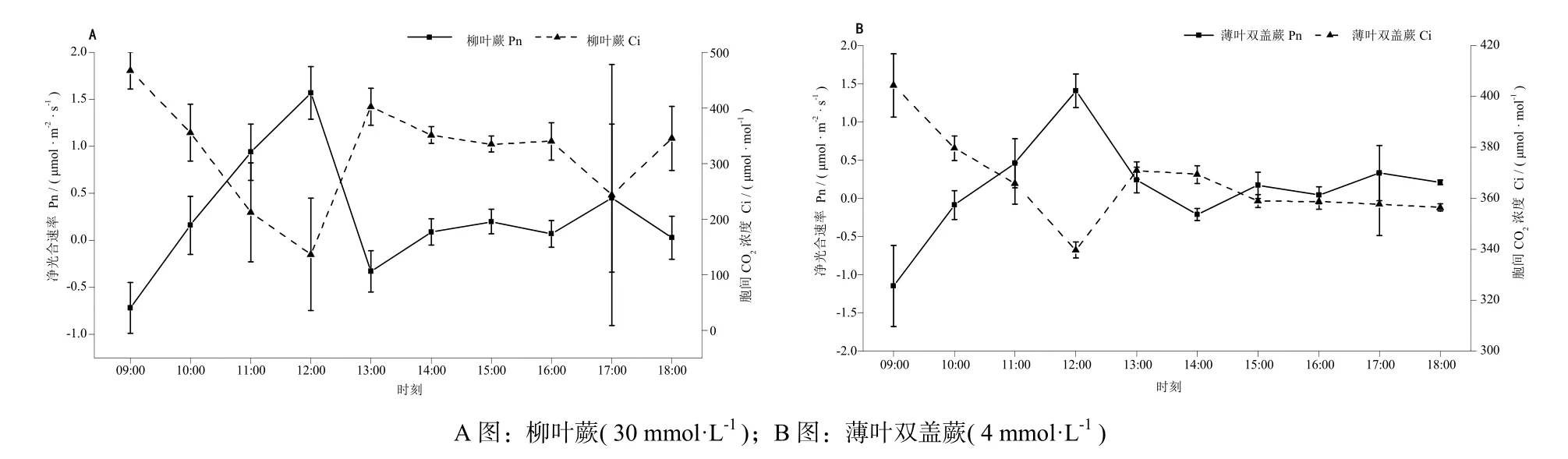
图1 2种植物净光合速率( Pn )日变化与胞间CO2 浓度( Ci )日变化关系图 Fig. 1 The relationship between diurnal variations of net photosynthetic rate ( Pn ) and intercellular CO2 concentration ( Ci ) of the two ferns’ leave
蒸腾作用是植物吸收和运输水分的主要动力,在维持植物各部分水分饱和,保持细胞组织形态,促进矿质元素及无机盐类在体内的运输和分布,降低叶片温度等方面均具有重要生理意义[11]。
从图2可见,当Ca2+浓度为30 mmol·L-1时,柳叶蕨的Tr与薄叶双盖蕨的Tr基本相近,其余浓度梯度上二者差异显著(P< 0.001),前者仅为后者的1/2左右。Ca2+浓度为4 mmol·L-1时,柳叶蕨(图2A) Tr日变化曲线呈轻微的“双峰”态,“峰”分别出现在13:00时和17:00时,“谷”出现于15:00时;30 mmol·L-1时,其Tr日变化曲线有明显的“峰”,出现在13:00时,“谷”出现在14:00时,这与午后14:00时左右气温和光照强度为1 d中最大有关;随Ca2+浓度升高,其Tr日变化曲线由“双峰”变为“单峰”,且强度明显减弱。薄叶双盖蕨(图2B)在Ca2+浓度较低时(4mmol·L-1)的Tr随时间变化趋势最为明显,在12:00时和17:00时出现“峰”,而“谷”期出现于13:00时,与柳叶蕨略有差异,这应与物种自身遗传性有关;与柳叶蕨类似,薄叶双盖蕨随 Ca2+胁迫程度的加剧,蒸腾作用强度亦降低,不同的是,Ca2+浓度较高时,薄叶双盖蕨的Tr随时间(外界气温)变化的规律性减弱。说明薄叶双盖蕨可能只在Ca2+浓度较低时才可以敏锐应对1 d之中光照强度和温度的变化。
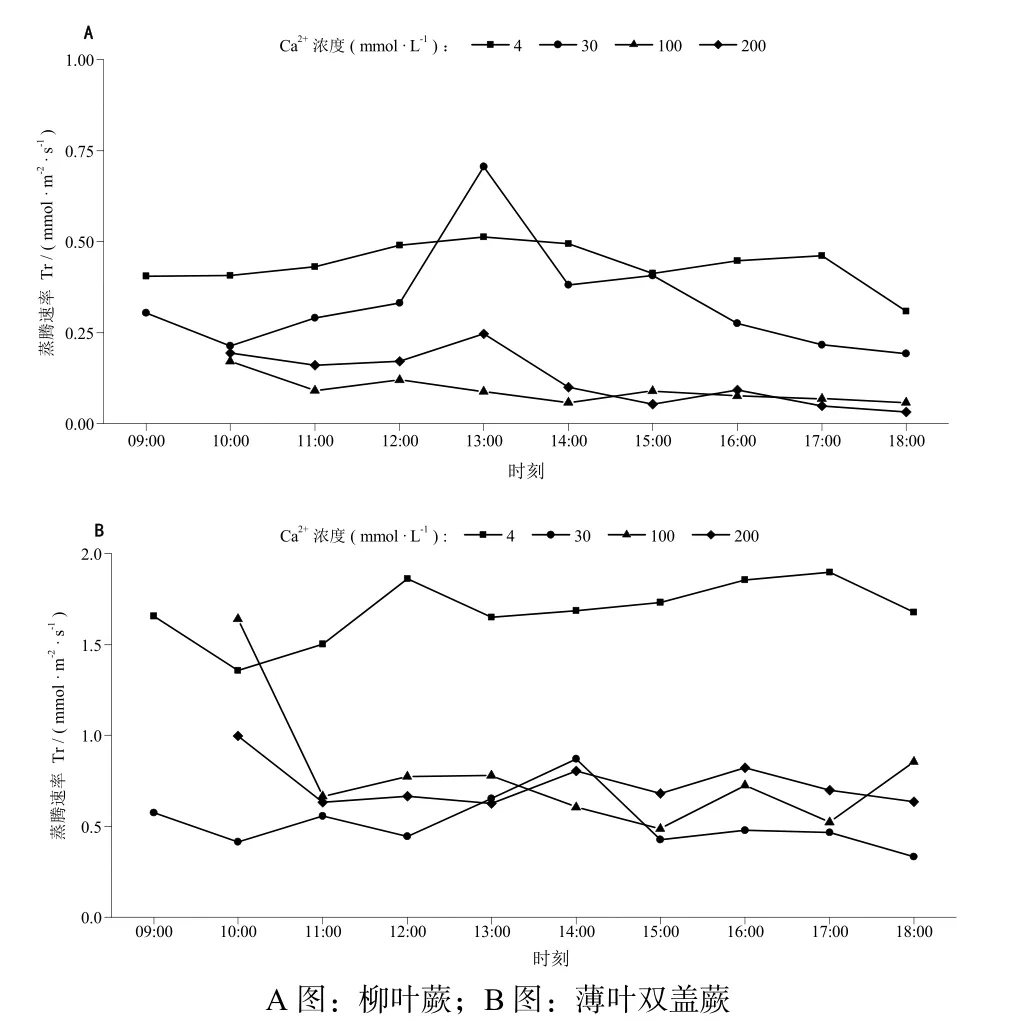
图2 不同Ca2+浓度下2种植物蒸腾速率( Tr )的日变化 Fig. 2 Diurnal variations of transpiration rate ( Tr ) of the two ferns’ leaves at different calcium concentration level
2.2.2 蒸腾速率( Tr )、气孔导度( Gs )的组间差异情况
气孔是CO2进入和水蒸汽逸出植物体的通道,植物通过调节气孔开闭程度对光合作用和蒸腾作用这两个相互耦合的过程进行调控[12-13],进而影响到植物的生长发育。一般说来,植物的 Tr 与 Gs 呈线性正相关,遭遇环境胁迫时,气孔表现为关闭,即气孔导度降低,蒸腾强度减弱[14-15]。
实验表明,柳叶蕨和薄叶双盖蕨两种植物的Tr与Gs在不同Ca2+浓度间均具有极显著差异(P< 0.001 ),经多重比较检验后可以归为如表2所示的3个系列。相对于薄叶双盖蕨,不同 Ca2+浓度梯度下柳叶蕨的 Tr 和 Gs 均处于较低水平,该现象的产生可能是柳叶蕨的遗传因素造成的。两植物在Ca2+浓度为4 mmol·L-1时均有最大的Tr和Gs,所不同的是,柳叶蕨Tr和Gs骤然降低的拐点在Ca2+浓度为100 mmol·L-1时,而薄叶双盖蕨出现在Ca2+浓度为30 mmol·L-1时。在Ca2+浓度为100 mmol·L-1和200 mmol·L-1时,柳叶蕨的Gs值分别为Ca2+浓度为4 mmol·L-1时的23.53%和35.29%;当Ca2+浓度为30 mmol·L-1和100 mmol·L-1时,薄叶双盖蕨的Gs值分别为Ca2+浓度为4 mmol·L-1时的28.38% 和48.65%。由此可见,随Ca2+胁迫程度的加剧,柳叶蕨的Gs波动相对较小。在Tr方面亦有近似的变化趋势。从而反映了柳叶蕨的气孔开合和蒸腾作用过程对Ca2+浓度变化有较优的适应性,保证了其对外界环境变化的积极响应,这很有可能是其能在有高Ca2+浓度的石灰土地区得以生存的原因之一。
由表2还可以看出,薄叶双盖蕨在Ca2+浓度大于100 mmol·L-1时的蒸腾速率及气孔导度远高于在Ca2+浓度为30 mmol·L-1时的蒸腾速率及气孔导度,这一方面可能是因为较高的Ca2+浓度破坏了薄叶双盖蕨的气孔结构,使其不能及时调节气孔开合[3],另一方面可能是因为胁迫出现时,薄叶双盖蕨仅关闭了相对小部分的气孔,通过强的蒸腾作用吸收更多的水分进入体内以降低体内Ca2+浓度。
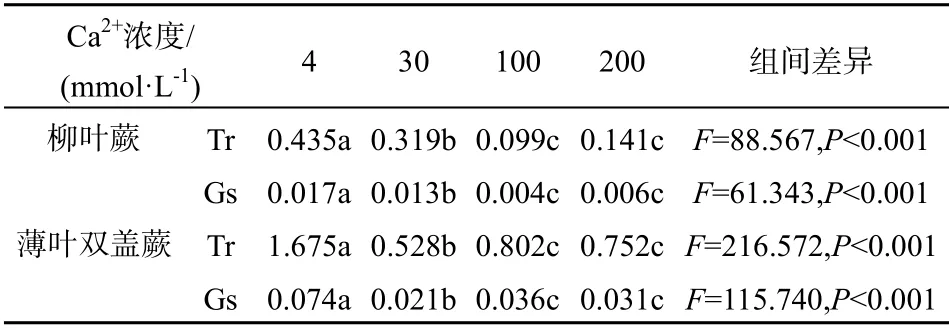
表2 2种蕨类植物蒸腾速率均值(Tr, mmol·m-2·s-1) 与气孔导度均值(Gs, mol·m-2·s-1) Table 2 Transpiration rate ( Tr, mmol·m-2·s-1 ) and stomatal conductivity ( Gs, mol·m-2·s-1 ) in medium level of the two ferns’ leave under different calcium concentration level
3 讨论及结论
3.1 讨论
Ca2+浓度从30 mmol·L-1增加到100 mmol·L-1,2种植物的净光合速率( Pn )均陡然下降,其中柳叶蕨下降了35.48%,薄叶双盖蕨下降了42.71%,显示当受Ca2+胁迫时,柳叶蕨光合速率降低相对缓慢,这时高光合有利于应对钙胁迫。在更高Ca2+浓度 ( 200 mmol.L-1) 控制下,薄叶双盖蕨的 Pn 略高于柳叶蕨的 Pn,这可能是由于薄叶双盖蕨受 Ca2+胁迫加剧,到了必须通过加快提高代谢速率以降低体内 Ca2+浓度的程度,而使作为植物最基础代谢过程的光合作用被瞬时增强所致[3-6,16]。但在该浓度下,柳叶蕨并无此特征表现,这一过程进一步说明了柳叶蕨较薄叶双盖蕨更利于在高钙环境中生存,柳叶蕨具有相对更高的耐钙能力。
土壤中的Ca2+可通过植物根部的Ca2+通道直接进入根系表皮细胞及根毛[17-18],并在Ca2+-ATPase的协助下进入木质部[16]。虽然“Ca2+的吸收同步于水分的吸收”这一观点一直备受争议[19],但蒸腾作用的增强既有助于植物对Ca2+的吸收,又有利于Ca2+依靠蒸腾拉力在植物体内运移和积累已被实验证明[20]。因此,植物适应高钙环境应该涉及到植株对Ca2+的吸收、转运、积累等各个环节。薄叶双盖蕨在高Ca2+浓度环境中保持较高的光合作用强度,为加快代谢速率降低体内Ca2+提供了可利用的能量;而同样条件下,柳叶蕨通过关闭大部分气孔、降低蒸腾作用强度等行为,在减少水分散失的同时亦限制了过量Ca2+进入植株地上部分,这与前人的相关研究结论基本一致[4]。另外,在较高Ca2+浓度时,柳叶蕨仍能使其蒸腾作用对气温变化进行较敏锐的积极响应,也为其能在Ca2+含量较高的石灰土地区生存提供了条件。
不同Ca2+浓度控制下,2种植物的叶片净光合速率 ( Pn )始终与胞间CO2浓度 ( Ci ) 呈显著负相关 (P< 0.01 ),从而认为,柳叶蕨和薄叶双盖蕨在 Ca2+浓度控制下发生的净光合速率降低的行为很有可能是由非气孔限制因素引起的[21]。同时,随 Ca2+胁迫加剧,柳叶蕨的 Pn 与 Tr 均降低,说明由 Ca2+浓度升高引起的柳叶蕨 Pn 降低可能与其叶片受热害、叶肉细胞羧化酶活性降低有关[22];当 Ca2+浓度大于 30 mmol·L-1时,薄叶双盖蕨的 Pn 降低,但 Tr 略有上升,说明薄叶双盖蕨Pn降低除了与其叶片叶肉细胞羧化能力有关外,还可能与过量 Ca2+引起叶片叶绿素含量降低等因素有关[23-24]。
3.2 结论
实验设计Ca2+营养液4个浓度梯度上,柳叶蕨和薄叶双盖蕨的日 Pn(max)最高值对应的Ca2+浓度分别为30 mmol·L-1和4 mmol·L-1。当 Ca2+浓度为 30 mmol·L-1时,柳叶蕨的 Tr 与薄叶双盖蕨的 Tr基本相近,其余浓度梯度上二者差异显著 (P< 0.001 )。柳叶蕨和薄叶双盖蕨的叶片Pn与Ci 均呈显著负相关关系 (P< 0.01 )。不同Ca2+浓度梯度下柳叶蕨相对于薄叶双盖蕨的Tr和Gs均处于较低水平,2种植物的Tr与Gs在不同Ca2+浓度间均具有极显著差异 (P< 0.001 )。
从植物光合作用特征的角度考虑,柳叶蕨能够在高钙环境的石灰土上正常生存的原因在于:钙离子胁迫发生时,柳叶蕨能保持相对稳定的光合速率及蒸腾速率变化趋势;胁迫持续期间,在保证生存的前提下控制其光合速率及蒸腾速率处于较低的水平,以相对保守的姿态度过胁迫。
[1] LIANG W J, WANG M L, AI X Z. The role of calcium in regulating photosynthesis and related physiologicalindexes of cucumber seedlings under low light intensity and suboptimal temperature stress[J]. Scientia Horticulturae, 2009, 123: 34-38.
[2] 李强, 曹建华, 余龙江, 等. 干旱胁迫过程中外源钙对忍冬光合生理的影响[J]. 生态环境学报, 2010, 19(10): 2291-2296.
[3] 李青云, 葛会波, 胡淑明, 等. 钠盐和钙盐胁迫对草莓光合作用的影响[J]. 西北植物学报, 2006, 26(8): 1713-1717.
[4] 姬飞腾, 李楠, 邓馨. 喀斯特地区植物钙含量特征与高钙适应方式分析[J]. 植物生态学报, 2009, 33(5): 926-935.
[5] WHITE P J, BROADLEY M R. Calcium in plants[J]. Annals of Botany, 2003, 92: 487-511.
[6] HIRSCHI K D. The calcium conundrum, both versatile nutrient and specific signal[J]. Plant Physiology, 2004, 136: 2438-2442.
[7] 曹建华, 袁道先, 潘根兴. 岩溶生态系统中的土壤[J]. 地球科学进展, 2003, 18(1): 37-44.
[8] 谢丽萍, 王世杰, 肖德安. 喀斯特小流域植被—土壤土壤系统钙协变关系研究[J]. 地球与环境, 2007, 35(1): 26-32.
[9] 安德艳, 艾复清. 铜仁地区植烟土壤类型及肥力分析[J]. 贵州农业科学, 2010, 38(6): 126-129.
[10] 许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯, 1997, 33(4): 241-244.
[11] MARKS C O, LECHOWICZ M J. The ecological and functional correlates of nocturnal transpiration[J]. Tree Physiology, 2007, 27: 577-584.
[12] TUZET A, PERRIER A, LEUNING R. A coupled model of stomatal conductance, photosynthesis and transpiration[J]. Plant, Cell and Environment, 2003, 26: 1097-1116.
[13] 王建林, 林荣芳, 于贵瑞, 等. 光和CO2作用下C3和C4作物气孔导度—光合速率耦合关系的差异[J]. 华北农学报, 2008, 23(1): 71-75.
[14] MIYASHITA K, TANAKAMARU S, MAITANI T, et al. Recovery responses of photosynthesis, transpiration, and stomatal conductance in kidney bean following drought stress[J]. Environmental and Experimental Botany, 2005, 53: 205-214.
[15] 廖岩, 陈桂珠. 三种红树植物对盐胁迫的生理适应[J]. 生态学报, 2007, 27(6): 2208-2214.
[16] WHITE P J. The pathways of calcium movement to the xylem[J]. Journal of Experimental Botany, 2001, 52: 891-899.
[17] DAVENPORT R, TESTER M. A weakly voltagedependent,non-selective cation channel mediates toxic sodium influx in wheat[J]. Plant Physiology, 2000, 122: 823-834.
[18] WHITE P J. Calcium channels in higher plants[J]. Biochimiea et Biophysica Acta, 2000, 1465: 171-189.
[19] ATKINSON C J, RUIZ L P, MANSFIELD T A. Calcium in xylem sap and the regulation of its delivery to the shoot[J]. Experimental Botany, 1992, 43: 1315-1324.
[20] GIUSEPPE M, BARTOLOMEO D, CRISTOS X. Significance of fruit transpiration on calcium nutrition in developing apricot fruit[J]. Plant Nutr. Soil Sci, 2010, 173: 618-622.
[21] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Ann Rev Plant Physiol, 1982, 33: 317-345 .
[22] 郭卫东, 郑建树, 张真真, 等. 短暂低温对佛手光合生理的影响[J]. 生态学报, 2009, 29(5): 2286-2293.
[23] CANDANA N, TARHANB L. Effects of Calcium, Stress on Contents of Chlorophyll and Carotenoid, LPO Levels, and Antioxidant Enzyme Activities in Mentha[J]. Journal of Plant Nutrition, 2005, 28:127-139.
[24] 邹文桐, 熊德中. 土壤交换性钙水平对烤烟若干生理代谢的影响[J]. 安徽农业大学学报, 2010, 37(2): 369-373.
