结核分枝杆菌休眠相关抗原Rv1733c DNA疫苗的构建及免疫学特性研究
2013-07-26段安虎张薇柏银兰康健王瑞徐志凯王丽梅
段安虎 张薇 柏银兰 康健 王瑞 徐志凯 王丽梅
·论 著 ·
结核分枝杆菌休眠相关抗原Rv1733c DNA疫苗的构建及免疫学特性研究
段安虎 张薇 柏银兰 康健 王瑞 徐志凯 王丽梅
目的 构建结核分枝杆菌(Mtb)休眠相关抗原Rv1733c的真核表达载体,并评价其作为DNA疫苗的免疫学特性。方法 利用限制性酶切的方法从本室前期保存的p MD-18T-Rv1733c质粒中构建Rv1733c的真核表达载体pcDNA-Rv1733c。将pcDNA-Rv1733c重组质粒稳定转染P815细胞,并用间接免疫荧光法检测Rv1733c的表达。采用数字表法随机将BALB/c小鼠分为3组,每组10只,即pcDNA-Rv1733c质粒DNA组、生理盐水组和BCG组。pcDNA-Rv1733c质粒DNA组和生理盐水组采用肌内注射方式免疫,间隔2周免疫1次,共免疫3次。BCG组采用皮下免疫一次。各组小鼠每2周采血,ELISA检测血清中特异性抗体水平和IgG2a/IgG1抗体亚类比率与比值。初次免疫8周后,MTS[3-(4,5-diethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-etrazolium,inner salt](四氮唑蓝盐化合物)法检测小鼠脾淋巴细胞特异性增殖、ELISPOT检测脾淋巴细胞分泌IFN-γ的水平。流式细胞法检测脾淋巴细胞中CD4+和CD8+T细胞所占比率;LDH法检测CTL(cytotoxic T lymphocytes;细胞毒性T淋巴细胞)活性。结果 成功构建Rv1733c的真核表达载体pcDNA-Rv1733c。间接免疫荧光实验表明pcDNA-Rv1733c质粒稳定转染的P815细胞中能够稳定表达Rv1733c蛋白。pcDNA-Rv1733c质粒DNA免疫小鼠后能诱导小鼠产生特异性抗体,抗体亚类以IgG2a为主,随着免疫时间的延长,IgG2a/IgG1的比值趋于平衡;脾淋巴细胞增殖指数(2.00±0.36)高于BCG组(1.1±0.06)(t=3.096,P<0.05);特异性分泌IFN-γ的脾淋巴细胞频数(41.48±5.30)SFC/106高于生理盐水组(2.75±1.37)SFC/106(t=4.752,P<0.05);然而脾淋巴细胞中CD4+、CD8+T细胞所占比率[分别为(18.15±2.30)%、(7.68±1.34)%]、CTL杀伤活性[(29.52± 1.96)%]都与生理盐水组相当[(16.43±2.02)%(t=0.571,P>0.05)、(7.32±0.42)%(t=0.234,P>0.05)、(25.28±2.51)%(t=0.726,P>0.05)]。结论 成功构建Rv1733c真核表达载体pcDNA-Rv1733c;并能够诱导小鼠机体产生特异性的体液和细胞免疫应答,提示用于结核病新型疫苗的研究具有一定的意义。
分枝杆菌,结核; 抗原,细菌; 疫苗,DNA; 抗体生成; 免疫,细胞
目前结核病(tuberculosis,TB)严重威胁着人类健康。全球约1/3人口潜伏感染结核分枝杆菌(Mycobacterium tuberculosis,Mtb),其中5%~10%有可能发展为TB,控制Mtb潜伏感染对于TB防治具有重要意义[1]。研究表明,Mtb在潜伏感染期主要以休眠菌状态存在。Mtb休眠菌为了适应宿主环境和逃避机体免疫作用而特异性转录表达一组由休眠调节子DosR(dormancy regulon)调控的休眠相关抗原(1atency antigens),共48个[2-3]。休眠相关抗原的表达对Mtb在体内的潜伏感染和持续存活具有重要意义。Leyten等[4]研究发现,在Mtb潜伏感染人群中可检测到针对休眠相关抗原的特异性免疫应答,而在BCG免疫人群中未能检测到[5],因此认为以Mtb休眠相关抗原作为靶抗原设计疫苗,可能获得针对Mtb潜伏感染的保护性免疫应答,有助于清除Mtb休眠菌,防止TB复发。休眠相关抗原Rv1733c是Mtb潜伏感染人群中外周血T淋巴细胞识别率较高的一个蛋白,该蛋白能够有效刺激T淋巴细胞分泌IFN-γ[6]。因此,本研究构建了Rv1733c的真核表达载体,并检测其免疫小鼠后的免疫学特性,为TB新型疫苗候选抗原的研究奠定基础。
材料和方法
一、材料
1.试剂和耗材:真核表达载体pcDNA3.1(-)、E.coli DH5α菌株、P815细胞(小鼠肥大瘤细胞,H-2 d)保存;重组质粒p MD-18T-Rv1733c由本室前期构建和保存[7]。限制性内切酶、T4 DNA连接酶均购自TaKaRa生物公司。Lipofectamine 2000购自Invitrogen公司;G418购自Roche公司;质粒大量提取试剂盒购自Omega公司;CytoTox 96 Non-Radioactive Cytotoxicity检测试剂盒购自Promega公司;大鼠抗小鼠CD4:FITC/CD8:RPE-Dual Reagent购自AbD Serotec公司;FITC标记-羊抗小鼠IgG购自北京中杉生物公司;纯化的Rv1733c蛋白和Rv1733c蛋白免疫小鼠血清由本室前期制备保存[7]。
2.实验动物:BALB/c雄性小鼠,6~8周龄,18~20 g/只,由第四军医大学实验动物中心提供。
二、方法
(一)pcDNA-Rv1733c重组质粒的制备
1.真核表达载体的构建:以Bam HⅠ和Hin dⅢ分别双酶切pcDNA3.1(-)载体以及重组质粒p MD-18T-Rv1733c,分别回收载体片段和各目的基因片段。将回收的目的基因片段与经双酶切后的真核表达载体pcDNA3.1(-)分别进行连接,转化DH5α感受态细胞。并分别接种于5 ml含100μg/ml氨苄青霉素的溶菌肉汤(lysogeny broth,LB)培养液中,37℃振荡培养12 h后提取质粒,以Bam HⅠ和Hin dⅢ双酶切鉴定。阳性克隆命名为pcDNARv1733c。
2.G418浓度的筛选和细胞转染:用24孔板中加入P815细胞,于24 h后加入G418筛选,5% CO2孵箱继续培养8~10 d,观察P815细胞死亡情况,选取稍高于细胞全部死亡孔的 G418浓度为工作浓度。细胞转染前1 d于24孔板中每孔接种2× 105个P815细胞,采用Lipofectamine 2000将pcDNA-Rv1733c和pcDNA3.1(-)两种质粒分别转染P815细胞,转染后24 h,将细胞按1∶10体积稀释,分别加入G418抗生素,后再继续培养7 d。用间接免疫荧光法(IFT)检测目的基因表达的相应抗原。选取阳性细胞进行克隆化后扩大培养。
3.IFT检测转染细胞中目的蛋白的表达:将转染后的细胞株接种于24孔板中,24 h后进行IFT检测细胞株是否表达目的蛋白。PBS缓冲液轻柔洗涤细胞3次,加入预冷的甲醇,-20℃固定15 min,再以PBS洗涤3次,山羊血清封闭30 min,PBS洗涤3次。加入抗Rv1733c蛋白免疫小鼠血清(由本实验室前期制备保存[7]),4℃过夜。次日以PBS洗涤后加入1∶2000稀释的异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗小鼠IgG,37℃孵育2 h后以PBS洗涤并于荧光显微镜下观察。
4.重组质粒的大量提取:将pcDNA-Rv1733c重组质粒的阳性克隆分别接种于5 ml LB液体培养基(含氨苄青霉素100μg/ml),37℃振荡培养过夜。次日扩大培养12 h。质粒的大量提取及纯化按照试剂盒说明书进行。
(二)动物分组及免疫
BALB/c小鼠数字表法随机分为3组,pcDNARv1733c质粒DNA组、生理盐水组和BCG组,每组10只。各组小鼠免疫前24 h在小鼠后肢大腿两侧多点肌注0.25%盐酸布比卡因50μl。其中pcDNA-Rv1733c质粒DNA组和生理盐水组采用肌内注射方式免疫,分别为pcDNA-Rv1733c质粒DNA 100μg/只和生理盐水0.1 ml/只;两组小鼠以同样的方法每隔2周免疫1次,共免疫3次。BCG组每只小鼠皮下接种BCG 1×105CFU/0.1 ml,免疫1次。
(三)免疫小鼠的免疫学特性的检测
1.特异性抗体及抗体亚型的检测:各组小鼠每2周尾静脉采小鼠血,分离血清。用纯化的Rv1733c蛋白(由本室自备保存)以10μg/ml的浓度包被ELISA板,100μl/孔,4℃过夜。PBS洗涤3次,加入5%牛血清白蛋白(BSA)100μl/孔,37℃封闭1 h。PBS洗涤3次后加入不同倍比稀释度的小鼠血清100μl/孔,37℃孵育1 h;PBS洗涤3次后加入1∶2000稀释的辣根过氧化物酶(horseradish peroxidase,HRP)-羊抗小鼠IgG 100μl/孔,37℃孵育1 h;PBS洗涤3次后加入底物[邻苯二胺(OPD)]显色液100μl/孔,37℃反应10 min,再加入2 mol H2SO4终止液,测定A490nm值。以正常小鼠血清为阴性对照,实验组/对照组≥2.1时判为阳性。
BCG组以PPD包被的ELISA板检测抗体效价及抗体亚型。检测抗体的IgG2a/IgG1亚型时,所有待测血清均以1∶100稀释,二抗则分别为1∶4000稀释的HRP-羊抗小鼠IgG2a或HRP-羊抗小鼠IgG1。其余步骤同抗体效价的测定。
2.脾淋巴细胞的分离制备:免疫结束后4周,将小鼠颈部脱臼处死,无菌取脾脏,置于200目铜网上,以注射器针芯研磨,加入Hanks液2 ml冲洗。将上述细胞悬液缓慢加入4 ml的小鼠脾淋巴细胞分离液上,8000×g离心20 min。吸取中间的白膜层(单个核细胞层),用RPMI-1640液洗涤2次后,计数备用。
3.脾淋巴细胞的增殖实验:用RPMI-1640完全培养液将分离的各组小鼠脾淋巴细胞浓度调整至5×105/ml,在96孔板中培养,200μl/孔。pcDNARv1733c质粒DNA组的抗原刺激组(实验孔)每孔加入50μl纯化的Rv1733c蛋白(50 mg/L溶于RPMI-1640培养液)刺激,BCG组实验孔加入50μl的PPD(25 mg/L)刺激,生理盐水组实验孔加入纯化的Rv1733c蛋白,所有组的阴性对照孔均不加蛋白刺激,调零孔不加脾淋巴细胞,各孔均设3个复孔。37℃5%CO2孵箱培养68 h后,加MTS[3-(4,5-diethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-etrazolium,inner salt](四氮唑蓝盐化合物)20μl/孔(5 mg/ml,溶于PBS,p H值为7.2,过滤除菌),继续培养4 h后终止培养,加10%十二烷基硫酸钠(SDS)25μl/孔,测定A490nm值。
4.脾淋巴细胞分泌IFN-γ的ELISPOT检测:IFN-γ检测的ELISPOT 96孔板为预包被板,不需特殊处理,于实验当日以无菌PBS 200μl/孔洗涤4次,10%胎牛血清(FCS)RPMI-1640培养液200 μl/孔,室温孵育封闭30 min后即可用于检测。将计数好的细胞悬液调整为5×106/ml,按100μl/孔的量分别加入到96孔板中,每个处理做2个复孔。在96孔板中同时加入50μl刺激物,并于37℃孵箱孵育,其中特异性刺激蛋白Rv1733c和PPD终浓度为25μg/ml,非特异刺激物ConA的终浓度为5μg/ml,阴性对照加入10%FCS RPMI-1640培养液50μl/孔。将96孔板置于5%CO2培养箱37℃孵育48 h后以4℃的去离子水裂解细胞,PBS 200μl/孔洗涤平板4次。加入以0.5%FCS PBS稀释的生物素标记抗体(R4-6A2-biotin)1μg/ml,100μl/孔,室温孵育2 h。PBS洗涤3次后加入含0.5%FCS的PBS所稀释的Streptavidin-ALP(1∶1000),100μl/孔,室温孵育1 h。PBS洗涤后加入BCIP底物液,底物使用前用直径0.45μm滤器滤除杂质,100μl/孔,显色直至有清晰斑点出现,清水轻柔冲洗96孔板正反两面;避光晾干,斑点计数。
5.脾淋巴细胞CD4+T细胞/CD8+T细胞计数:取100μl细胞浓度为1×105/ml各组小鼠脾淋巴细胞,加入荧光标记的CD4:FITC/CD8:RPE单抗10μl,充分混匀于室温避光孵育染色30 min。8000×g离心20 min,洗涤液洗涤2次,弃上清,加入终浓度2%的多聚甲醛固定液500μl重悬细胞,流式细胞仪检测。
6.脾淋巴细胞特异性细胞毒性 T淋巴细胞(cytotoxic T lymphocytes,CTL)活性检测:CTL检测采用乳酸脱氢酶(LDH)方法。以上述方法中制备的pcDNA-Rv1733c重组质粒转染P815细胞的稳定表达系作为靶细胞,以本室前期保存的P815-Hsp65稳定转染细胞系作为测定BCG免疫小鼠脾淋巴细胞CTL活性的靶细胞。以各组小鼠脾淋巴细胞作为效应细胞。具体实验步骤参见Promega公司的CTL检测试剂盒说明书。
(四)统计学分析
结 果
一、pcDNA-Rv1733c重组质粒制备的结果
1.Rv1733c真核表达载体的构建:采用限制性酶切的方法将Rv1733c目的基因从质粒p MD-18TRv1733c中亚克隆入真核表达载体pcDNA3.1(-)中,并进行酶切鉴定,结果表明,所构建的重组载体能够特异性切出大小为633 bp的基因片段,与预期大小一致,表明成功构建了Rv1733c基因的真核表达载体,阳性克隆命名为pcDNA-Rv1733c(图1)。
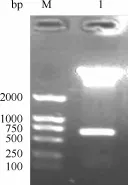
M:DNA分子量标准;1:pcDNA-Rv1733c质粒的双酶切产物图1 pcDNA-Rv1733c的酶切鉴定
2.pcDNA-Rv1733c稳定转染P815细胞系的建立:结果如图2所示,在pcDNA-Rv1733c稳定转染的P815细胞胞质中可见到有较强的特异性免疫荧光;而未转染的空白P815细胞中,整个细胞全部被Evans blue染成红色,没有特异性绿色荧光出现。表明所筛选的pcDNA-Rv1733c质粒转染P815细胞系可稳定表达Rv1733c蛋白。
二、免疫小鼠的免疫学特性检测结果
(一)特异性抗体及其亚型的比例检测
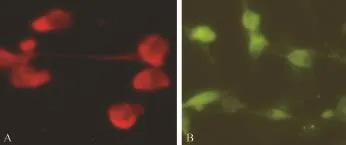
图2 pcDNA-Rv1733c稳定转染P815细胞系中的Rv1733c的IFT检测
1.ELISA法检测各组小鼠的特异性抗体水平:pcDNA-Rv1733c质粒DNA组小鼠的抗体效价均随着免疫时间及次数的增加持续增高,在第3次免疫后2周左右抗体水平达到最高,效价为1∶1600,但抗体水平(A492=0.67±0.13)低于BCG免疫组小鼠的抗体水平(A492=0.91±0.05)(t=3.184,P<0.05)(图3)。
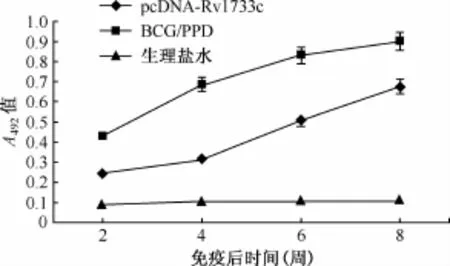
图3 免疫小鼠血清抗体水平
2.ELISA法检测小鼠抗体亚型IgG2a/IgG1的比值:pcDNA-Rv1733c质粒DNA组和BCG组小鼠在初次免疫后2周抗体亚型均以IgG2a为主,此后随免疫次数及免疫时间的延长,IgG2a逐渐降低,IgG1逐渐增高,二者逐渐达到一个平衡的状态(图4)。
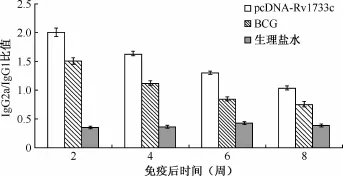
图4 小鼠体内抗体亚型IgG2a/IgG1的比值分析
(二)脾淋巴细胞的免疫学特性检测结果
1.MTS法检测各组小鼠的脾淋巴细胞特异性增殖:结果表明,pcDNA-Rv1733c质粒DNA组小鼠脾淋巴细胞在Rv1733c蛋白的特异性刺激下可发生特异性增殖,增殖指数(SI)为(2.00±0.36),高于BCG组小鼠脾淋巴细胞在Rv1733c蛋白刺激下的SI(1.1±0.06)(t=3.096,P<0.05),但低于PPD蛋白刺激下的BCG组小鼠脾淋巴细胞SI(2.6± 0.17)(t=4.154,P<0.05)(图5)。
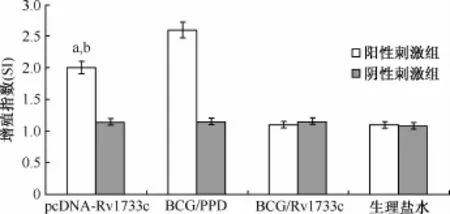
图5 小鼠脾淋巴细胞的特异性增殖实验
2.ELISPOT法检测各组小鼠脾淋巴细胞特异性分泌IFN-γ的水平:pcDNA-Rv1733c质粒DNA组小鼠脾淋巴细胞特异性分泌IFN-γ的细胞频数[斑点形成细胞(spot forming cells,SFC)]为(41.48± 5.30)SFC/106,高于生理盐水组的(2.75±1.37)SFC/106(t=4.752,P<0.05)和Rv1733c蛋白刺激下的BCG免疫组小鼠的(7.25±2.82)SFC/106(t= 3.151,P<0.05),但明显低于PPD蛋白刺激下的BCG免疫组小鼠的IFN-γ细胞频数(104.25± 6.72)SFC/106(t=5.841,P<0.01)(图6)。
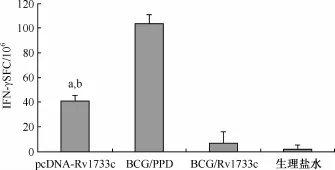
图6 ELISPOT检测各组小鼠特异性分泌IFN-γ的脾淋巴细胞频数
3.流式细胞仪检测各组小鼠脾淋巴细胞中CD4+和CD8+T细胞所占比率(%):结果如图7所示,pcDNA-Rv1733c质粒DNA组小鼠脾淋巴细胞中CD4+和CD8+T细胞所占比率分别为(18.15± 2.30)%和(7.68±1.34)%,低于BCG组小鼠的各类细胞所占比率[(35.82±1.79)%(t=3.571,P<0.05)和(18.82±0.79)%(t=2.864,P<0.05)],与生理盐水组相比差异无统计学意义[(16.43±2.02)%(t=0.571,P>0.05)和(7.32± 0.42)%(t=0.234,P>0.05)]。
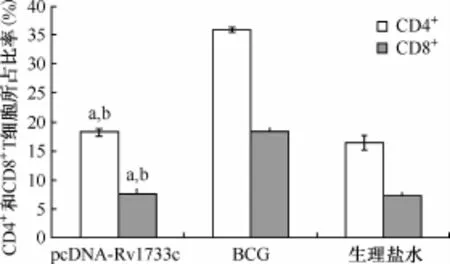
图7 小鼠脾淋巴细胞中CD4+T和CD8+T细胞所占比率
4.LDH法检测各组小鼠脾淋巴细胞的CTL杀伤效应:结果如图8所示,当效靶比为100∶1时,pcDNA-Rv1733c质粒DNA组小鼠脾淋巴细胞的CTL杀伤活性为(29.52±1.96)%,低于BCG诱导的小鼠脾淋巴细胞CTL杀伤活性(51.56± 2.93)%(t=4.234,P<0.05),与生理盐水组比较差异无统计学意义(25.28±2.51)%(t=0.726,P>0.05)。
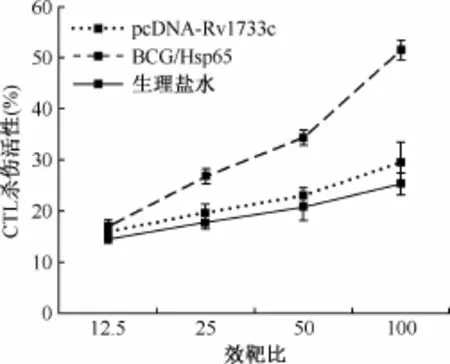
图8 小鼠脾淋巴细胞CTL杀伤活性
讨 论
结核病DNA疫苗不仅可以作为治疗性疫苗,也可以作为预防性疫苗的加强型疫苗[8]。其中最重要的是其不仅可以诱导针对相应抗原的体液免疫应答,还可以产生持久的Th1细胞免疫应答。Th1型CD4+T细胞可以分泌IFN-γ、IL-2等细胞因子发挥保护性免疫应答,CD4+T细胞可以直接识别并杀伤表达相应抗原的靶细胞,并通过分泌IFN-γ等达到抗Mtb感染的免疫保护效应。因此特异性的CTL应答,对于识别、杀伤和清除寄生于巨噬细胞内的Mtb非常有意义,也是一个良好的防治TB新型疫苗所必需的[9]。
研究发现Mtb在潜伏感染期主要以休眠菌状态存在,Mtb休眠菌可特异性表达与其休眠相关的抗原,这些抗原对Mtb在体内的潜伏感染和持续存活具有重要意义。Rv1733c是TB患者外周血T细胞能够识别较强的一个 Mtb休眠相关抗原,且该抗原能够明显刺激TB患者T淋巴细胞释放IFN-γ。因此,本研究构建了Rv1733c的真核表达载体,并评价其作为DNA疫苗的免疫学特性。实验结果显示,将构建的真核表达载体pcDNA-Rv1733c转染到P815细胞后,经G418的克隆化筛选,转染的P815细胞胞质内能够利用Rv1733c蛋白免疫小鼠血清稳定检测到Rv1733c蛋白的表达,表明Rv1733c的真核表达载体构建成功。
将pcDNA-Rv1733c重组质粒DNA免疫小鼠,检测免疫小鼠的体液和细胞免疫应答。实验结果显示Rv1733c的DNA疫苗在免疫小鼠后第2周起即可检测到Rv1733c的特异性抗体,且抗体水平随免疫次数的增加及时间延长而增高,并在第3次免疫后2周抗体水平达到最高,效价为1∶1600,但Rv1733c的DNA疫苗免疫小鼠产生的抗体水平低于BCG免疫组小鼠的抗体水平(P<0.05)。抗体亚类检测结果表明,DNA疫苗和BCG免疫小鼠血清中IgG2a和IgG1的抗体亚类均是在免疫初始以IgG2a为主(Th1型免疫应答的特异性标志之一),但随着免疫时间延长,IgG2a水平逐渐下降,并趋于IgG2a/IgG1平衡的状态。上述结果说明Rv1733c 的DNA疫苗在小鼠体内能够刺激产生特异性体液免疫应答,但免疫原性较弱,且刺激产生的Th1型免疫反应不持久,免疫原性不及BCG。
免疫小鼠的细胞免疫应答检测结果显示,与生理盐水对照组相比,Rv1733c的DNA疫苗免疫小鼠的脾淋巴细胞经Rv1733c抗原特异性刺激后能够发生明显的特异性的淋巴细胞增殖(P<0.05),特异性分泌IFN-γ的水平高于生理盐水组(P<0.05),但脾淋巴细胞中的CD4+和CD8+T细胞的百分比、CTL的特异性杀伤活性均与生理盐水组差异无统计学意义(P>0.05)。表明Rv1733c的DNA疫苗在小鼠体内虽能刺激产生细胞免疫应答,但细胞免疫应答并不强烈。然而值得注意的是,BCG免疫组小鼠各项细胞免疫应答指标虽均高于Rv1733c的DNA疫苗免疫小鼠(P<0.05),然而BCG免疫组小鼠的脾淋巴细胞在Rv1733c抗原的特异性刺激下并无特异性反应,与生理盐水组相比差异无统计学意义(P>0.05),表明BCG免疫过程中并不能诱导机体产生针对 Mtb休眠相关抗原Rv1733c特异性免疫反应,此结果与文献报道相一致[5],再次说明BCG保护效果不理想的可能原因之一是无法诱导机体产生针对Mtb休眠相关抗原保护性免疫反应。前期多篇文献报道表明在持续感染小鼠模型及持续感染人群中,Rv1733c是Mtb休眠相关抗原中能被识别最高频率的一个抗原,且可引起相应的强烈的T细胞免疫应答[10],然而本实验中Rv1733c DNA疫苗诱导的细胞免疫应答相对较弱,分析其中原因,可能与免疫途径、佐剂以及实验动物等诸多因素相关。Bivas-Benita[11]等的实验也正好表明了这一点,作者通过改变免疫途径以及免疫佐剂,可以有效提高Rv1733c的质粒DNA的细胞免疫应答,取得较好的结果。这也从另一方面表明,免疫途径、免疫佐剂等免疫策略对DNA疫苗免疫效果的影响是十分重要的。
结核病既是感染性疾病,又是一种免疫性疾病,疫苗用于结核病的免疫治疗是一个新的探索领域。Mtb休眠菌是Mtb在体内持留存在,化疗药物难以清除的主要原因,并成为结核病复发和传染的主要来源。因此,对 Mtb休眠相关抗原的免疫学特性的深入研究,对于控制 Mtb的潜伏感染、预防发病及其用于结核病的免疫治疗中均具有重要研究意义。
[1]World Health Organization.Tuberculosis[EB/OL].Geneva:WHO,2013[2013-04-18].http://www.who.int/mediacentre/factsheets/fs104/en/index.html.
[2]Voskuil MI.Mycobacterium tuberculosis gene expression during environmental conditions associated with latency.Tuberculosis (Edinb),2004,84(3/4):138-143.
[3]Muttucumaru DG,Roberts G,Hinds J,et al.Gene expression profile of Mycobacterium tuberculosis in a non-replicating state. Tuberculosis(Edinb),2004,84(3/4):239-246.
[4]Leyten EM,Lin MY,Franken KL,et al.Human T-cell responses to 25 novel antigens encoded by genes of the dormancy regulon of Mycobacterium tuberculosis.Microbes Infect,2006,8 (8):2052-2060.
[5]Lin MY,Geluk A,Smith SG,et al.Lack of immune responses to Mycobacterium tuberculosis DosR regulon proteins following Mycobacterium bovis BCG vaccination.Infect Immun,2007,75 (7):3523-3530.
[6]Black GF,Thiel BA,Ota MO,et al.Immunogenicity of novel DosR regulon-encoded candidate antigens of Mycobacterium tuberculosis in three high-burden populations in Africa.Clin Vaccine Immunol,2009,16(8):1203-1212.
[7]张薇,柏银兰,康健,等.结核分枝杆菌持续感染期抗原Rv1733c的表达、纯化和鉴定.现代生物医学进展,2012,12(10):1868-1871.
[8]吴雪琼.新型结核病疫苗的研究现状与发展趋势.中国防痨杂志,2012,34(3):133-137.
[9]Huygen K.On the use of DNA vaccines for the prophylaxis of Mycobacterial diseases.Infect Immun,2003,71(4):1613-1621.
[10]Roupie V,Romano M,Zhang L.Immunogenicity of eight dormancy regulon-encoded proteins of Mycobacterium tuberculosis in DNA-vaccinated and tuberculosis-infected mice.Infect Immun,2007,75(2):941-949.
[11]Bivas-Benita M,Lin MY,Bal SM,et al.Pulmonary delivery of DNA encoding Mycobacterium tuberculosis latency antigen Rv1733c associated to PLGA-PEI nanoparticles enhances T cell responses in a DNA prime/protein boost vaccination regimen in mice.Vaccine,2009,27(30):4010-4017.
Construction and immunogenicity of the DNA vaccine of dormancy related antigen Rv1733c of Mycobacterium tuberculosis
DUAN An-hu*,ZHANG Wei,BAI Yin-lan,KANG Jian,WANG Rui,XU Zhi-lai,WANG Li-mei.*Shaanxi Research Institute for Tuberculosis Prevention and Control,Xi'an 710048,China
WANG Li-mei,Email:limwang@tom.com
Objective To construct DNA vaccine of dormancy related antigen Rv1733c of Mycobacterium tuberculosis(Mtb),and to evaluate its immunogenicity in mice.Methods Rv1733c gene was cloned into the eukaryotic expression vector pcDNA 3.1(-)from the plamid p MD-18T-Rv1733c,which was constructed previously and preserved in our lab.The constructed plasmid was named pcDNA-Rv1733c.P815 cells were stably transfected with the plasmid pcDNA-Rv1733c,and were detected the protein expression of Rv1733c by indirect immunofluorescence (IFT).The mice BALB/c were divided randomly into three groups named pcDNA-Rv1733c DNA,saline and BCG,10 mice per group.The mice were immunized with pcDNA-Rv1733c DNA or saline intramuscularly 3 times at an interval of 2 weeks.BCG was immunized subcutaneously only once.The antigen specific antibody level and IgG2a/ IgG1 subtype ratio in immunized mice were detected by ELISA every 2 weeks.At 8 weeks after the first immunization,the specific proliferation of spleno-lymphocytes of mice was detected by MTS[3-(4,5-diethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-etrazolium,inner salt]method,and IFN-γsecreted by splenolymphocytes was detected by ELISPOT.The percentages of CD4+and CD8+T cells in spleno-lymphocytes were analyzed by flow cytometry,and the function of cytotoxicity T lymphocyte(CTL)was detected by lactate dehydrogen-ase(LDH)assay.Results The eukaryotic expression plasmid of Rv1733c gene was successfully constructed,named pcDNA-Rv1733c.In P815 cells stably transfected with pcDNA-Rv1733c plasmid,the expression protein of Rv1733c could be stably detected by IFT.In immunized mice,the pcDNA-Rv1733c plasmid could stimulate the production of the antigen specific antibody,and the antibody subtype biased to IgG2a,but with the extension of immunization time,the ratio of IgG2a/IgG1 was tended to balance.In pcDNA-Rv1733c DNA group,the stimulation index of spleno-lymphocytes was(2.00±0.36),and the cell number of secreted IFN-γwas(41.48±5.30)SFC/106,which were both statistically higher than those in saline group(t=3.096,P<0.05).However,the percentages of CD4+and CD8+T cells[(18.15±2.30)%and(7.68±1.34)%],and the activity of CTL[(29.52±1.96)%]were not significantly different with those in saline group(t=0.571,P>0.05).Conclusion The eukaryotic expression plasmid of Rv1733c was constructed successfully.The pcDNA-Rv1733c plasmid DNA could induce specific humoral and cellular immunity in mice.It may be used as the new TB vaccine against latent Mtb infection.
Mycobacterium tuberculosis; Antigens,bacterial; Vaccines,DNA; Antibody formation;Immunity,cellular
2013-07-08)
(本文编辑:薛爱华)
“十二五”国家科技重大专项(2012ZX10003008-007);国家自然科学基金(30801055)
710048西安,陕西省结核病防治研究所(段安虎、王瑞);第四军医大学唐都医院儿科(张薇);第四军医大学微生物学与病原生物学教研室(柏银兰、康健、徐志凯、王丽梅)
王丽梅,Email:limwang@tom.com
