一种用于海水处理的微生物絮凝剂ETYBF
2013-07-19郝建安姜天翔张秀芝张晓青张爱君张雨山
郝建安,杨 波,姜天翔,张秀芝,张晓青,张爱君,王 静,张雨山
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
一种用于海水处理的微生物絮凝剂ETYBF
郝建安,杨 波,姜天翔,张秀芝,张晓青,张爱君,王 静,张雨山*
(国家海洋局天津海水淡化与综合利用研究所,天津 300192)
自渤海湾分离到一株对海水有高絮凝活性的菌株,鉴定并命名为黑曲霉ETYB-13。该菌株发酵上清液经乙醇沉淀与冷冻真空干燥,获得微生物絮凝剂ETYBF。该菌株的絮凝活性曲线证实,在培养48~72 h之间,是收集絮凝剂的最佳时间。化学定性实验显示,ETYBF的主要成分为多糖。紫外光谱与红外光谱也确定ETYBF主要成分为多糖。凝胶渗透色谱(GPC)证实,ETYBF是一种混合物,且分子量在105Da以上。稳定性实验证实,ETYBF的活性不受环境温度与pH变化的影响。
海水水质处理;微生物絮凝剂ETYBF;多糖
絮凝剂是一类常用的水处理试剂,可以将水中的固体、胶体以及微生物等沉降,从而达到净水要求。截至目前,已开发出多种絮凝剂,无机絮凝剂与有机絮凝剂是主要的絮凝剂类型。然而,无机絮凝剂与有机絮凝剂在使用中都发现了一些问题,如残留离子,易引起“三致”效应等。鉴于这两种絮凝剂存在的缺点,生物絮凝剂,这种被认为安全、无污染的新型絮凝剂成为研究的热点[1]。
微生物絮凝剂是由微生物产生的一种生物絮凝剂,是最具应用价值的生物絮凝剂。1986年,日本学者Ryuichiro等发现了红平红球菌(Rhodococcus erythropolis)可产微生物絮凝剂NOC-1,可对水中的有机与无机成分有絮凝作用[2]。2003年,Deng等自土壤样品中分离到具备絮凝活性的胶质芽孢杆菌,该菌株可以产生微生物絮凝剂MBFA9。MBFA9在0.1 mL/L的浓度下就可对高岭土悬液获得99.6%的絮凝率[3]。2005年,Deng等再次报道了寄生曲霉可以产生微生物絮凝剂,该絮凝剂可以对水溶性染料产生高絮凝活性[4]。2007年,Yim等发现一种沟鞭藻类,螺旋藻KG03可以产生具有絮凝活性的胞外多糖[5]。陆续报道的具有絮凝活性的微生物已经涵盖细菌、真菌以及藻类等。微生物絮凝剂在很多行业都有较大的应用潜力。
近年来,海水利用已经成为新兴的产业。海水水质决定了海水利用的效率。絮凝剂在海水水质处理中的应用必不可少。虽然市面上有较多絮凝剂,但专用于海水处理的微生物絮凝剂还没有,关于黑曲霉产生用于海水处理的微生物絮凝剂还未见报道。
本文研究了一种分离自黑曲霉ETYB-13,对海水具有絮凝活性的微生物絮凝剂。我们研究了该菌株的絮凝活性分布与絮凝活性曲线,并通过乙醇沉淀与冷冻真空干燥将该絮凝活性成分制成粉末状微生物絮凝剂ETYBF,并对其性质进行了研究。
1 试验部分
1.1 菌种
原始水样采集自渤海湾,菌种通过梯度稀释法与划线法分离。通过絮凝活性检测来筛选絮凝活性菌株。
1.2 培养基
真菌培养基∶葡萄糖20 g,酵母抽提物0.5 g,NH4Cl 0.8 g,MgSO4·7H2O 0.5 g,KH2PO42 g,CaCl20.5 g,蒸馏水补足 1 L,pH 7.0,115℃,25 min。
1.3 絮凝活性检测
絮凝活性试验采用改进的高岭土法[6],在150 mL的烧杯中加入93 mL陈海水,0.4 g高岭土,5 mL1%(W/V)CaCl2溶液以及2 mL培养液。200 r/min搅拌2 min,静置5 min,测定其上清液在波长550 nm处的吸光度(以A表示)。同时以蒸馏水代替培养液进行絮凝活性试验,其上清液在550 nm处的吸光度(以B表示)为对照。
絮凝率 =(B-A)/B×l00%。
1.4 菌种鉴定
真菌菌株基因组的提取参照Weiland所述方法[7],选用通用引物NS1 5'-GTAGTCATATGCTTGTCTC-3'和NS8 5'-TCCGCAGGTTCACCTACGGA-3'[13]扩增18S rRNA基因。PCR 反应体系(25 uL):基因组 DNA 2 uL,引物各 10 pmol,10×PCR Buffer2.5 uL,Mg2+1.5 uL,dNTP2 uL,rTaq 3uL,ddH2O补足。反应条件:95 ℃,5 min;94 ℃,1 min,54 ℃,1 min,72 ℃,2 min,30 cycle;72 ℃,10 min;4 ℃ pause。PCR 产物纯化回收,与pMD18-T载体连接(16℃过夜)。连接产物转化E.coliDH5α感受态细胞,蓝白斑筛选,PCR鉴定。阳性克隆子委托上海生物工程公司测序,测序结果在GenBank中比对分析。形态学观察为平板培养形态观察结合显微镜下观察。
1.5 絮凝活性定位
接种菌种于100mL液体培养基,30℃,180rpm培养48h;收集培养物。此时的培养物既含有细胞也含有发酵产物,为后续实验保留部分。培养物经4℃,12 000 rpm,离心30 min,进行固液分离,此时获得的液体即发酵上清液,已经除去了原有的细胞,只含有发酵产物。收集菌体,用10 mMTris.HCl(pH8.0)溶液反复清洗后重新溶解,形成细胞悬液。细胞悬液在功率500 W,以10 s为间隔,超声破碎30 min,于4℃,12 000 rpm,离心10 min,去除沉淀,所获得的细胞破碎产物溶液只包含细胞成分不包括发酵产物。培养物,发酵上清液,细胞破碎产物进行絮凝活性检测。
1.6 絮凝活性曲线
5 mL液体培养基活化菌种,30℃,180 rpm培养24 h。取20支试管,每管中含5 mL液体培养基,按1∶100比例接种菌液,30℃,180 rpm培养。每隔24 h,取2 mL培养物,4℃,12 000 rpm,离心5 min,所得上清液进行絮凝活性检测,记录絮凝率。剩余3 mL培养物,4℃,12 000 rpm,离心10 min除去发酵液,称重,记录数据作为生物量。以培养时间为横轴,以生物量和絮凝率为纵轴,绘制絮凝活性曲线。
1.7 ETYBF的制备
接种菌种于500 mL液体培养基,30℃,180 rpm,振荡培养48~72 h,培养物经过滤除去菌丝体。4℃,12 000 rpm,离心30 min进行固液分离,收集发酵上清液。在0℃条件下,向发酵上清液中加入2倍体积冰乙醇,轻微搅拌混匀。此溶液冰浴静置3 h后,4℃,12 000 rpm,离心10 min,保留沉淀。沉淀控干并溶于5 mL双蒸水中,冷冻真空干燥即获得微生物絮凝剂ETYBF。
1.8 ETYBF成分分析
进行糖类(Molish反应,蒽酮反应)、蛋白类(茚三铜反应,双缩脲反应)、脂类(苏丹III染色)、以及核酸类(苔黑酚反应,二苯胺反应)定性反应,初步确定絮凝活性物质种类。
在190~500 nm进行紫外扫描,4 000~400 cm-1进行红外扫描,验证定性实验结果。
1.9 ETYBF分子量的确定
ETYBF溶于双蒸水,使用0.45 μm滤膜过滤。反应温度为40℃,反应压力为1.5 MPa。样品注入流速为0.5 mL/min。所用柱子为TosohTSKgelG4000PWXL,7.8mm×300mm。标准品为 BlueDextran(MW>2×106):Dextran T-70,Dextran T-40。
1.10 ETYBF稳定性研究
取粉末状絮凝活性产物,配成2 mg/mL溶液,进行絮凝活性试验。将反应环境pH在2~12范围内以1为间隔调节,观察絮凝活性变化。将反应环境温度在0℃、20℃、30℃、37℃、65℃、80℃、100℃条件下改变,观察絮凝活性变化。
2 结果与讨论
2.1 黑曲霉ETYB-13的分离与鉴定
通过稀释法、平板划线法与絮凝活性筛选,发现真菌ETYB-13絮凝率一直在80%左右,活性较高且稳定,因此选取此株菌作为后续试验的研究对象。ETYB-13菌株的18S rDNA扩增出约1 728 bp长的片段,在Genbank中的比对结果见表1。

表1 ETYB-13 18S rRNA在Genbank数据库中比对分析
18 S rRNA是真核生物核糖体40S亚基的组成部分,其进化速率较慢,因此是作为菌种鉴定较好的分子标尺[8]。ETYB-13的18S rRNA基因序列在Genbank中比对后发现其与Aspergillus niger D63697.1菌株的相似性最大,达到99%。菌株ETYB-13 18S rDNA在Genbank中的注册号为GQ903338。
将ETYB-13在固体平板上进行培养,结果见图1。

ETYB-13在固体培养基平板上培养36~48 h后,菌落初具规模。菌落初期白色,然后变为黄色。菌落外观干燥,不透明,呈现较疏松的丝绒状,中央凸起,有放射状沟纹。菌落与培养基间的连接紧密,不易挑起。生长后期,孢子囊呈黑色粒状,菌落背面呈淡黄色,菌落周围出现透明圈。在显微镜下,ETYB-13菌株分生孢子梗直立生长,无隔,不分枝,淡褐色,粗糙,顶端膨大成近球形的泡囊,黑褐色。表面长满小梗,黑色。分生孢子呈椭圆形或近圆形,着生于小梗顶端,串生。
结合形态学观察,最终确定ETYB-13菌株为黑曲霉,命名为黑曲霉 ETYB-13(Aspergillus niger ETYB-13)。
2.2 絮凝活性定位
培养物,发酵上清液,细胞破碎产物进行絮凝活性检测,结果见图2。
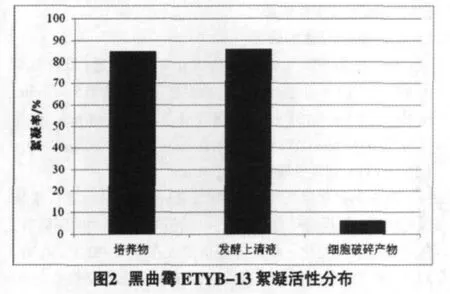
图2显示,黑曲霉培养物与发酵上清液的絮凝活性均达80%以上,而细胞破碎产物的絮凝活性低于10%,因此可以肯定该菌株产生的絮凝活性产物主要存在于发酵上清液中。
微生物絮凝剂的来源主要有两类,一类来自于微生物本身,某些细菌、霉菌、放线菌和酵母等本身就可以产生絮凝效果,从微生物细胞壁也可以提取絮凝剂,如葡聚糖、蛋白质和N-乙酰葡萄糖胺等成分。另一类来自于微生物细胞代谢产物,此类成分范围较广,包括多糖、多肽、蛋白质、脂类及其复合物等[9]。本研究发现该菌的絮凝活性主要存在于发酵上清液中,可以判断其絮凝活性成分是细胞代谢产物,这为后续絮凝活性成分的提取提供了依据。
2.3 絮凝活性曲线

以培养时间为横坐标,以絮凝率和生物量为纵坐标,绘制黑曲霉ETYB-13絮凝活性曲线,结果见图3。
图3显示,菌株生长状态与絮凝活性几乎同步,78 h菌株生物量最大,证明其生长达到顶峰。培养时间在48~72 h之间,菌株絮凝率都在90%以上,其中培养54 h,菌株絮凝率最高达到94.3%。
真菌在延滞期中,由于刚刚接种到培养基,其代谢系统需要适应新的环境,同时要合成酶、辅酶、其他代谢中间代谢产物等,所以此时期,生长速率常为零,也没有活性代谢产物产生。进入快速生长期,经过调整期的准备,此时期的真菌生长已具备足够的物质基础,同时外界环境也是最佳状态。真菌生长速率最快,代谢旺盛,酶系活跃,产生大量活性代谢产物。进入生长衰退期,外界环境对真菌的继续生长越来越不利,细胞的分解代谢大于合成代谢。大量微生物死亡,死亡速度大于新生速度,整个群体出现负增长,细胞开始畸形,自溶死亡,活性代谢产物亦随之消亡。
2.4 ETYBF成分分析
定性实验显示,除molish反应与蒽酮反应为阳性以外,其他反应均为阴性,因此可初步确定ETYBF的主要成分为多糖。紫外光谱扫描显示,ETYBF的最大吸收峰在201 nm,此处是某些多糖的特征吸收峰。红外光谱扫描显示,ETYBF有两组峰。在3 284 cm-1附近的宽峰代表了羟基基团;在1 000~1 100 cm-1附近的一系列吸收峰是某些糖类衍生物的特征峰。结合上述实验结果,可判定ETYBF的活性成分为多糖。
微生物絮凝活性产物,主要为结构复杂的高分子物质,大多为多糖类和蛋白质类物质。如Alcaligenes cupidus KT201代谢产生的Al-201即是一种由葡萄糖、乳糖、葡萄醛酸和乙酸(摩尔比为 6.34∶5.55∶1.0)组成的微生物絮凝剂。Enterobacter sp.BY-29所产絮凝剂为酸性多聚糖。Paecilomyces sp I-1所产的PF-101是氨基半乳糖以α-1,4糖苷键相连而成的分子量大于3×105Da的粘多糖,其分子中80%是N-末端取代的半乳糖胺残基,8%为N-端乙酰化[10]。
2.5 ETYBF分子量的确定
ETYBF使用凝胶渗透色谱分析,结果见图4。
如图所示,黑曲霉ETYB-13絮凝活性产物的数均分子量 Mn=2.33×105Da,重均分子量Mw=4.30×105Da,多分数系数Mw/Mn=1.84,多分数系数大于1,说明絮凝活性产物是一种混合物。
截至目前,微生物絮凝剂报道最多的成分是蛋白质和多糖。而报道的多糖分子量都较高,因为根据现在较为流行的桥联絮凝机理,在絮凝过程中,高分子量意味着该分子有更多的吸收位点,从而具有更高的架桥能力,最终形成较高的絮凝能力[11]。ETYB-13的絮凝活性产物,根据凝胶渗透色谱结果,推测其分子量在105Da数量级,符合上述观点。同时凝胶渗透色谱证实,该絮凝活性产物为混合物。
2.6 ETYBF稳定性研究
对ETYBF的pH与温度稳定性进行探讨,结果见图5。
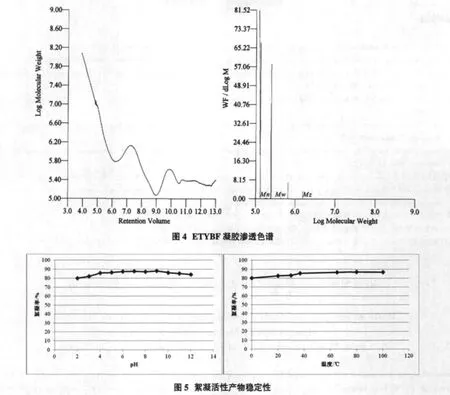
图中显示,ETYBF不受环境酸碱性变化与温度变化的影响,改变pH与温度,絮凝活性产物的絮凝率都不低于80%。
酸碱度的变化会影响微生物絮凝剂及其被絮凝物表面电荷、带电状态及中和电荷的能力。在一定的pH值范围内,微生物絮凝剂表现出良好的絮凝活性。不同的絮凝剂对pH值变化所表现的效果也不一样,同种絮凝剂对不同的被絮凝物具有不同的pH初始值要求。本研究中,ETYBF保持活性的反应环境pH范围很广,对环境酸碱度要求不高。
反应环境温度也会影响絮凝效率。适当提高温度可提高溶液中粒子运动的速度,增加粒子间碰撞的几率,从而提高絮凝率。但当温度过高,性质不稳定的高分子物质空间结构改变,导致变性,从而使絮凝活性下降。在本研究中,ETYBF有较好的温度稳定性。
综上所述,ETYBF成分较稳定,因此其储存与应用都较为方便。
3 结论
使用稀释平板法、划线分离法与絮凝活性实验联合,从海水样品中筛选出一株高絮凝活性真菌。经18S rDNA鉴定与形态学观察,确定为黑曲霉。絮凝活性分布实验证实其絮凝活性产物仅存在于发酵上清液中。该菌株在培养72 h达到生物量最大,并在54 h絮凝活性达到最高。经乙醇沉淀、冷冻真空干燥可获得该菌株絮凝活性产物ETYBF。对ETYBF性质进行研究,定性反应、紫外光谱与红外光谱同时证实其活性成分为多糖。凝胶渗透色谱显示ETYBF是一种混合物,且分子量在105Da数量级。稳定性实验发现,ETYBF的絮凝活性不易受环境温度与酸碱性变化的影响。
[1]ZhangT,Lin Zh.Microbial flocculant and its application in environmental protection[J].J Environ Sci,2009,11∶1-12.
[2]RyuichiroK,Kiyoshi T,TomooS.Screeningfor and characteristics ofmicrobial flocculants[J].Agric Biol Chem,1999,50∶2301-2307.
[3]Deng S B,Bai R B,Hu X M,et al.Characteristics of a bioflocculant produced by Bacillus mucilaginosus and its use in starch wastewater treatment[J].Appl Microbiol Biotechnol,2003,60∶588-593.
[4]Deng S,Yu G,Ting Y P.Production of a bioflocculant by Aspergillus parasiticus and its application in dye removal[J].Colloid Surface B 44,2005∶179-186.
[5]Yim J H,Kim S J,Ahn S H,et al.Characterization of a novel bioflocculant,p-KG03,from a marine dinoflagellate,Gyrodinium impudicum KG03[J].Bioresource Technol,2007,98(2)∶361-367.
[6]Zhang J,Liu Z,Wang S,et al.Characterization of a bioflocculant produced by the marine myxobacterium Nannocystis sp.NU-2[J].Appl Microbiol Biotechnol,2002,59∶517-522.
[7]Weiland J J.Rapid procedure for the extration ofDNAfromfungal spores and mycelia[J].Fungal Genet Newlet,1997,44∶60-63.
[8]Meyer A,Todt C,Mikkelsen N T,et al.Fast evolving 18S rRNA sequences from Solenogastres(Mollusca)resist standard PCR amplification and give newinsights intomollusk substitution rate heterogeneity[J].BMCEvol Biol,2010,10∶70.
[9] 李素清,柯水洲,袁辉洲,等.微生物絮凝剂的研究进展[J].净水技术,2008,27(1):5-8.
[10]徐美娟,胡惠仁,刘秋娟.环境友好絮凝剂-微生物絮凝剂[J].上海造纸,2004,35(1):52-55.
[11]周杰,张苓花,王运吉.产絮凝剂微生物的分离与鉴定及其絮凝剂特性[J].大连轻工业学院学报,2006,25(4):235-238.
New Microbial Flocculant ETYBF for Seawater Treatment
HAO Jian-an,YANG Bo,JIANG Tian-xiang,ZHANG Xiu-zhi,ZHANG Xiao-qing,Zhang Ai-jun,WANG Jing,ZHANG Yu-shan
(The Institute of Seawater Desalination and Multipurpose Utilization,SOA,Tianjin 300192,China)
Aspergillus niger ETYB-13 isolated from Bohai gulf has showed high flocculating activity toward seawater.Microbial flocculant ETYBF was isolated by ethanol precipitation and freeze-vacuum dry from fermentation supernatant of the strain.Flocculating activity curve of the fungi proved that the best time for collecting flocculants was between 48 h and 72 h.Chemical qualitative analysis of ETYBF suggested the main ingredients of ETYBF were acid polysaccharides.Ultraviolet(UV)spectrometry and Fourier-transform infrared(FTIR)spectrometry confirmed this conclusion.Gel permeation chromatography(GPC)showed ETYBF was a mixture.The molecular weight of ETYBF was also indicated above 105Da by GPC.Stability test showed the flocculating activity of ETYBF was not affected by changes of temperature and pH value.
seawater treatment;microbial flocculant ETYBF;polysaccharides
Q939.9
A
1003-2029(2013)01-0064-05
2012-10-25
海洋公益性行业科研专项资助项目(201105026);国家海洋局青年海洋科学基金资助项目(2010139);中央级公益性科研院所基本科研业务费专项基金项目团队项目(K-JBYWF-2011-T02)
郝建安(1981-),男,工程师,研究方向为海水净化与水再利用技术。Email:phoenix328@hotmail.com
张雨山(1962-),男,研究员,博士,研究方向为海水利用技术。Email:yushanzhang@hotmail.com
book=68,ebook=42
