毛细管电泳法表征多肽及糖蛋白的稳定性
2013-07-13汪勇高培峰赵新颖屈锋
汪勇,高培峰#,赵新颖,2,屈锋*
(1.北京理工大学生命学院,北京 100081;2.北京市理化分析测试中心,北京 100089)
定量蛋白质组学的绝对定量方法需要使用标准内标肽,内标肽的纯度和稳定性等性质影响定量方法的准确度和精确度。同时,蛋白质定量方法研究中也需要保证蛋白质样品的性质稳定和一致。由于多肽及蛋白质的不稳定性在很大程度上影响蛋白质的定量研究,因此快速、有效地评价和表征样品的稳定性是定量蛋白质组学深入研究应该解决的问题之一,样品稳定性也是定量蛋白质组学研究必须关注的基本内容。
血管紧张素II 是人体内重要的体液调节物质,对心血管功能稳定、电解质和体液平衡的维持、血压调节等方面均有重要作用[1]。血管紧张素II 作为标准内标肽和药用多肽时,其纯度、稳定性是质量优劣的关键指标。血管紧张素II的检测多采用高效液相色谱(HPLC)结合免疫化学方法[2]或放射性同位素检测[3]。也有基于高效液相色谱法研究物理和化学因素(如保存条件、温度、pH 值、缓冲溶液)对多肽稳定性的影响[4]。相比HPLC,毛细管电泳(CE)方法速度快,分辨率高,所需样品量少,已有多肽药物[5]和生物样品中血管紧张素及衍生物的分析报道[6],与毛细管电泳相关的毛细管电泳-质谱联用(CE-MS)[7-9]、毛细管电色谱(CEC)[10]方法也出现在一些多肽的分析中。
糖蛋白是生物体内重要的功能蛋白,也是修饰蛋白质组学的研究热点。作为定量蛋白质组学研究的基础,了解糖蛋白的稳定性是其相关研究的基础和前提。目前糖蛋白稳定性的研究重点主要是利用分子动力学模拟和物理化学参数变化研究其结构稳定性[11-13]。也有基于紫外光谱法针对特定生物体内所提取的蛋白质的含量变化进行稳定性表征的研究报道[14]。利用毛细管电泳分析与糖有关的糖蛋白、寡糖和糖肽已有综述报道[15,16]。
多肽和糖蛋白大多具有生物学活性,外界条件变化易于影响多肽和糖蛋白的结构,引起稳定性改变和分子的荷质比变化。毛细管电泳法可快速表征多肽和糖蛋白的分子的荷质比差异。在不同的外界条件下(如样品存放时间、温度、溶液pH),多肽和糖蛋白的电泳图谱的出峰个数、出峰时间以及峰形等参数可指示分子的表面电荷性质甚至分子结构的变化,从而可用于表征多肽和糖蛋白的稳定性。尽管已有较多针对多肽和糖蛋白的相关分析报道,但针对两类样品稳定性和影响因素的研究还没有较系统的报道。本文以市售血管紧张素II和植物血球凝集素、牛凝血酶、人凝血酶、辣根过氧化物酶4种糖蛋白为多肽和糖蛋白模式分子,利用毛细管电泳分析方法表征其稳定性。
1 实验部分
1.1 仪器与试剂
Beckman P/ACE MDQ 毛细管电泳系统,配备紫外(UV)检测器(美国Beckman Coulter 公司)。Agilent 7100毛细管电泳系统,配备二极管阵列检测器(DAD 检测器)(美国Agilent 公司)。
血管紧张素II(Ang II)是人工合成的DRVYIHPF 八肽,pI 6.94,纯度≥95%,购自上海强耀生物科技有限公司。植物血球凝集素(PHA,pI 5.4~6.5)、牛凝血酶(B-Thr,pI 5~8)购自Sigma Aldrich公司,人凝血酶(H-Thr,pI 5~8)购自Enzo Life Sciences 公司,辣根过氧化物酶(HRP,pI 3~9)购自ROCHE 公司。
硼酸、盐酸、氢氧化钠、氯化钠、柠檬酸和柠檬酸钠(北京化工厂),硼砂和磷酸氢二钠(国药集团化学试剂有限公司),磷酸氢二钠(北京化学试剂公司),Tris(北京拜尔迪生物技术有限公司),上述试剂均为分析纯,实验用水均为蒸馏水。
熔融石英毛细管购自凯利奥拉色谱分析(邯郸)有限责任公司。涂层毛细管购自河北邯郸开发区奥泰克生物科技有限公司。
1.2 毛细管电泳实验条件
多肽分析条件:Beckman P/ACE MDQ 毛细管电泳系统,进样压力3.45 kPa(0.5 psi),进样时间5 s;正向20 kV 分离,检测波长为280 nm;样品溶液用稀释后的电泳缓冲液配制。熔融石英毛细管(有效长度/总长:40 cm/50.2 cm,内径:75μm),两次实验间和实验结束后,依次用0.1 mol/L NaOH和H2O在172.37 kPa(25 psi)下冲洗5 min。毛细管不用时需将两端水封后置于室温下保存。
糖蛋白分析条件:Agilent 7100毛细管电泳系统,进样压力5 kPa,进样时间5 s;B-Thr的分析电压为-10 kV,其余3种糖蛋白均为-20 kV;检测波长为195 nm;样品溶液用0.2 mol/L(pH 7.4)硼酸盐缓冲液配制。涂层毛细管(有效长度/总长:25 cm/33.5 cm,内径:75μm),新毛细管在使用前分别用20 mmol/L H3PO4和H2O 各冲洗10 min,两次实验之间和实验结束后,依次用20 mmol/L H3PO4和H2O 冲洗5 min,毛细管不用时需将两端水封后置于4℃冰箱中保存。
2 结果与讨论
对人工合成的Ang II 进行纯度和稳定性分析。优化样品分析所需样品浓度、电泳缓冲液、样品溶液pH和离子强度等条件,并对样品的纯度进行表征,对保存温度和时间对样品溶液稳定性的影响进行讨论。分别考察了PHA、B-Thr、H-Thr和HRP 这4种糖蛋白在毛细管中的吸附性,在电泳中的荷电性质及迁移,以及保存温度和时间对4种糖蛋白样品溶液稳定性的影响。
2.1 Ang II 分析
2.1.1 样品浓度选择
准确称取Ang II 样品溶于水中,配制成60 g/L的母液,实验时稀释到所需浓度。考察样品浓度与峰面积之间的线性关系,如图1所示,Ang II 在0.03~0.24 g/L 质量浓度范围内线性关系良好。后续实验中所用质量浓度均为0.06 g/L,该浓度下样品的吸收值可满足对样品峰的观察和对比。
2.1.2 电泳缓冲液对分离的影响
电泳缓冲液种类和pH 是决定分离效果的关键因素之一。实验中考察了5种不同的缓冲体系:硼酸盐缓冲液、磷酸盐缓冲液、PBS 缓冲液、磷酸氢二钠-柠檬酸缓冲液和柠檬酸-柠檬酸钠缓冲液(配比见表1)对样品分析的影响(如图2a)。
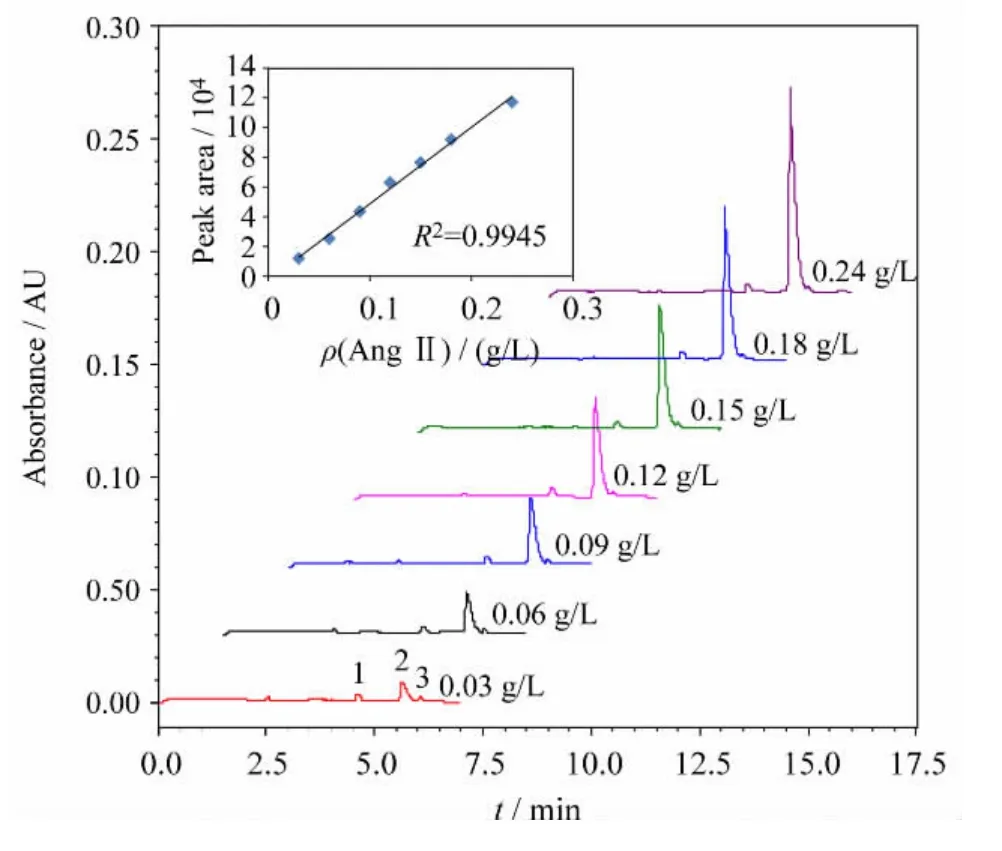
图1 Ang II 样品的电泳图及其峰面积与质量浓度的线性关系Fig.1 Electropherograms and linearity of the peak area and mass concentration of Ang II
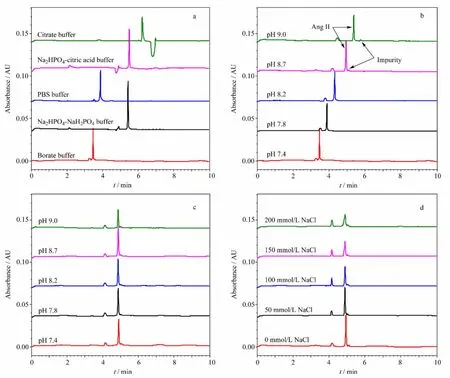
图2 (a)缓冲液种类、(b)硼酸盐缓冲液的pH、(c)样品溶液的pH和(d)样品溶液中离子强度对分离的影响Fig.2 Effects of(a)buffer type,(b)buffer pH,as well as(c)pH and(d)ionic strength of Ang II sample solution on separation
不同缓冲体系导致AngⅡ的迁移差异及负峰的出现。比较电泳图中样品峰的峰高和峰形,发现使用硼酸盐缓冲液、磷酸盐缓冲液、PBS缓冲液和磷酸氢二钠-柠檬酸缓冲液时,样品峰的峰形尖锐,峰高值大。而含有磷酸盐的后3者缓冲体系的电流值明显高于硼酸盐缓冲体系,故后续实验选择硼酸盐缓冲液为电泳缓冲液。考察了不同pH的缓冲液对目标峰和杂质峰的灵敏度和分离度的影响(图2b),可见pH 为8.7和9.0时杂质峰的检测最灵敏,且与目标峰分离度较好,对目标物的检测干扰最小,因此后续实验选择pH 9.0的电泳缓冲液。
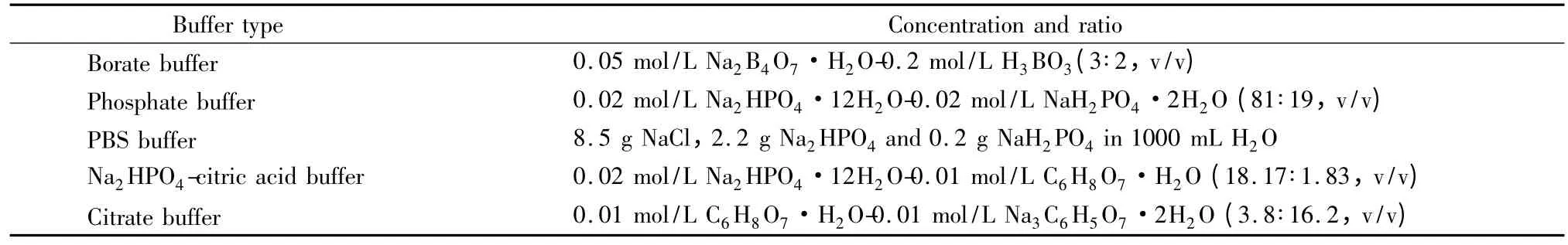
表1 实验用缓冲液及其浓度和配比Table 1 Buffer types,concentrations and ratios used in the experiments
2.1.3 样品溶液pH和离子强度对分离的影响
电泳过程中,待测样品会在低电导样品溶液与高电导电泳缓冲液的界面处发生堆积效应产生富集作用。当电泳缓冲液保持恒定时,样品溶液的pH和离子强度会对目标峰与杂质峰的分离产生影响。
Moring 等[17]的研究表明,样品溶液浓度为电泳缓冲液浓度的1/10时,样品的浓缩效果最好。故在pH 9.0硼酸盐缓冲液(0.2 mol/L)为电泳缓冲液时,以稀释的不同pH的硼酸盐缓冲液(0.02 mol/L)配制样品溶液,考察样品溶液pH 值对分离的影响。结果表明,不同样品溶液pH 导致目标峰面积有所差异,但迁移时间以及目标峰与杂质峰的分离度基本不变(图2c)。
同样,样品溶液中离子强度较低也可使样品中组分产生更好的浓缩效果,而增加离子强度则使检测灵敏度降低。由图2d 可见,在相同样品浓度溶液中加入NaCl 时,NaCl 浓度增大使样品中目标峰和杂质峰均展宽,且峰面积降低,目标峰与杂质峰的分离度也降低。说明对样品进行纯度分析时,样品溶液中的离子强度或盐浓度较大不利于提高目标峰和杂质峰的分离度,实际样品的纯度检测应在低盐条件(<50 mmol/L NaCl)下进行。
综合考虑上述影响因素,保持目标峰与杂质峰的分离度最好,且目标峰检测灵敏度高的优化条件为:以0.2 mol/L 硼酸盐缓冲液(pH 8.7或9.0)为电泳缓冲液,以稀释10倍的电泳缓冲液(0.02 mol/L)配制样品。
2.1.4 样品的纯度分析
考虑到实验中电渗流和实验条件的波动对峰面积值的影响,以目标峰和杂质峰的峰面积及校正的峰面积(峰面积/迁移时间)表示目标峰和杂质峰的量。利用峰面积归一化法,分别以目标峰面积与总峰面积、校正的目标峰面积与总校正峰面积的比值表示样品的相对纯度。
对0.06 g/L的Ang II 重复测定3次,测得样品的纯度值分别为:91.40%/88.76%(峰面积比值/校正峰面积比值)、89.09%/89.37%和90.83%/91.08%。两种计算方法测得样品纯度的平均值分别为90.44%(RSD 1.09%)和89.74%(RSD 1.09%),两种方法之间存在约0.7%的数值差异,说明本实验中的实验条件稳定,实验重复性较好。但所测结果与商品供货商标示的纯度(≥95%)有明显差异。因供货商提供的验证报告结果为HPLC 分析图的峰面积归一化处理所得,说明毛细管电泳方法与HPLC的测定结果表示的纯度值存在的差异约在4.56%~5.26%之间。
2.1.5 存储溶液pH和存储温度对稳定性的影响
使用0.02 mol/L的pH 7.4的硼酸盐缓冲液配制Ang II 样品,将配好的样品分为3份,分别置于20℃、4℃和-20℃下保存不同时间。统计各样品的目标峰、杂质峰的校正峰面积,比较样品测定的纯度值变化。

图3 存储温度和时间对Ang II 稳定性的影响Fig.3 Effects of storage temperature and time on the stability of Ang II
由图3可知,溶液状态的Ang II 在不同的放置温度下,其纯度值的变化程度不同,温度越低,纯度值变化越小。放置温度为20℃时,Ang II的纯度值下降较快,24 h 时已降至90%以下。而低温条件(4℃和-20℃)下,Ang II的纯度值变化较小,放置48 h 内,二者均保持在91%以上。4℃与-20℃相比,4℃保存时不需对样品进行反复冻融,使用更方便。故Ang II 样品溶液较好的保存条件为pH 7.4缓冲液中、4℃下放置,该条件下,Ang II 可在48 h 内保持良好稳定性。
2.2 糖蛋白分析
HRP(40 kDa)是植物辣根中存在的糖蛋白酶类,是酶联免疫技术中常用的酶之一。凝血酶(34 kDa)是由凝血酶原形成的蛋白质水解酶,是凝血过程中催化血纤蛋白原水解的酶。H-Thr 是通过重组技术获得,B-Thr 是从牛血浆中提取而来。PHA(115 kDa)是一类具有特异糖结合活性的糖蛋白,通过细胞膜上特定的糖基识别可区别细胞的类型和反映细胞在分化、成熟和肿瘤细胞性变(性质)中的变化,是重要的细胞识别试剂。以上蛋白质都是生物学中具有重要功能和应用的糖蛋白。
2.2.1 糖蛋白的吸附性
蛋白质通常在熔融石英毛细管内壁存在一定的吸附性,因此考察了4种糖蛋白在毛细管内的吸附性质。结果表明,4种糖蛋白在毛细管内壁的吸附都很强,在电泳过程中几乎不出峰或峰形严重扭曲。因此选择可抑制吸附的涂层毛细管进行分析。
2.2.2 糖蛋白的检测
因涂层管中的电渗流很弱,故所施电压主要影响蛋白质自身的电泳迁移速率。使用硼酸盐(pH 8.7)电泳缓冲液,正向电压分离时,40 min 内在负极检测端均未检测到4种糖蛋白。而采用负向电压时,在正极检测端可检测到4种糖蛋白,说明4种蛋白质在溶液中均表面带净负电荷。由1.1节可知,所购4种糖蛋白样品标示的pI 值均不是单一值,而是处于3~9之间。上述实验结果进一步说明所购4种蛋白质的等电点均低于8.7。此外,H-Thr和HRP 电泳时出现单一峰,而B-Thr和PHA 则出现多重峰,因此认为后两者可能存在多种蛋白质的亚型或变体结构。
2.2.3 分析条件优化
缓冲液的选择考察了硼酸盐缓冲液(0.2 mol/L)、磷酸盐缓冲液(0.2 mol/L)和Tris-HCl 缓冲液(0.1 mol/L)对分离的影响。Tris-HCl 缓冲液中,H-Thr、B-Thr 以及HRP均不出峰,PHA 多峰间分离度极差,只出一个包峰;磷酸盐缓冲液中,4种糖蛋白分析时基线不平,出峰杂乱,且B-Thr和PHA的多峰之间分离度很低;使用硼酸盐缓冲液,PHA和B-Thr的多峰间分离度较高,且H-Thr和HRP的峰形较好,响应值较高。故实验中选用硼酸盐溶液作为电泳缓冲液。
缓冲液pH的选择因涂层毛细管的内表面涂层易受强酸或强碱溶液的破坏,且实验中4种糖蛋白均没有确定的等电点,除HRP 外,其余3种蛋白呈现出5~8的等电点范围,因此,考察了中性pH缓冲液(pH 7.4、7.8、8.2、8.7)的影响。图4的结果表明,pH 7.4时,4种糖蛋白的响应值最低,糖蛋白B-Thr和PHA的多峰间分离度也最差;而pH 8.7时,4种糖蛋白的出峰较好,B-Thr 以及PHA的多峰得到很好分离,成分单一的H-Thr 以及HRP 峰形较好,且响应值较高。pH 7.8和8.2的结果介于二者之间。因此后续实验选用pH 8.7的硼酸盐缓冲液。
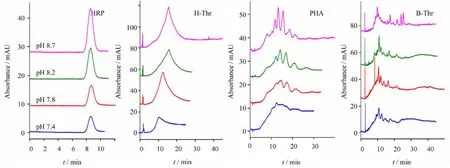
图4 缓冲液pH 对糖蛋白分离的影响Fig.4 Effect of running buffer pH on glycoprotein separation
分离电压的选择由图4可见,4种糖蛋白中除HRP 外,其余3种糖蛋白的峰形明显较差。为此考察了电压对分离的影响。对H-Thr、HRP 以及PHA 选择了-15,-20,-25 kV 3个电压。因BThr 出峰数较多,为增加其分辨率,选择了较低的-10,-15,-20 kV 3个电压。在-25 kV 电压下,蛋白质样品的迁移时间明显较快,有利于单一峰形蛋白质的快速分析(见图5中HRP和H-Thr)。但对含有多峰的PHA和B-Thr 蛋白,随着电压的升高,多峰间的分辨率明显降低(见图5中PHA和BThr)。此外,高电压下电泳速度加快的同时,蛋白质样品的检测灵敏度有所降低。在-20 kV 分离时,H-Thr、HRP 以及PHA的分离效果较好,但B-Thr的多峰之间不能有效分离。而在-10 kV 时,B-Thr 多峰间的分离得到改善。因此,后续表征蛋白质稳定性时,对H-Thr,HRP 以及PHA 选择-20 kV 电压,而对B-Thr 选择-10 kV 电压。
2.2.4 糖蛋白的稳定性
将0.2 mol/L(pH 7.4)硼酸盐缓冲液配制的蛋白质样品分为3份,分别置于20℃、4℃和-20℃下放置不同时间。比较样品的电泳图变化,图6的结果显示,48 h 内,3种保存温度下,4种糖蛋白溶液的电泳图没有明显改变,说明样品溶液稳定性良好。当样品保存时间大于一周且小于四周,随着时间的增加,3种温度对样品的稳定性存在明显影响:在-20℃保存时,4种糖蛋白电泳图相对稳定,峰形、出峰个数随时间变化基本不变;在4℃保存时,H-Thr的峰形变化较大,难以确定其峰高或峰面积,但其余3种糖蛋白的电泳图基本不变,受保存时间影响不大;在20℃保存时,除HRP 仍基本保持稳定外,其余3种糖蛋白的电泳图均出现明显变化:HThr的峰高明显降低,糖蛋白B-Thr和PHA的峰形和峰位置随时间增加而改变,一些峰降低或消失,但又有新形态的峰出现。放置时间大于两周且小于四周,HRP 仍保持相对稳定,而H-Thr的峰几乎消失;PHA和B-Thr的出峰数、峰高及迁移时间与新配样品相比,也出现显著的变化。
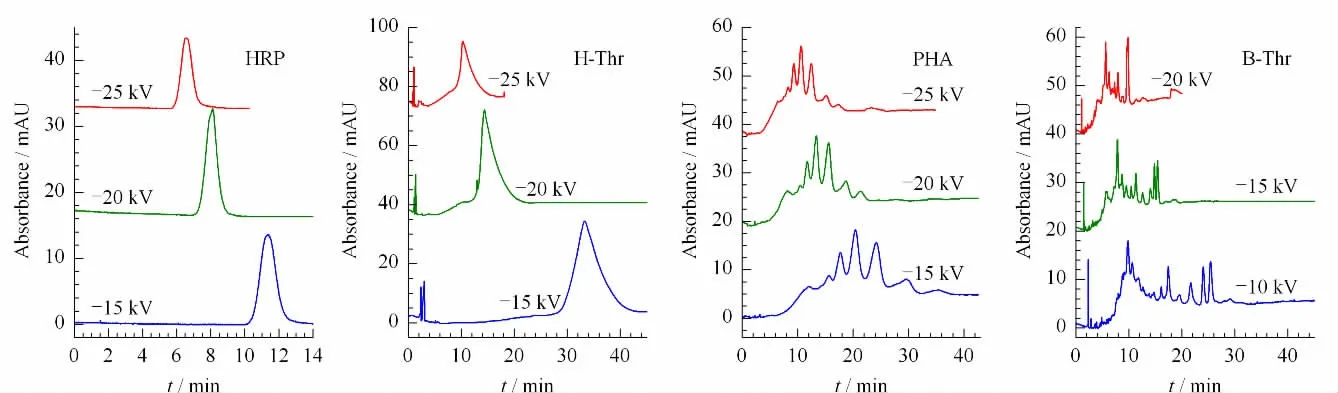
图5 分离电压对糖蛋白分离的影响Fig.5 Effect of voltage on glycoprotein separation
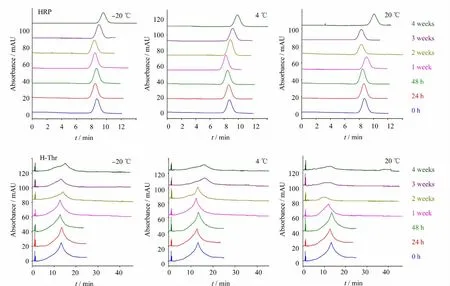
图6-Ⅰ 保存温度和时间对糖蛋白稳定性的影响Fig.6-Ⅰ Effects of storage temperature and time on the stability of glycoproteins

图6-Ⅱ 保存温度和时间对糖蛋白稳定性的影响Fig.6-Ⅱ Effects of storage temperature and time on the stability of glycoproteins
3 结论
多肽和蛋白质等生物样品的稳定性对后续实验研究非常重要。为了保证对多肽和蛋白质等样品的定量分析,对其进行高效、快速的稳定性考察和表征非常必要。本文所用的Ang II和4种糖蛋白的稳定性均较好,配制的样品溶液在48 h 内可保持稳定。毛细管电泳方法具有高效、快速、低成本优势,适合用于快速表征和评价多肽和蛋白质样品的稳定性,以及研究影响稳定性的关键因素,且特别适合价格昂贵或来源稀少的生物样品的表征和评价。
[1]Basso N,Terragno N A.Hypertension,2001,38(6):1246
[2]Tonnaer J A,Verhoef J,Wiegant V M,et al.J Chromatogr B,1980,183(3):303
[3]Ahmad S,Simmons T,Varagic J,et al.PLoS One,2011,6(12):e28501
[4]Zhou X,Wang X J,Tian H S,et al.Journal of Jilin University:Medicine Edition(周鑫,王晓杰,田海山,等.吉林大学学报),2010,36(3):518
[5]Tenorio-López F A,Zarco-Olvera G,Sánchez-Mendoza A,et al.Talanta,2010,80(5):1702
[6]Huang Z D.Chinese Journal of Chromatography(黄志东.色谱),2000,18(1):80
[7]Wojcik R,Dada O O,Sadilek M,et al.Rapid Commun Mass Spectrom,2010,24(17):2554
[8]Kuroda Y,Yukinaga H,Kitano M,et al.J Pharm Biomed Anal,2005,37(3):423
[9]Hasan M N,Park S H,Oh E,et al.J Sep Sci,2010,33(23/24):3701
[10]Chen T H,Misra T K,Liu C Y.Electrophoresis,2008,29(8):1651
[11]Wang X L,Kumar S,Buck P M,et al.Proteins,2013,83(3):443
[12]Lazaridis T,Karplus M.Biophysical Chemistry,2003,100(1/3):367
[13]Scharnagl C,Reif M,Friedrich J.Biochimica et Biophysica Acta,2005,1749(2):187
[14]Wu S H,Luo T S,Zhang C G,et al.Chinese Journal of Experimental Traditional Medical Formulae(吴少辉,罗廷顺,张成桂,等.中国实验方剂学杂志),2012,18(21):74
[15]Kakehi K,Honda S.J Chromatogr A,1996,720(1/2):377
[16]Yin L H,Xue J,Lin B C.Chinese Journal of Analytical Chemistry(尹利辉,薛俊,林秉承.分析化学),1996,24(12):1464
[17]Moring S E,Colburn J C,Grossman P D,et al.LC-GC,1990,8(1):34
