基于巯基-烯点击反应制备有机-无机杂化硼酸亲和整体柱用于糖蛋白的选择性富集
2013-07-13杨帆毛劼何锡文陈朗星张玉奎
杨帆,毛劼,何锡文,陈朗星*,张玉奎,2
(1.南开大学化学学院,天津 300071;2.中国科学院大连化学物理研究所,辽宁大连 116023)
糖蛋白是一类重要的翻译后修饰蛋白,它是由糖链在多肽链上以多种形式共价修饰而成的一类重要的生理活性物质。糖蛋白在生物体内种类繁多,分布广泛,与人体中很多重要的生物学过程密切相关[1,2]。因此,对糖蛋白的研究具有十分重要的生物学意义和临床应用价值。通常糖蛋白在复杂生物体系中的绝对丰度都非常低,高丰度的非糖蛋白的存在会对低丰度的糖蛋白产生干扰和掩盖。虽然生物质谱技术得到了迅速的发展,但是对于低丰度的糖蛋白或糖肽的分析还是无能为力,为了解决这一瓶颈问题,多种糖蛋白或糖肽的分离富集技术应运而生[3-6]。在复杂的生物体系中,通过选择性地分离、富集低丰度糖蛋白来排除高丰度非糖蛋白的干扰是目前糖蛋白鉴定和研究的有效策略。近几年来,硼酸亲和技术在糖蛋白分离富集领域得到了快速的发展。硼酸亲和作用的机理是硼酸基团在碱性条件下与带有顺式二醇(cis-diol)基团的物质共价结合,形成稳定的五或六元环酯结构,当介质的pH 切换为酸性时则可实现可逆的解离[7]。利用硼酸这种可逆结合的性质,硼酸亲和技术已发展成为一种选择性富集含顺式二醇基团化合物的有效提纯手段。
整体柱作为一种新型分离介质,具有制备简单、通透性好、传质快等优点,在生物分离分析中发挥的作用日益增大[8,9]。将整体柱与硼酸亲和技术相结合,是当前硼酸亲和材料的一个发展方向。硼酸亲和整体柱结合了整体柱材料与硼酸亲和技术的优点,近年来受到了很大关注[10]。2006年Potter等[11]首先在毛细管中合成了硼酸亲和整体柱,并在微液相色谱模式和毛细管电色谱模式下实现了核苷类物质的分离、富集。Chen 等[12]采用3-丙烯酰胺基苯硼酸作为功能单体原位聚合制备了有机基质硼酸亲和整体柱,并将其作为一种固相微萃取柱用于萃取核苷和糖蛋白,扩展了硼酸亲和整体柱的应用范围。Liu 等[13-16]研究了一系列苯硼酸衍生物为功能单体合成可在中性条件下工作的硼酸亲和整体柱,为硼酸亲和整体柱的设计和制备提供了更多选择。随后Lin 等[17]和Liu 等[18]利用“一锅法”[19,20]制备了有机-无机杂化硼酸亲和整体柱,将新的整体柱载体引入硼酸亲和技术中,制备的硼酸亲和整体柱显示了优良的性能。
在色谱分离领域,Cu(I)催化叠氮-炔基环加成反应(Cu(I)-catalyzed azide-alkyne cycloaddition,CuAAC)[21]作为典型的点击化学反应已应用于液相色谱固定相的制备中[22]。我们采用CuAAC 反应制备疏水聚合物整体柱[23,24]和硼酸有机-无机杂化硼酸亲和整体柱[25],并成功用于蛋白质的分离。巯基-烯(thiol-ene)反应是另一类典型的点击化学反应。巯基-烯点击反应不需要加入催化剂,不会在产物中造成重金属残留,在光引发或热引发的条件下即可快速反应。利用其制备色谱固定相,具有制备简单、反应条件温和、可控性好等优点,可形成具有特殊交联网状结构的聚合物,在聚合物材料的制备中受到越来越多的关注[26]。
本文采用溶胶-凝胶和巯基-烯点击反应两步制备有机-无机杂化硼酸亲和整体柱,建立了一种制备硼酸亲和整体柱的新路线。首先以四甲氧基硅烷(TMOS)和巯丙基三甲氧基硅烷(MPTMS)作为反应单体,采用溶胶-凝胶反应制备表面含巯基的硅胶整体柱。然后利用巯基-烯反应在整体柱上修饰硼酸配基3-丙烯酰胺基苯硼酸(AAPBA),制成AAPBA-硅胶杂化亲和整体柱,并成功用于含顺式二醇的核苷和糖蛋白的分离。相比“一锅法”路线[17,18],本方法先合成带有活性位点的整体骨架材料,再通过点击反应将硼酸配基接枝到整体柱上。所得材料的功能基团均分布在骨架表面,避免了功能基团被包埋在骨架中的问题,更利于其与目标分子作用。并且所得的骨架中间体可以用于接枝不同性质和功能的硼酸基团,从而可以用于制备多种类型的硼酸亲和整体材料。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪SPD-M20A(日本岛津公司),配置两台LC-20AD 泵、一台DGU-20A5在线脱气机以及一个SPD-M20A 二极管阵列检测器,色谱数据的采集和处理在LCsolution 工作站完成;艾科浦Aquaprince 超纯水机;Bruker AV-400型核磁共振(NMR)仪;FTS6000型红外光谱仪(美国Bio-Rad 公司);SS-550型扫描电子显微镜(日本岛津公司)。
TMOS和MPTMS 购自湖北武大有机硅新材料股份有限公司;间氨基苯硼酸(APBA)购自北京元素科技化学有限公司;丙烯酰氯购自美国Acros 公司。聚乙二醇(PEG,Mr10000)及偶氮二异丁腈(AIBN)购自天津化学试剂厂,AIBN 经甲醇重结晶处理。腺苷、脱氧腺苷、人血清白蛋白(HSA)、核糖核酸酶A(RNase A)、卵清白蛋白(OVA)、辣根过氧化物酶(HRP)购自美国Sigma-Aldrich 公司。其他化学试剂均为分析纯及以上级别,实验用水为超纯水。不锈钢柱(100 mm ×4.6 mm)购自天津谱祥科技有限公司。
1.2 AAPBA-硅胶杂化整体柱的制备
1.2.1 有机单体AAPBA的合成
有机单体AAPBA的合成参考文献[27]并进行了一些修改,具体如下:将1.0 g APBA 溶解于25 mL NaOH 溶液(1.2 mol/L)中,置于冰水浴中冷却。于0℃剧烈搅拌的条件下,逐滴缓慢地加入1.2 mL 丙烯酰氯。反应1 h 后,加入1 mol/L 盐酸调节混合物溶液的pH 至1.0,得到白色固体沉淀物。过滤沉淀物,用50 mL 冷水洗涤5次。将所得沉淀物溶解在20 mL 水中并加热至60℃,滤掉杂质。滤液在0℃条件下静置过夜,得到白色针状晶体,过滤后用冷水洗涤。然后放入真空烘箱中干燥,即得AAPBA。AAPBA的1H NMR 数据如下:δ10.07(s,1H,NH),δ8.02(s,2H,B-OH),δ7.88(s,1H,Ar-H),δ7.81(d,1H,Ar-H),δ7.49(d,1H,Ar-H),δ7.28(t,1H,Ar-H),δ6.46(dd,1H,CH),δ6.27(dd,1H,C=CH2),δ5.74(dd,1H,C=CH2)。
1.2.2 巯基修饰的硅胶整体柱的制备
将0.1 g PEG 溶于2 mL 0.2 mol/L 乙酸溶液,加入1 mL TMOS、0.3 mL MPTMS和0.5 mL 甲醇,在冰水浴中激烈搅拌使其水解,得到透明均一溶液。超声1 min 后,用注射器将混合物注入不锈钢柱中。不锈钢柱两端密封置于55℃烘箱中反应12 h。反应结束后依次用水、甲醇冲洗整体柱,将致孔剂和未反应完的残余试剂除去。
1.2.3 巯基-烯反应制备AAPBA-硅胶杂化整体柱
利用巯基-烯反应将AAPBA 键合在巯基修饰硅胶整体柱上,条件如下:将0.2 g AAPBA,1%(质量分数)AIBN 溶于15 mL 甲醇中,涡流搅拌混匀,经0.45μm 滤膜过滤。将巯基硅胶整体柱连接液相泵并置于60℃柱温箱中,循环泵入AAPBA 修饰液,巯基-烯反应24 h 后依次用甲醇和水冲洗整体柱以除去残余试剂。
1.3 AAPBA-硅胶杂化整体柱的动态吸附容量
采用前沿分析法测定AAPBA-硅胶杂化整体柱的动态吸附容量[27]。分别以腺苷和OVA 作为测试物,脱氧腺苷和HSA 作为死时间标记物,测定不同pH 条件下AAPBA-硅胶杂化硼酸亲和整体柱对含顺式二醇基团生物分子的动态吸附容量。测试前用磷酸盐缓冲溶液充分平衡硼酸亲和柱直至基线稳定。再将含有1 g/L 测试物和0.01 g/L 标记物的缓冲溶液以恒定流速通过整体柱。当整体柱吸附测试物达到饱和后,测试物流出整体柱进入检测器。不同pH 条件下的动态吸附容量(Q,mg/g)计算公式如下:
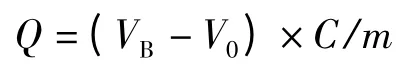
式中VB(mL)为整体柱突破体积的10%(突破曲线10%高处),V0为整体柱中的死体积(mL),C 为测试物的质量浓度(mg/mL),m 为整体柱的干质量(g)。测试后用0.2 mol/L 醋酸溶液洗脱测试物,再用磷酸盐缓冲液冲洗整体柱至平衡后继续测试。
1.4 色谱条件
实验中所用的液相泵流速为0.5 mL/min,选用0.1 mol/L 磷酸盐缓冲液和0.2 mol/L 醋酸溶液作为梯度洗脱液。对核苷等分析物质的色谱检测波长为260 nm,对糖蛋白等分析物质的色谱检测波长为214 nm。样品溶液使用0.1 mol/L 磷酸盐(pH 7.5)缓冲液配制,进样量为20μL。所有流动相和样品溶液使用前均经0.45μm 滤膜(Nihon Millipore Ltd.)过滤。
2 结果与讨论
2.1 AAPBA-硅胶杂化整体柱的制备条件优化
AAPBA-硅胶杂化整体柱的制备过程如图1所示。在制备巯基硅胶整体柱的过程中,TMOS与MPTMS的比例、PEG和甲醇用量对杂化整体柱形貌及机械性能有较大影响,因此对这些因素进行了考察(见表1)。
改变TMOS与MPTMS的比例,发现当MPTMS的比例较高时,反应物很难混合均匀,无法形成均匀的水解溶液。当TMOS和MPTMS的体积比为10∶3时,两相可以较好互溶,混合物体系在冰水浴中4 h可形成均一透明的溶液。
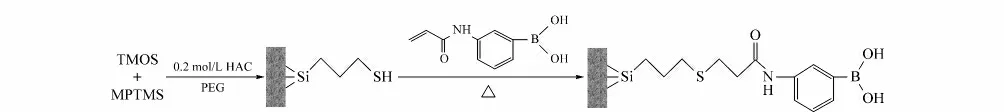
图1 巯基-烯法制备AAPBA-硅胶杂化整体柱Fig.1 Preparation of AAPBA-silica hybrid monolith via“thiol-ene”click reaction
PEG 在聚合体系中除了具有致孔的作用之外,还会影响到溶胶-凝胶反应过程中的相分离过程[28]。保持体系中其他反应物的量不变,改变PEG的含量,发现当PEG的含量为0.2 g 时,形成的整体柱骨架呈半透明态,质地硬脆,通透性差;当PEG的含量为0.1 g 时,得到的整体柱骨架致密均匀,机械稳定性能好,同时具有良好的渗透性,适合用于较高流速条件下的色谱分析。
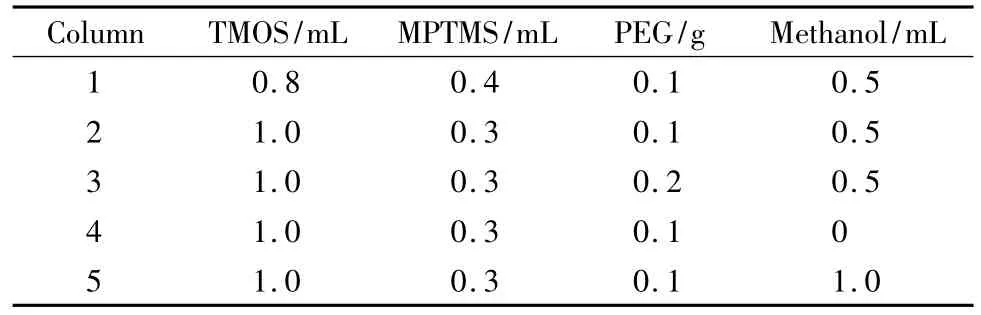
表1 巯基硅胶整体柱的制备条件Table 1 Conditions for the preparation of mercaptopropylmodified silica monoliths
以TMOS和MPTMS 为前躯体的溶胶-凝胶体系中,甲醇的存在可以改善硅烷化试剂在水相中的溶解,并且会对骨架的形貌产生影响。经考察发现,当反应体系中不含甲醇时,反应体系需要较长时间才能形成均一溶液,得到的整体柱骨架质地硬,通透性较差。当甲醇的含量为0.5 mL 时,反应混合物能够较好互溶,可在较短时间内得到均匀的溶液。然而甲醇的含量太高将会导致形成的整体柱骨架极易收缩。
经过优化,当预聚液的组成为TMOS 1.0 mL、MPTMS 0.3 mL、PEG 0.1 g、甲醇0.5 mL、0.2 mol/L HAc 2 mL 时,合成的巯基硅胶整体柱具有通透的骨架结构和良好的机械稳定性。
2.2 AAPBA-硅胶杂化整体柱的表征
使用FT-IR 对AAPBA-硅胶杂化整体柱的制备过程进行表征(见图2)。曲线a 为巯基硅胶整体柱的红外吸收曲线,在2562 cm-1处出现巯基的弱吸收峰。曲线b 为AAPBA-硅胶杂化整体柱的红外吸收曲线,1668 cm-1和1550 cm-1处出现酰胺基团的特征峰,1610 cm-1和1491 cm-1处出现苯环的伸缩振动峰,705 cm-1处出现苯环间位取代的峰,655 cm-1处出现C-S 键的特征峰。结果证明AAPBA 被成功地接枝到巯基硅胶整体柱上。
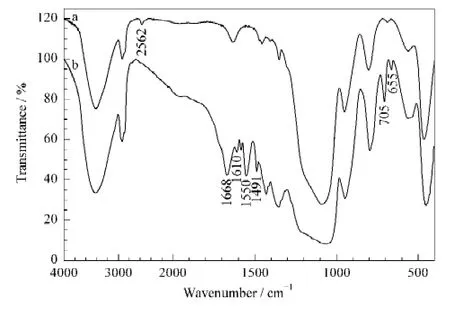
图2 (a)巯基硅胶整体柱与(b)AAPBA-硅胶杂化整体柱的红外光谱图Fig.2 IR spectra of(a)mercaptopropyl-modified silica monolith and(b)the AAPBA-silica hybrid boronate affinity monolith
用扫描电镜来表征最优化条件下制备的AAPBA-硅胶杂化整体柱的形貌特征。从图3中可以清晰地看出巯基硅胶整体柱的硅胶骨架高度交联的网状结构,并且骨架中存在大尺寸的贯穿通孔,为点击法修饰AAPBA 提供了空间。经巯基-烯反应后得到的整体柱骨架呈现出相互贯通的、分布均匀的连续结构,具有可供流动相快速流过的大尺寸通孔(孔径约2~4μm)。这些均匀大孔结构的存在可以降低传质阻力,改善整体柱的渗透性能。
为了考察AAPBA-硅胶杂化整体柱的机械强度,分别用水和甲醇作为流动相测定流速与柱压的关系。如图4所示,在0.1~5.0 mL/min的范围内,整体柱的柱压随流速增加呈线性增加。以水为流动相,柱压(y,MPa)与流速(x,mL/min)的线性方程为y=1.61x-0.24,相关系数R=0.995;以甲醇为流动相,线性方程为y=1.05x-0.05,相关系数R=0.997。表明该杂化硼酸亲和整体柱具有良好的机械强度,在较高的流速下也能保持稳定的形态。

图3 (a)巯基硅胶整体柱与(b)AAPBA-硅胶杂化整体柱的扫描电镜图Fig.3 Scanning electron microscope images of(a)mercaptopropyl-modified silica monolith and(b)the AAPBA-silica hybrid monolith
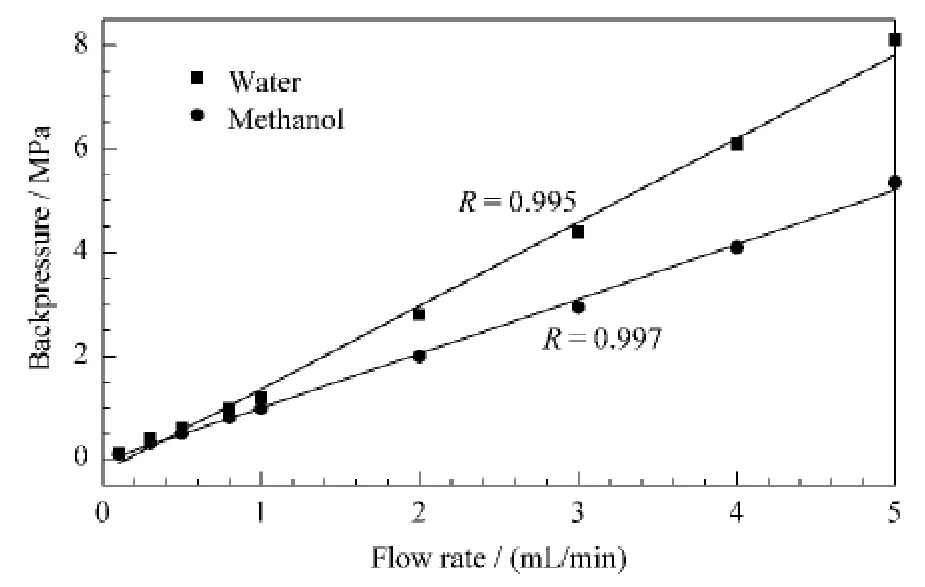
图4 AAPBA-硅胶杂化整体柱的机械稳定性Fig.4 Mechanical stability of the AAPBA-silica hybrid monolith
渗透性是评价整体柱性能的一个重要指标。整体柱的渗透性(B0)根据Darcy 公式[29]计算:
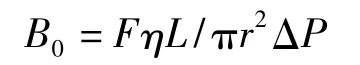
式中F 为流动相流速(m3/s),η为流动相的黏度(Pa·s),L 为整体柱的长度(m),r 为整体柱的内半径(m),ΔP 为相应流速下对应的柱压降(Pa)。经过计算,AAPBA-硅胶杂化硼酸亲和整体柱在水相中B0=8.4×10-14m2(η=1.005×10-3Pa·s,20℃),有机相中B0=5.8×10-14m2(η=0.580×10-3Pa·s,20℃),表明该杂化整体柱在不同极性的流动相条件下都表现出良好的通透性。另外,该杂化整体柱在水和有机流动相中的B0差值很小,这可以解释为其具有良好的耐溶剂性能,在不同的溶剂中都表现出良好的稳定性。
整体柱的重现性是评价制备方法有效性和实用性的重要指标。本工作中以腺苷保留时间的RSD来评价制备方法的重现性。腺苷在同一根柱上连续5次进样的保留时间RSD 为1.88%,在同一批次5根不同柱上保留时间的RSD 为5.69%,在3根不同批次柱上的保留时间RSD 为8.60%。说明本工作中采用的制备方法具有较好的重现性。
2.3 AAPBA-硅胶杂化整体柱的亲和性能
由于硼酸配基AAPBA的pKa值较低[18],因此在中性pH 条件下,AAPBA-硅胶杂化硼酸亲和整体柱对含有顺式二醇结构的生物分子表现出良好的亲和能力。选用腺苷和脱氧腺苷作为对比分析物,研究杂化硼酸整体柱对含有顺式二醇结构的生物小分子的亲和性能,结果如图5所示。作为一种典型的具有顺式二醇结构的化合物,腺苷在pH 7.5的条件下被保留在杂化硼酸亲和整体柱中,而脱氧腺苷则没有保留地流出整体柱;在10 min 时切换到酸性流动相,腺苷被成功洗脱。此实验结果与硼酸亲和作用机理相符,说明硼酸亲和整体柱对顺式二醇化合物具有良好的亲和性能。
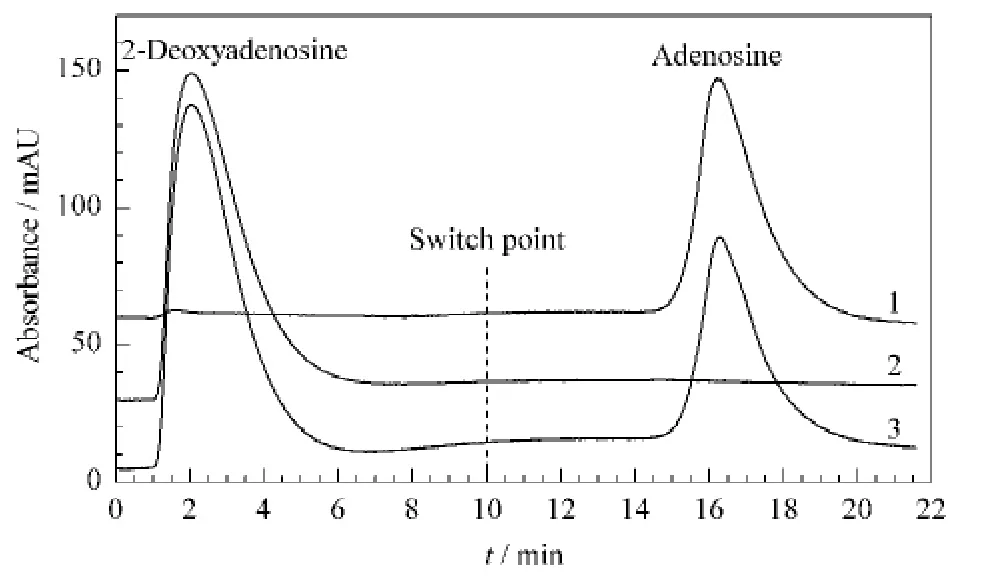
图5 腺苷与脱氧腺苷在AAPBA-硅胶杂化整体柱上的色谱保留行为Fig.5 Chromatographic retention behaviors of adenosine and 2-deoxyadenosine on the AAPBA-silica hybrid monolith
糖蛋白与非糖蛋白在AAPBA-硅胶杂化整体柱上有明显不同的保留行为,如图6所示。在pH 7.5时,非糖蛋白HSA和RNase A 在约4 min 出峰,而糖蛋白HRP和OVA 则被完全保留在整体柱中。10 min 时将流动相切换为酸性,可实现糖蛋白的可逆洗脱。经AAPBA-硅胶杂化整体柱处理后可以实现糖蛋白与非糖蛋白的有效分离,表明该整体柱对糖蛋白具有良好的亲和选择性,是分离富集糖蛋白的一种有效方法。
动态吸附容量是评价AAPBA-硅胶杂化整体柱亲和性能的重要参数。在不同pH 条件下,腺苷的动态吸附容量QAD(mg/g)和OVA的动态吸附容量QOVA(mg/g)如表2所示。随着pH的升高,QAD由3.18 mg/g 增至7.12 mg/g,QOVA由1.95 mg/g 增至6.15 mg/g,略低于CuAAC 点击反应制备的硼酸亲和整体柱[25]。但与CuAAC 法相比,巯基-烯法不需要引入重金属催化剂,制备过程更加安全。AAPBA-硅胶杂化整体柱在较高pH 条件下表现出更强的亲和吸附能力,这与硼酸亲和作用机理相符。然而该硼酸亲和整体柱在中性条件下仍表现出对具有顺式二醇结构的化合物的亲和能力,表明AAPBA-硅胶杂化整体柱可在中性条件下用于糖蛋白的分离分析,中性的分离条件对蛋白的分析具有明显优势。
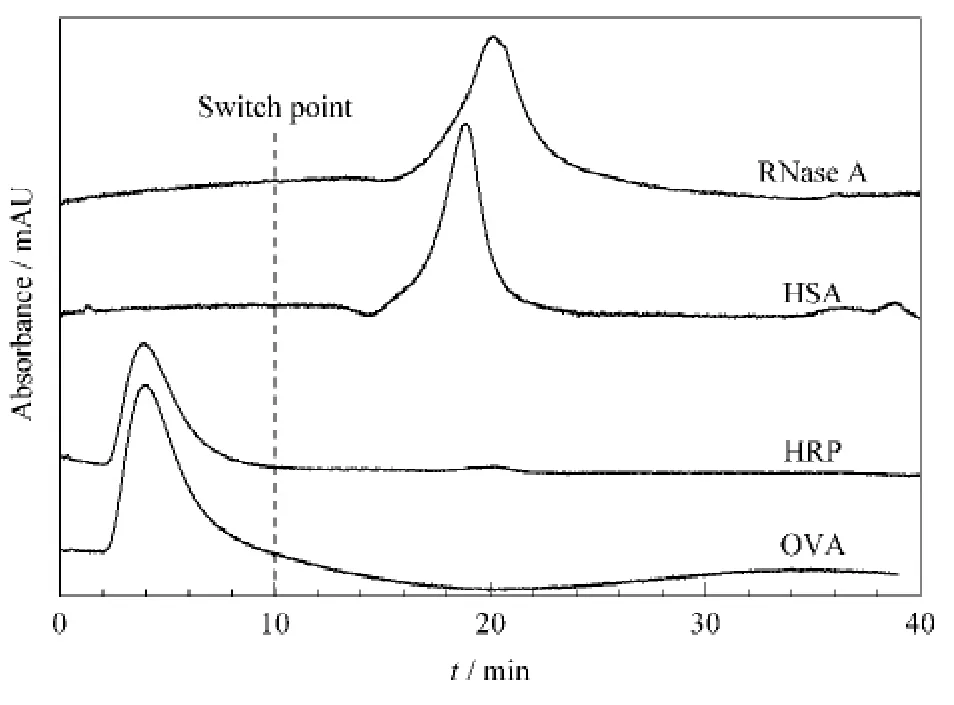
图6 糖蛋白与非糖蛋白在AAPBA-硅胶杂化整体柱上的色谱保留行为Fig.6 Chromatographic retention behaviors of glycoproteins and nonglycoproteins on the AAPBA-silica hybrid monolith
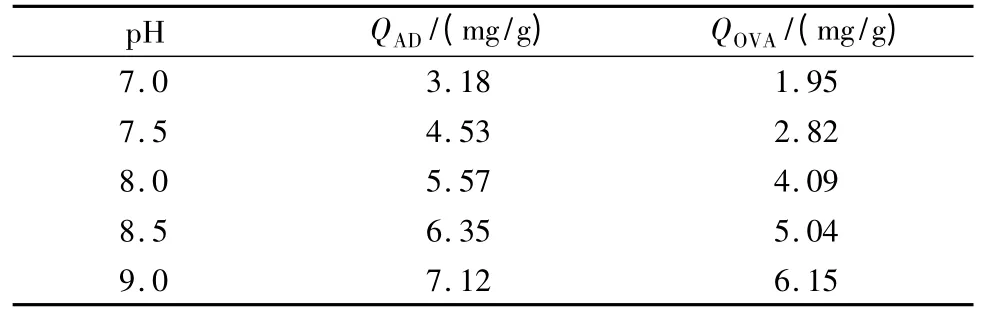
表2 AAPBA-硅胶杂化整体柱在不同pH 条件下的动态吸附容量Table 2 Binding capacity of the AAPBA-silica hybrid monolith under different pH conditions
3 结论
本文发展了一种以巯基-烯反应制备有机-无机杂化硼酸亲和整体柱的新方法。该方法制备的整体柱具有均匀的孔结构、良好的通透性、稳定的机械性能和硼酸亲和能力,可选择性分离含有顺式二醇结构的生物分子。并且这种新型硼酸亲和整体柱能在中性条件下选择性吸附含有顺式二醇的生物分子,表明其在糖蛋白富集领域有较好的发展前景。硼酸亲和整体柱对标准糖蛋白的定量回收实验及血样中糖蛋白的定量提取正在进行中。
[1]Dwek M V,Ross H A,Leathem A J C.Proteomics,2001,1(6):756
[2]Krishnamoorthy L,Mahal L K.ACS Chem Biol,2009,4(9):715
[3]Hirabayashi J.Glycoconj J,2004,21(1/2):35
[4]Wada Y,Tajiri M,Yoshida S.Anal Chem,2004,76(22):6560
[5]Tian Y,Zhou Y,Elliott S,et al.Nat Protoc,2007,2(2):334
[6]Alvarez-Manilla G,Atwood J Ⅲ,Guo Y,et al.J Proteome Res,2006,5(3):701
[7]Liu S,Bakovic L,Chen A.J Electroanal Chem,2006,591(2):210
[8]Zhu G J,Zhang L H,Liang Z,et al.Chinese Journal of Chromatography(朱贵杰,张丽华,梁振,等.色谱),2007,25(2):122
[9]Zou H F,Wu M H,Wang F J,et al.Chinese Journal of Chromatography(邹汉法,吴明火,王方军,等.色谱),2009,27(5):526
[10]Li H Y,Liu Z.TrAC Trends Anal Chem,2012,37:148
[11]Potter O G,Breadmore M C,Hilder E F.Analyst,2006,131(10):1094
[12]Chen M,Lu Y,Ma Q,et al.Analyst,2009,134(10):2158
[13]Liu Y C,Ren L B,Liu Z.Chem Commun,2011,47:5067
[14]Ren L B,Liu Z,Liu Y C,et al.Angew Chem Int Ed,2009,48:6704
[15]Li H Y,Liu Y C,Liu J,et al.Chem Commun,2011,47(28):8169
[16]Li H Y,Wang H Y,Liu Y C,et al.Chem Commun,2012,48:4115
[17]Lin Z A,Pang J L,Yang H H,et al.Chem Commun,2011,47:9675
[18]Li Q J,Lu C C,Li H Y,et al.J Chromatogr A,2012,1256:114
[19]Wu M H,Wu R A,Wang F J,et al.Anal Chem,2009,81:3529
[20]Zhang Z B,Wu M H,Wu R A,et al.Anal Chem,2011,83:3616
[21]Kolb H C,Finn M G,Sharpless K B.Angew Chem Int Ed Engl,2001,40(11):2004
[22]Chu C H,Liu R H.Chem Soc Rev,2011,40,2177
[23]Sun X L,Lin D,He X W,et al.Talanta,2010,82:404
[24]Sun X L,He X W,Chen L X,et al.Anal Bioanal Chem,2011,399:3407
[25]Yang F,Mao J,He X W,et al.Anal Bioanal Chem,2013,DOI:10.1007/s00216-013-6917-y
[26]Kempe K,Krieg A,Becer C R,et al.Chem Soc Rev,2012,41,176
[27]Yang F,Lin Z A,He X W,et al.J Chromatogr A,2011,1218:9194
[28]Xu L,Lee H K.J Chromatogr A,2008,1195(1/2):78
[29]Stanelle R D,Sander L C,Marcus R K.J Chromatogr A,2005,1100(1):68
