一种基于硝酸纤维素膜的新颖便捷的芯片对循环肿瘤细胞的高效捕获
2013-07-13张鹏孙长龙张人高明霞张祥民
张鹏,孙长龙,张人,高明霞,2*,张祥民,2*
(1.复旦大学化学系,上海 200433;2.复旦大学生物医学研究院,上海 200433)
循环肿瘤细胞(CTC)是指那些从肿瘤组织上脱落下来并进入血液全身循环的癌细胞。它由普通癌细胞转化而来,并且随时可以通过逆分化再次长出肿瘤组织,因此它与癌症的扩散和转移密切相关,是反映癌症病情发展的风向标,对其进行详尽研究对于癌症的早期诊断与治疗具有决定性的意义[1]。人体外周血液中CTC的含量很低,一般不会超过100个/mL,而其中的红细胞、白细胞等背景干扰细胞则高达109个,这对现有的分离分析方法来说是一个巨大的挑战[2,3]。总的来说,目前的研究亟须解决两个方面的问题:一是怎样把数量如此少的CTC 从背景如此复杂的人血中分离出来;二是如何对分离的少量CTC 进行高灵敏的检测计数和后续的生化分析。
近十年来,关于循环肿瘤细胞的分离捕集研究受到了国内外的广泛关注,一系列研究成果也相继被报道。美国强生公司推出了基于免疫磁珠分离的循环肿瘤细胞检测与分析系统(CellSearchTM)[4],率先得到了美国食品药品管理局(FDA)的认证并已广泛用于临床诊断,不过费用昂贵,而且假阳性率比较高。近来微流控芯片成为CTC 分离研究的热点,Nagrath 等[5,6]报道了基于上皮细胞粘附分子(Ep-CAM)抗体组装的微流体芯片阵列,对相应的循环肿瘤细胞具有很高的捕获效率;Hosokawa 等[7,8]基于癌细胞与正常细胞的形态差异,制成了体积排阻分离装置,扩展了CTC 研究的思路;国内的王树涛等[9,10]也基于硅板表面的纳米纤毛与癌细胞表面的结构相互作用,开发了一种硅板芯片,其对癌症病人血液样本的检测效果要好于当前的CellSearchTM系统。目前报道的这些关于CTC 芯片的最新研究成果对CTC的捕集效率较高,假阳性也控制得不错,但是芯片的制备过程大多太复杂,而且重复性较差,很难大规模生产,严重妨碍了其在临床应用上的前景;另外由于芯片孔道的尺寸限制,对病人血液的分析耗时很长,而且捕获的癌细胞也不方便进行后续的再培养等生化分析。
基于以上认识,目前CTC的研究真正需要的是一种设计新颖,制备便捷,分析快速高效的CTC 捕获芯片。最近各种膜基底平台[11,12]开始广受关注,因此我们设计了一种以硝酸纤维素膜(NCM)为基底的CTC 高效捕集芯片。硝酸纤维素膜常用于免疫印迹(western blotting)等生化分析中,利用其对蛋白质优良的吸附效能[13,14],可以方便地吸附抗体进行CTC 特异性捕获,简便高效;另外还可利用其良好的生物亲和性和在蛋白质组学分析中的特殊作用,对捕集到的癌细胞进行生物学再培养[15]和单细胞蛋白质组的研究。本研究中用非小肺癌细胞NCI-H1650作为目标靶细胞,初步验证了此种CTC芯片的良好捕获效能,预示了其在今后临床应用上的光明前景。
1 实验部分
1.1 仪器、试剂与材料
牛血清白蛋白(BSA)、乙醇等购自美国Sigma公司,实验所用抗体EpCAM CD326购自Biolegend。实验所用细胞非小肺癌细胞NCI-H1650购自中科院上海细胞库,细胞培养液RPMI1640、磷酸盐缓冲液(PBS)洗液和优级胎牛血清(FBS)来自PAA 公司。硝酸纤维素膜和聚甲基丙烯酸甲酯(PMMA)有机玻璃板来自美国Kender 公司。
1.2 实验步骤
1.2.1 CTC 捕获芯片的制备
将商品化的硝酸纤维素膜切成1 cm ×1 cm的小块,然后放入纯乙醇中浸泡10 s,让其软化透明,并平铺在预先剪裁好的PMMA 平板上自然风干,装配成芯片基底。在吸附抗体以前,需要在含10%(v/v)乙腈的1 mmol/L PBS 缓冲液中浸泡1 h 活化;然后把20μL 抗体(0.5μg/μL)溶解在200μL含10%乙腈的1 mmol/L PBS 缓冲液中,均匀滴加在CTC 芯片上,并在37℃下反应0.5 h,然后用PBS洗去多余的抗体;再加上50μL的BSA 溶液(0.5%,质量分数)封端0.5 h,以降低其对癌细胞的非特异性吸附。制备好的CTC 芯片保存在4℃冰箱备用。
1.2.2 CTC 芯片抗体吸附量的考察
CTC 芯片上滴加的抗体溶液在37℃反应0.5 h后,收集吸附过后的抗体溶液进行高效毛细管电泳(HPCE)分析,并用未经过吸附的抗体原溶液进行对照实验。使用的毛细管电泳仪为彩陆CL3030,运行缓冲液为100 mmol/L的磷酸盐缓冲液;采用虹吸10 s 进样,分离电压为10 kV,紫外检测波长为214 nm,最后根据抗体的峰面积来计算抗体的相对含量。
1.2.3 CTC 捕集与检测
非小肺癌细胞NCI-H1650于含5%(v/v)二氧化碳的37℃恒温培养箱中,使用添加10%(v/v)胎牛血清的RPMI1640培养基培养,待细胞培养成熟后用0.25%(质量分数)trypsin-EDTA 孵育3 min消化下来,并用PBS 缓冲液洗涤3次后配制成一定浓度的细胞悬液。把细胞液滴加在CTC 芯片上,放入37℃恒温箱孵育一定时间后,用PBS 洗去未捕获的细胞,然后进行显微镜成像计数和后续的检测。
2 结果与讨论
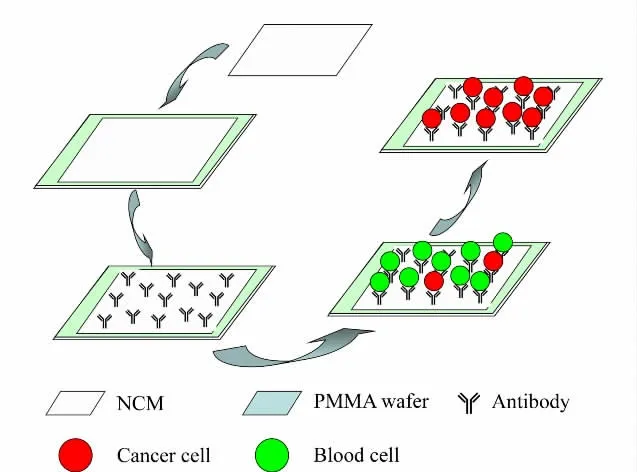
图1 CTC 芯片的制备和癌细胞捕获整体流程示意图Fig.1 Schematic illustration of CTC microchip fabrication and cancer cell capture
CTC 芯片的制备和癌细胞捕获全过程见图1,非常简便可控。传统的芯片制备多采用化学共价结合的方法来固定抗体,不仅抗体固定效率相对较低,而且过程复杂,大多需要先对芯片表面进行功能化修饰,这也会造成对细胞的毒性伤害。我们采用的硝酸纤维膜基底,具有良好的生物亲和性,在CTC捕集过程中不会对癌细胞活性产生任何不良影响,这样可以对捕获的少量细胞进行再培养,以便于后续的生物学和病理学研究;硝酸纤维素膜在蛋白质组定量和定性研究中也有极大的应用,我们可以对捕获的癌细胞裂解,然后分析单细胞的蛋白质组学,从分子水平揭示癌症的发展机理;最为重要的是,硝酸纤维素膜对蛋白质有很强的吸附效能,我们用其来直接吸附抗体,不仅操作简便而且效率高。对于CTC 芯片上抗体吸附量的考察,我们采用了HPCE对比分析抗体吸附前和吸附后量的变化(见图2)。从图中可看出,芯片吸附前的抗体原液会呈现一个很大的电泳峰,但是吸附后的上清液这个峰完全消失不见,说明硝酸纤维素膜吸附了近乎100%的抗体。通过计算得知其吸附量约为10μg/cm2,如此高的抗体浓度也成为后面优异的癌细胞捕集效率的保证。
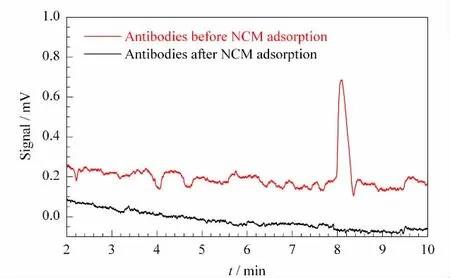
图2 抗体芯片吸附前后的电泳对照图Fig.2 Electropherograms of antibodies before &after CTC microchip adsorption
制好的CTC 芯片实物见图3d,硝酸纤维素膜用乙醇处理使其透明,便于后面的光学检测,也利于固化在支撑载体PMMA 板上。为了测试芯片的捕获效率,我们用非小肺癌细胞NCI-H1650配制成50个/μL的癌细胞悬液,然后滴加在CTC 芯片上,37℃反应一定时间后洗掉未吸附的细胞在明场显微镜下进行计数以验证其捕获效率。图3中a和b 分别是连接了抗体的芯片和未连接抗体芯片的细胞捕获对照图,吸附了抗体的芯片能捕获到大量的癌细胞,而未连接抗体的芯片则基本没有细胞存在。这一结果除了充分证明CTC 芯片的捕获高效能外,还显示芯片经过BSA 封端后非特异性吸附基本上不存在。图3c 是在同一块芯片上左边吸附抗体、右边不吸附抗体的直接对照实验,这样可以完全消除反应条件和洗脱时间差异的影响。以红线为界,左边吸附了抗体,能捕获到大量癌细胞,后边没吸附抗体则一个细胞也没有,进一步证明了CTC 芯片捕获的高特异性。

图3 CTC 芯片的实物图以及癌细胞捕获效果图Fig.3 Photo of CTC microchip and bright field microscopy images of captured cancer cells in CTC microchips
癌细胞与CTC 芯片的孵育时间对其捕获效率影响很大,一般来说抗原抗体特异性反应的最佳时间为0.5~1 h,为此我们考察了反应5、15、30、45和60 min的效率差异,具体见图4。从中我们可以看到孵育30 min 后CTC 捕集效率基本不再升高,因而我们后面实验的孵育时间都设定为30 min。我们还考察了加入不同细胞数量时CTC 芯片的捕获效率,统计结果见图5。当细胞数量在400个以上时,捕获效率都超过了60%,这与当前的主流报道结果[5,9]相当;当细胞数量低至20个时我们也能检测到6个,证明了其对血液中低含量的癌细胞进行捕集完全可能。

图4 不同孵育时间下CTC 芯片的捕获效率Fig.4 Capture yield of CTC microchip at different capture times

图5 不同数量癌细胞的CTC 芯片捕获效率Fig.5 Capture yield of CTC microchip in different numbers of cancer cells
为了模拟病人血样中CTC的检测,我们把500个癌细胞投入到1 mL 健康人血液中。首先全血进行红细胞破裂,初步离心去除上清液以排除大量红细胞的干扰,然后用所制备的CTC 芯片对离心沉淀细胞捕集30 min,用PBS 洗去未捕获的干扰细胞,然后进行检测计数。结果共有182个癌细胞被成功检测到,检测效率为36%。当然也存在着白细胞淋巴细胞也被非特异性吸附的可能,如果辅以本工作后期将要进行的拉曼成像检测,检测准确度将会大大提高。
3 结论
本研究工作开发了一种新颖便捷的CTC 捕获芯片,其对癌细胞捕获的高效率已经为实验所证明。CTC 芯片具有制备简便、价格便宜、分析快速等优点,因而在今后大规模的临床应用中会具有极大的优势。当然目前还只是初步研究,在后期的工作中将会结合表面增强拉曼光谱成像,进一步提高癌细胞分离及检测的灵敏度和精度。同时由于硝酸纤维素膜在蛋白质组学方面的重要应用,将来也可以直接在CTC 芯片上对捕获到的单个癌细胞进行单细胞蛋白质组学[16]的研究。
[1]Mehlen P,Puisieux A.Nat Rev Cancer,2006,6(6):449
[2]Pantel K,Brakenhoff R H,Brandt B.Nat Rev Cancer,2008,8(5):329
[3]Pantel K,Alix-Panabieres C.Trends in Molecular Medicine,2010,16(9):398
[4]Attard G,Swennenhuis J F,Olmos D,et al.Cancer Res,2009,69(7):2912
[5]Nagrath S,Sequist L V,Maheswaran S,et al.Nature,2007,450(7173):1235
[6]Adams A A,Okagbare P I,Feng J,et al.J Am Chem Soc,2008,130(27):8633
[7]Hosokawa M,Hayata T,Fukuda Y,et al.Anal Chem,2010,82(15):6629
[8]Mohamed H,Murray M,Turner J N,et al.J Chromatogr A,2009,1216:8289
[9]Wang S T,Wang H,Jiao J,et al.Angew Chem Int Ed,2009,121:9132
[10]Wang S T,Liu K,Liu J A,et al.Angew Chem Int Ed,2011,123:3140
[11]Yu W W,White I M.Anal Chem,2010,82(23):9626
[12]Lee C H,Hankus M E,Tian L M,et al.Anal Chem,2011,83(23):8953
[13]Lu Y,Shi W W,Qin J H,et al.Anal Chem,2010,82(1):329
[14]Manimaran M,Jana N R.J Raman Spectro,2007,38(10):1326
[15]Shah A M,Yu M,Nakamura Z,et al.Anal Chem,2012,84:3682
[16]Wang W L,Jin W R.Chinese Journal of Chromatography(王文雷,金文睿.色谱),2007,25(6):799
