组蛋白H3赖氨酸27和36位甲基化修饰的鉴定
2013-07-13王国娟张锴何锡文张玉奎
王国娟,张锴*,何锡文,张玉奎,3
(1.南开大学药物化学生物学国家重点实验室,天津 300071;2.南开大学化学学院,天津 300071;3.中国科学院大连化学物理研究所,辽宁大连 116023)
组蛋白翻译后修饰是一类重要的表观遗传学密码[1],它参与细胞中DNA 复制、基因转录、DNA 损伤修复、染色体凝聚等重要的生物过程,不仅与细胞的分化和发育密切相关,也与肿瘤的发生、发展密切联系[2-5]。越来越多的证据表明:组蛋白翻译后修饰将成为新一代重要的疾病标志物和药物调控靶点[6-8]。目前已经报道了组蛋白60多个氨基酸残基上的至少11种翻译后修饰形式,包括乙酰化、甲基化、丙酰化、丁酰化、磷酸化、泛素化、苏素化等[9,10]。由于组蛋白翻译后修饰种类繁多,且随着细胞生理活动而动态变化,因此对传统生物分析技术提出了挑战。近年来,随着高分离能力的色谱技术与高精度、高分辨率质谱技术的迅速发展,基于质谱技术的蛋白质组学方法已成为组蛋白翻译后修饰鉴定和定量分析的重要手段。
目前,基于质谱技术的定量蛋白质组学策略主要有:无标记的质谱定量和基于同位素标记的质谱定量方法。Jensen 等[11]发展了基于分析和计算机策略的无标记质谱法,这一方法可以在多肽水平上获得所有4个核心组蛋白翻译后修饰的相对量。Mann 等[12]发展了SILAC 方法(stable isotope labeling by amino acids in cell culture),将轻、重同位素标记的氨基酸分别加入不同的细胞培养基中,在细胞生长代谢过程中完成对不同样本蛋白质的同位素标记。再将不同标记的样品按一定比例混合,平行处理后,进入质谱检测。通过生物信息学分析,对比轻、重同位素标记的、序列相同肽段的丰度,可以得到不同状态下蛋白质修饰的相对定量关系。Bonenfant 等[13]利用SILAC 法相对定量了HeLa 细胞由S期到G2/M 期多种组蛋白修饰的变化,发现有丝分裂是细胞周期中多种修饰发生动态变化的时期。Garcia 等[14]建立了体外化学衍生同位素标记方法,改进了酶解肽段的疏水性,增加序列覆盖率,可以用于组蛋白修饰的定量分析。
本文在对组蛋白翻译后修饰研究中发现了一些氨基酸序列相同、同种修饰位于不同残基位点的多肽组,这些多肽具有非常相近的色谱行为,通常同时从液相色谱柱上流出进入质谱。由于它们的质荷比(m/z)完全相同,因此在一级质谱中难以分辨,作为同一个母离子被选取并进行碎片裂解,这导致二级碎片的复杂性增加,难以鉴定。本文采用液相色谱与质谱技术联合蛋白质信息学方法,对Hela 细胞组蛋白H3赖氨酸27位和36位上的甲基化和二甲基化修饰的定量分析进行了探讨。
1 实验部分
1.1 主要试剂
改良型RPMI-1640培养基、胎牛血清、青霉素、链霉素(均购于Thermo Scientific 生物化学制品(北京)有限公司);磷酸盐缓冲液(PBS 缓冲液):0.2 g磷酸二氢钾(KH2PO4)、0.2 g 氯化钾(KCl)、1.14 g磷酸氢二钠(Na2HPO4)、8.0 g 氯化钠(NaCl)(均购于Bio Basic Inc.),溶解在500 mL 高纯水(Millipore纯水机制备)中,pH 调至7.4;乙腈和水(购于Fisher Scientific,Pittsburgh,PA,USA),三氟乙酸(Sigma-Aldrich,St.Louis,MO,USA),测序级胰蛋白酶(Promega,Madison,WI,USA),μ-C18 ZipTip(Millipore,Bedford,MA,USA)。
1.2 细胞培养及组蛋白提取
配制含有10%(v/v)胎牛血清及1%(v/v)双抗(青霉素、链霉素)的RPMI-1640培养基。取出冻存的Hela 细胞,快速置于37℃水浴中复苏,加入上述配好的培养基,将Hela 细胞均匀接种在康宁培养皿(d=10 cm)中,放置在37℃下、含有5%(v/v)CO2的细胞培养箱中培养,大约72 h 后,待细胞长至80%满时,收集细胞进行组蛋白提取。
组蛋白提取详细步骤按文献[15]报道的方法进行。主要步骤如下:用预冷的含有5 mmol/L 丁酸钠的PBS 溶液冲洗Hela 细胞两次,每次10 min,离心机转速设置为300 g;加入1 mL 蛋白提取缓冲溶液(Triton X-100 Extraction Buffer,TEB):0.5%(v/v)
Triton X-100、2 mmol/L 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、0.2 g/L 叠氮化钠(NaN3),置于冰上振荡10 min 以裂解细胞,离心,弃去上清液;在残渣中加入0.2 mol/L H2SO4溶液(约400μL)提取组蛋白;离心并转移上清液到新的1.5 mL 离心管中,向其中逐滴加入50%(v/v)的三氯乙酸(trichloroacetic acid,TCA)水溶液,振荡数次,在冰上放置30 min 使沉淀完全,然后离心弃去上清。最后分别用在4℃下预冷的0.1%(v/v)浓盐酸/丙酮溶液和在-20℃下冰冷的100%丙酮冲洗沉淀,离心干燥获取组蛋白。
1.3 组蛋白样品前处理
利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)将提取的组蛋白混合样品分离。切取目标组蛋白胶条,进行胶内酶解[16]:蛋白凝胶条带经脱色、切碎、洗涤、干燥后置于含0.2μg 胰蛋白酶的50 mmol/L的碳酸氢铵溶液(pH=8.0)中,37℃下酶解过夜。提取酶解多肽,离心干燥。最后,多肽经μ-C18 ZipTip 除盐处理,用于后续液相色谱-质谱分析。
1.4 HPLC/MS-MS 分析及数据搜索
采用nano-HPLC/LTQ-orbitrap 质谱仪(Thermo,CA)进行样品分析[17]。将酶解后的多肽溶解在10μL的缓冲溶液A(0.1%(v/v)甲酸水溶液)中,取2μL 溶解后的多肽样品注射到Nano-HPLC 系统(Eksigent Technologies,Dublin,CA)中进行分离。自制毛细管柱(100 mm×75μm)填料为Jupiter C12(粒径4μm,孔径9 nm,Phenomenex,St.Torrance,CA)。液相色谱流动相由初始5%的缓冲溶液B(含0.1%(v/v)甲酸、95%(v/v)乙腈的水溶液)在120 min 内线性变化至95%的缓冲液B。液相色谱分离后的多肽样品经由电喷雾离子源Nano-ESI 引入质谱仪进行分析。质谱仪采用data-dependent 模式,一次MS 扫描后进行20次的二级质谱碎片分析。一级质谱的扫描范围为m/z 350~2000;采用collisionally activated dissociation(CAD)碎片裂解模式,归一化能量为35%;全扫描的Automatic gain control(AGC)值设为1E6。所得到的质谱数据利用Mascot软件在NCBInr 数据库进行搜索[18]。
2 结果与讨论
2.1 组蛋白酶解多肽的鉴定
从Hela 细胞中提取出组蛋白后,采用SDSPAGE 将组蛋白混合物有效分离,酶解成多肽后,采用液相色谱与质谱联用仪检测,借助于Mascot 软件搜索和质谱数据解析,整体考察了Hela 细胞组蛋白H3上的翻译后修饰图谱。根据Mascot 数据检索报告,结合手工分析,对鉴定到的组蛋白H3的多肽序列、修饰位点和鉴定到的数量进行了统计(见表1)。鉴定结果表明,Hela 细胞组蛋白H3上修饰形式复杂,一段多肽上可能有一个、两个,甚至三个氨基酸残基上存在修饰。二级质谱谱图数量的差异进一步表明:这些含有修饰的多肽丰度存在较大不同。另外,本研究发现,氨基酸序列27~40的肽段上赖氨酸K27和K36位点上修饰很丰富,且Kme2-SAPATGGVKmeKPHR和KmeSAPATGGVKme2KPHR的m/z 相同(都是738.44),从液相色谱中同时流出,具有相同的保留时间,因此对它们的鉴定和定量需要进一步分析。
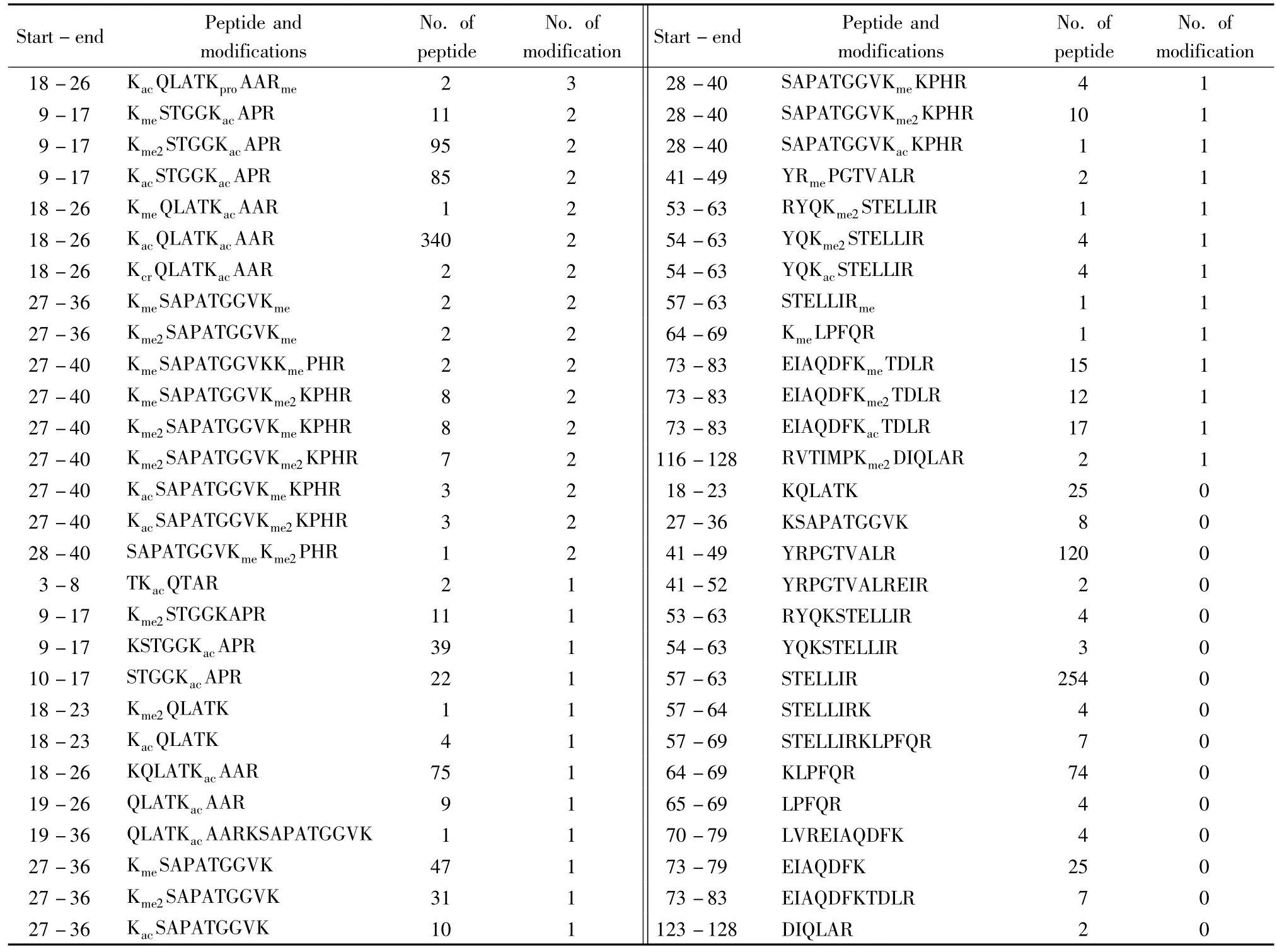
表1 Hela 细胞组蛋白H3多肽鉴定的统计Table 1 A list of all identified tryptic H3 peptides in Hela cells
2.2 H3K27和K36甲基化与二甲基化修饰的鉴定
通过分析修饰肽段的二级质谱碎片(图1),并将b、y 离子的测量值与多肽序列碎片理论值进行对比,推测二级质谱碎片可能是由两组碎片峰叠加组成的。通过b、y 离子的归属分析,进一步确认了单甲基化与二甲基化修饰的修饰位点。图1中红色所示y5离子m/z 值为679.44,y4离子m/z 为537.33,二者相差142.1,恰好等于赖氨酸残基(m/z 128.2)与甲基化修饰(m/z 14)之和的质荷比,由此可知K36带有甲基化修饰;图1中蓝色所示y5*离子的m/z 是693.45,它与y4离子的m/z 差值为156.1,刚好等于赖氨酸残基(m/z 128.2)与二甲基化修饰(m/z 28)之和的质荷比,由此可以确定K36带有二甲基化修饰。采用同样方法可以鉴定K27上的修饰。另外,根据二级质谱图中,二者对应的b10、b11、b13、y2、y3、y4离子的质荷比相等,而b3、b5、y5、y7、y8、y9、y11、y12、y13离子的质荷比相差14,可以进一步验证这一肽段序列上两种修饰的类型和位点。例如y8的m/z 为892.61,根据其他碎片峰的信息,综合判断的多肽为:“GGVKmeKPHR”;而y8*(m/z 906.65)为“GGVKme2KPHR”,二者相差一个甲基的质荷比(m/z 14)。
2.3 H3K27和K36的甲基化与二甲基化修饰的相对丰度分析

图1 赖氨酸27和赖氨酸36位点修饰肽段(amino acid,aa 27-40)的二级质谱图Fig.1 MS/MS spectrum of mixed peptide(aa 27-40)with post-translational modifications(PTMs)at K-27 and/or K-36
由于Kme2SAPATGGVKmeKPHR和KmeSAPATGGVKme2KPHR 在色谱分离时同时出峰,一级质谱峰重叠在一起,且具有相同的质荷比,无法根据它们一级谱图对应峰的强度或者二级碎片谱图的数量来定量分析。因此考察了它们混合二级图谱中不同碎片的丰度。在二级质谱图上,二者的碎片离子b3、b5、y5、y7、y8、y9、y11、y12、y13的m/z 相差14,提取这几对离子中丰度相对最高的3组碎片离子y8、y9、y11进行对比分析。可以看出:Kme2SAPATGGVKmeKPHR 对应的离子y8、y9、y11和KmeSAPATGGVKme2KPHR 对应的y8*,y9*,y11*的相对丰度的比值分别为1.00、0.83和0.92(见表2),平均比值是0.92。由此,我们可以分析这两条多肽对两个修饰位点的贡献。

表2 肽段(aa 27-40)上不同修饰的最强离子丰度表Table 2 List of three most intense ions of distinct peptide species(aa 27-40)
3 结论
本文利用液相色谱与串联质谱联用技术结合蛋白质信息学分析手段,考察了Hela 细胞组蛋白H3的翻译后修饰。通过二级质谱碎片解析,对质荷比相同而修饰位点不同的肽段进行了图谱解析,确定了多肽序列和修饰位点;利用二级碎片离子的丰度比,确定了修饰的丰度差异。对复杂样品中多肽修饰的定性定量分析进行了探索性的研究。
[1]Strahl B D,Allis C D.Nature,2000,403(6765):41
[2]Berger S L.Nature,2007,447(7143):407
[3]Herman J G,Baylin S B.N Engl J Med,2003,349(21):2042
[4]Meissner A.Nat Biotech,2010,28(10):1079
[5]Chi P,Allis C D,Wang G G.Nature Rev,2010,10(7):792
[6]Feinberg A P.Nature,2007,447(7143):433
[7]Jones P A,Baylin S B.Cell,2007,128(4):683
[8]Berdasco M,Esteller M.Dev Cell,2010,19:698
[9]Martin C,Zhang Y.Curr Opin Cell Biol,2007,19:266
[10]Ruthenburg A J,Li H,Patel D J,et al.Nat Rev Mol Cell Biol,2007,8:983
[11]Beck H C,Nielsen E C,Matthiesen R,et al.Mol Cell Proteomics,2006,5(7):1314
[12]Ong S E,Blagoev B,Kratchmarova I,et al.Mol Cell Proteomics,2002,1(5):376
[13]Bonenfant D,Towbin H,Coulot M,et al.Mol Cell Proteomics,2007,6(11):1917
[14]Garcia B A,Mollah S,Ueberheide B M,et al.Nat Protoc,2007,2(4):933
[15]Shechter D,Dormann H L,Allis C D,et al.Nat Protoc,2007,2(6):1445
[16]Zhao Y,Zhang W,Kho Y,et al.Anal Chem,2004,76(7):1817
[17]Chen Y,Kwon S W,Kim S C,et al.J Proteome Res,2005,4(3):998
[18]Chen Y,Sprung R,Tang Y,et al.Mol Cell Proteomics,2007,6(5):812
