血管紧张素(1-7)抑制血管生成的机制
2013-07-12李文敏徐暘陈秀生陈思杨晓帆陈兴露高洋杜红延
李文敏 徐暘 陈秀生 陈思 杨晓帆 陈兴露 高洋杜红延
•综 述•
血管紧张素(1-7)抑制血管生成的机制
李文敏 徐暘 陈秀生 陈思 杨晓帆 陈兴露 高洋★杜红延★
血管紧张素(1-7)[angiotensin-(1-7),Ang-(1-7)]是肾素-血管紧张素系统(renin-angiotensin system,RAS)中新近发现的一种内源性七肽氨基酸肽类激素,通过与血管紧张素II(angiotensin II,Ang II)生理功能相互拮抗,使体内的血管内皮生长因子(vascular endothelial growth factor,VEGF),胎盘生长因子(Placental growth factor,PLGF)和环氧化酶-2(cyclooxygenase-2,COX-2)等明显下调,抑制肿瘤血管的增生以及癌细胞的生长,从而防止肿瘤在体内的发生、发展和转移。本文综述了血管紧张素(1-7)抑制肿瘤血管增生和肿瘤生长等方面作用的研究以及与临床癌症试验相关的研究进展,有望为肿瘤的预防和治疗等研究提供新的方向。
Ang-(1-7);癌症;血管抑制;研究进展
肿瘤转移是危及肿瘤患者生命最主要的恶性行为特征。肿瘤细胞可通过对周围组织直接浸润、血管转移和淋巴管转移等多种方式在体内扩散。大量研究表明,肿瘤血管生成是肿瘤恶性转化,生长和转移的生物基础和重要环节。因此,有效抑制新血管在肿瘤组织内的生长就能直接抑制肿瘤的生长,也会使已有的肿瘤萎缩。并且,抑制血管的生成还能减少肿瘤细胞经血液的扩散,从而达到抑制肿瘤恶性转移的作用。抑制肿瘤血管生成已成为临床治疗肿瘤的有效途径。本文就血管紧张素(1-7)[angiotensin-(1-7),Ang-(1-7)]抑制血管生成的功能和机制研究,以及临床治疗研究进展展开综述,并讨论Ang-(1-7)在肿瘤预防和治疗方面的应用前景。
1 Ang-(1-7)概述
血管紧张素(angiotensin),亦称血管收缩素或血管张力素,是一种寡肽类激素,也是RAS系统(reninangiotensin system)的重要组成部分。血管紧张素能引起血管收缩,血压升高;促进肾上腺皮质释放醛固酮(aldosterone),同时也具有很强的致渴作用。血管紧张素原(angiotensinogen,AGT)主要是由肝脏合成并释放入血的一种血清球蛋白,在血浆肾素作用下酶解为血管紧张素Ⅰ(angiotensin I)。AngⅠ可被血管紧张素转换酶(angiotensin-converting enzyme,ACE)降解为血管紧张素II(angiotensin II),还可被血管紧张素转换酶2(angiotensin 2)降解为Ang-(1-7)[1]。
Ang-(1-7)是RAS系统中新近发现的一种对AngⅡ具有拮抗作用的内源性生物活性物质,具有扩张血管、降低血压和抗细胞增殖等作用,并可拮抗AngⅡ与其AT1受体结合产生的收缩血管、升高血压、尿钠潴留和细胞增殖等作用。简单来说,即Ang-(1-7)和AngⅡ是RAS系统的2条不同通路中的重要调节肽,且在肿瘤细胞增殖和血管生成的作用上发挥完全拮抗的生理功能[2]。笔者总结了目前RAS系统的相互转化以及功能的研究,它们之间的相互关系如图1所示。
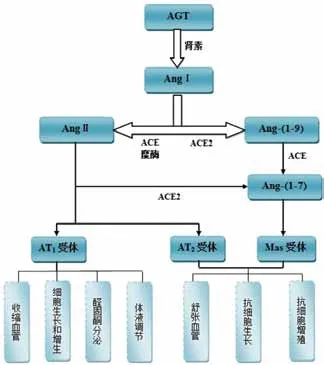
图1 肾素-血管紧张素系统(RAS)转化和功能示意图Figure 1 The schematic diagram of the transformation and function of the renin-angiotensin system
人们通过Ang-(1-7)能与AngII相互拮抗的生理现象,猜测Ang-(1-7)能够通过拮抗AngII的生理作用来抑制血管的生成和肿瘤的转移。有研究表明AngII 与血管内皮细胞表面的受体结合,可激活细胞内的第二信使,并通过诱导细胞入侵及组织新生管状结构的形成等一系列作用,实现其促进血管增生、组织修复与生长的作用。VEGF与受体的结合刺激血管内皮细胞增殖,增加血管的通透性,有助于肿瘤细胞入侵血管,促进肿瘤侵袭和转移。国内外多项实验均表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)与肿瘤的转移相关[3~5]。
在多种类型的肿瘤细胞中均发现AngⅡ与VEGF的表达量呈正相关,两者的浓度都普遍高于正常组织细胞,因此考虑Ang-(1-7)拮抗AngⅡ的同时能够下调VEGF的含量,达到抑制肿瘤细胞生长的作用。
此外,Ang-(1-7)不可被血管紧张素II-1型受体(AT1 receptor)或血管紧张素II-2型受体(AT2 receptor)的拮抗剂抑制,但能被Ang-(1-7)的受体拮抗剂[D-Ala7]-Ang-(1-7)显著抑制。提示Ang-(1-7)并不是通过AT1或AT2受体,而是通过Mas受体来发挥抗肿瘤细胞增殖与抗血管生成作用[6]。
目前普遍认为肿瘤的发生发展与血管的新生密切相关,人们在总结Ang-(1-7)对心血管系统的调节作用的基础上,推测Ang-(1-7)对肿瘤生长的抑制作用[7],为基于ACE2/Ang-(1-7)/Mas途径的新药研发提供参考。同时,也可以通过AT1受体抑制剂与Ang-(1-7)的联合应用,更好地抑制肿瘤的生长和肿瘤血管的生成,为肿瘤治疗提供新的思路与方向。
2 Ang-(1-7)与癌症
研究发现Ang-(1-7)对肺癌、前列腺癌、结肠腺癌和乳腺癌等都有一定的抑制作用,其中目前研究较多的为肺癌和前列腺癌。通过大量实验研究和数据分析发现,Ang-(1-7)主要通过下调VEGF等血管生成因子来抑制肿瘤血管的生成,防止肿瘤的浸润和转移。同时,通过抑制蛋白酪氨酸磷酸酶 (MAP kinase) 和COX-2信号通路来发挥抑制癌细胞增殖和促进其凋亡的作用。此外,通过该通路,Ang-(1-7)还能够显著的减少转化生长因子-β(transforming growth factor-β,TGF-β)的量,并降低细胞外信号调节激酶将近一半的生理活性,从而起到抑制肿瘤生长的作用。因此,探究Ang-(1-7)抑制肿瘤血管生成和肿瘤生长的机制,为肿瘤治疗开辟新的思路,成为近年来肿瘤研究的热点之一。
2.1 Ang-(1-7)与肺癌
肺癌是最常见的肺原发性恶性肿瘤,近30年来,肺癌的发病率和病死率均迅速上升,死于癌病的男性病人中肺癌已居首位。绝大多数肺癌起源于支气管粘膜上皮,故亦称支气管肺癌。Gallagher等[6]首次在3组体外培养的人肺癌细胞研究中,发现Ang-(1-7)可通过靶向激活肺癌细胞上的Mas受体,从而抑制肺癌细胞的增殖。提示Ang-(1-7)可能作为一种内源性调节细胞生长因子,通过靶向作用于Mas受体进而发挥作用,为肺癌提供潜在的化学治疗方法。Soto-Pantoja等[8]通过研究肺癌细胞异种移植模型发现,在无胸腺小鼠体内,Ang-(1-7)对肺肿瘤的生长抑制作用可能与其下调VEGF表达水平有关。Ni等[9]通过对A549人肺癌细胞的研究,发现Ang-(1-7)是通过联合作用于MAPK和PI3K/Akt信号通路来抑制肿瘤细胞的转移和侵袭。de Jonge等[10]在已完成的Ⅰ期临床试验中发现,在接受Ang-(1-7)药物治疗的18名患者中,4名患者的预后显示与一种VEGF家族中胎盘生长因子(placental growth factor,PIGF)的下调有关。同时,治疗效果不明显的患者中并未观察到PIGF的明显变化。这表明Ang-(1-7)导致体内PIGF下调的机制并不是简单的线性相关关系,目前对Ang-(1-7)抗肿瘤效果的体内机制仍不是十分清楚,需要进一步的研究确定Ang-(1-7)与PIGF之间相互影响的方式。
2.2 Ang-(1-7)与前列腺癌
前列腺癌是男性泌尿生殖系肿瘤中最常见的一种恶性肿瘤,在男性恶性肿瘤中约占33%,是前列腺腺泡细胞异常无序生长的结果[11]。Krishnan等[12]通过用人PC3前列腺癌细胞分别接种经Ang-(1-7)处理五周的无胸腺小鼠以及无预处理的无胸腺小鼠,结果显示经Ang-(1-7)预处理的小鼠在第六周时仍无一例小鼠诱发前列腺癌,而未经预处理的对照组中,有83%的小鼠诱发前列腺癌,其几率明显高于经Ang-(1-7)预处理的小鼠。同时,Krishnan等[13]通过对已患人前列腺癌的无胸腺小鼠进行为期54天的Ang-(1-7)治疗,其免疫原性试验显示经Ang-(1-7)治疗的肿瘤小鼠,MAPK激酶 ERK1/2的磷酸化程度明显高于未经Ang-(1-7)治疗的小鼠,且其生物发光和核磁共振成像技术分析也显示经处理小鼠的转移瘤的体积及其湿重都显著小于对照组,瘤内血管密度也相对较低。其机制与Ang-(1-7)下调VEGF和PIGF的生成有关,伴随着这些抑制血管细胞生成和增殖的因子的减少,可溶性血管内皮生长因子受体sFlt-1也相应增加。而sFlt-1是VEGF和PIGF的假性受体,能够通过与VEGF和PIGF的特异性结合而减少其与正常受体的结合,从而限制了前列腺癌在大鼠中的发生和转移[14]。
2.3 Ang-(1-7)与结肠腺癌
结肠腺癌是结肠癌中最常见的一种类型,是结肠腺上皮来源的常见消化道恶性肿瘤。结肠癌起病隐匿,死亡率仅次于肺癌和肝癌,占我国恶性肿瘤第三位[15]。Bernardi等[16]对33例人结肠腺癌样本以及对照样本——正常结肠粘膜样本进行分析,发现ACE、Mas受体基因在人结肠腺癌细胞中表达量均明显上升,并且ACE酶活力显著上升。同时,通过对两株结肠癌细胞(CaCo-2和HT29)的研究,发现Ang-(1-7)不改变肿瘤细胞的细胞周期,但可使结肠癌细胞中过表达的Mas受体激活,提示Mas受体可作为肿瘤的早期诊断靶标,且通过Ang-(1-7)干预可特异性激活Mas受体发挥对肿瘤的治疗作用。
2.4 Ang-(1-7)与乳腺癌
乳腺癌是全世界女性最常见的癌症,全世界每年约有50万人死于乳腺癌。在欧美国家,平均每4个女性癌症患者中就有1个罹患的是乳腺癌[17]。Cook等[18]用Ang-(1-7)处理罹患ZR-75-1和BT-474乳腺癌的裸鼠模型,发现经Ang-(1-7)处理的肿瘤小鼠肿瘤的体积明显缩小,数据显示,经药物Ang-(1-7)处理后的患ZR-75-1乳腺癌的小鼠其肿瘤体积与对照组相比减少了25%。经Ang-(1-7)处理的BT-474肿瘤小鼠的肿瘤体积也比未用药前减少了29.2%。体外细胞实验检测也同时说明经Ang-(1-7)的处理可明显减少肿瘤细胞的间质性纤维化程度,从而达到抑制肿瘤细胞生长的作用。数据显示,经Ang-(1-7)处理后的ZR-75-1肿瘤细胞的细胞内间质性纤维化程度比未经药物处理的对照组减少了64%,经Ang-(1-7)处理的BTP-474肿瘤细胞的细胞内间质性纤维化程度与对照组相比减少75%。Santos等[19,20]发现,Ang-(1-7)与Mas受体结合后,可有效的提高MAPK磷酸酶的活性,通过对MAPK的去磷酸化而降低MAPK的活性,进而减少TGF-β和肿瘤纤维母细胞的纤连蛋白的产生,减少肿瘤相关的纤维母细胞的生长,从而达到抑制乳腺癌生长的作用。Rodgers等[21]在Ⅰ期和Ⅱ期临床实验中也显示,每天100μg/kg的Ang-(1-7)辅助给药,能够安全有效地减少乳腺癌肿瘤的复发率,延长女性的生存期。
总之,Ang-(1-7)抗肿瘤作用主要涉及以下几个分子信号通路[22]。一方面Ang-(1-7)可通过靶向激活肿瘤细胞上的Mas受体,显著降低MAPK激酶的表达,抑制Ras-Raf-MEK-ERK信号转导通路中ERK1/2的磷酸化激活途径,从而抑制癌细胞的增殖。另一方面,Ang-(1-7)的抑癌作用可能与其下调COX-2表达水平有关。COX-2表达水平的下调可以降低促炎的前列腺素E2(prostaglandin E2,PGE2)生成,抑制肿瘤的生长[23,24]。值得一提的是,Ang-(1-7)还可通过降低血管内皮细胞生长因子VEGF家族中胎盘生长因子PIGF的含量,抑制肿瘤血管的生成[25]。在已有的研究中,笔者归纳其体内抗肿瘤作用主要的分子信号通路如图2所示。

图 2 Ang-(1-7)抗肿瘤作用的主要分子信号通路Figure 2 The major molecular signaling pathways of anticancer effect targeted by Ang-(1-7)
3 总结和展望
Ang-(1-7)对肺癌、前列腺癌、乳腺癌、肝癌等多种癌症都发挥抗肿瘤和抑制肿瘤细胞转移的作用。且针对该分子的药物也已开展了相应的Ⅱ期临床试验。通过观察4名接受Ang-(1-7)药物治疗的肺癌患者的预后,发现其病情的改善与一种VEGF家族中胎盘生长因子PIGF的下调有关,但Ang-(1-7)与PIGF之间的相互通路和分子机制尚未清楚。我们的前期研究已经发现,Ang-(1-7)对肝癌发生、发展有一定的抑制作用。本课题组拟进一步深入开展研究,探讨Ang-(1-7)与肝癌之间的相互关系及其分子机制。寻找原发性肝癌发病机制中的关键分子作为有效的治疗靶点对于延长患者的生存期和提高生存质量具有非常重要的意义,并为其他肿瘤的研究以及进一步临床探究提供依据和借鉴。
[1] 何疆春, 杨晔, 费宇行. 作用于肾素-血管紧张素系统的药物进展[J]. 心肺血管病杂志, 2009, 28(6): 434-437.
[2] 杜慧, 缪朝玉. Ang-(1-7)及其Mas受体的研究进展[J]. 第二军医大学学报, 2011, 32(6): 667-671.
[3] Matsumoto M, Roufail S, Inder R, et al. Signaling for lymphangiogenesis via VEGFR-3 is required for the early events of metastasis[J]. Clin Exp Metastasis, 2013.
[4] Geng L, Chaudhuri A, Talmon G, et al. TGF-Beta Suppresses VEGFA-mediated angiogenesis in colon cancer metastasis[J]. PLoS One, 2013, 8(3): e59918.
[5] Giuliano S, Pagès G. Mechanisms of resistance to antiangiogenesis therapies[J]. Biochimie, 2013, 95(6): 1110-1119.
[6] Gallagher P E, Tallant E A. Inhibition of human lung cancer cell growth by angiotensin-(1-7)[J]. Carcinogenesis, 2004, 25(11): 2045-2052.
[7] Gallagher P E, Cook K, Soto-Pantoja D, et al. Angiotensin peptides and lung cancer[J]. Curr Cancer Drug Targets, 2011, 11(4): 394-404.
[8] Soto-Pantoja D R, Menon J, Gallagher P E, et al. Angiotensin-(1-7) inhibits tumor angiogenesis in human lung cancer xenografts with a reduction in vascular endothelial growth factor[J]. Mol Cancer Ther, 2009, 8(6): 1676-1683.
[9] Ni L, Feng Y, Wan H, et al. Angiotensin-(1-7) inhibits the migration and invasion of A549 human lung adenocarcinoma cells through inactivation of the PI3K/Akt and MAPK signaling pathways[J]. Oncol Rep, 2012, 27(3): 783-790.
[10] de Jonge M J, Hamberg P, Verweij J, et al. Phase I and pharmacokinetic study of pazopanib and lapatinib combination therapy in patients with advanced solid tumors[J]. Invest New Drugs, 2013, 31(3): 751-759.
[11] 孟庆超, 王禾, 于磊, 等. Bag- 1及Bcl- 2在前列腺癌组织中的表达及意义[J]. 现代肿瘤医学, 2007, 15(3): 366-368.
[12] Krishnan B, Smith T L, Dubey P, et al. Angiotensin-(1-7) attenuates metastatic prostate cancer and reduces osteoclastogenesis[J]. Prostate, 2013, 73(1): 71-82.
[13] Krishnan B, Torti F M, Gallagher P E, et al. Angiotensin-(1-7) reduces proliferation and angiogenesis of human prostate cancer xenografts with a decrease in angiogenic factors and an increase in sFlt-1[J]. Prostate, 2013, 73(1): 60-70.
[14] Krysiak O, Bretschneider A, Zhong E, et al. Soluble vascular endothelial growth factor receptor-1 (sFLT-1) mediates downregulation of FLT-1 and prevents activated neutrophils from women with preeclampsia from additional migration by VEGF[J]. Circ Res, 2005, 97(12): 1253-1261.
[15] Peto J. Cancer epidemiology in the last century and the next decade[J]. Nature, 2001, 411(6835): 390-395.
[16] Bernardi S, Zennaro C, Palmisano S, et al. Characterization and signi fi cance of ACE2 and Mas receptor in human colon adenocarcinoma[J]. J Renin Angiotensin Aldosterone Syst, 2012, 13(1): 202-209.
[17] 颜文贞, 王芳, 戴东. 个体化健康教育对乳腺癌患者术后康复的影响[J]. 广东医学, 2010, 31(6): 715-716.
[18] Cook K L, Metheny-Barlow L J, Tallant E A, et al. Angiotensin-(1-7) reduces fibrosis in orthotopic breast tumors[J]. Cancer Res, 2010, 70(21): 8319-8328.
[19] Santos R A, Ferreira A J, Simões E Silva A C. Recent advances in the angiotensin-converting enzyme 2-angiotensin(1-7)-Mas axis[J]. Exp Physiol, 2008, 93(5): 519-527.
[20] Santos R A, Simoes e Silva A C, Maric C, et al. Angiotensin-(1-7) is an endogenous ligand for the G protein-coupled receptor Mas[J]. Proc Natl Acad Sci U S A, 2003, 100(14): 8258-8263.
[21] Rodgers K E, Oliver J, Dizerega G S. Phase I/II dose escalation study of angiotensin 1-7 [A(1-7)] administered before and after chemotherapy in patients with newly diagnosed breast cancer[J]. Cancer Chemother Pharmacol, 2006, 57(5): 559-568.
[22] Machado R D, Santos R A, Andrade S P. Mechanisms of angiotensin-(1-7)-induced inhibition of angiogenesis[J]. Am J Physiol Regul Integr Comp Physiol, 2001, 280(4): R994-R1000.
[23] Joo Y E, Rew J S, Seo Y H, et al. Cyclooxygenase-2 overexpression correlates with vascular endothelial growth factor expression and tumor angiogenesis in gastric cancer[J]. J Clin Gastroenterol, 2003, 37(1): 28-33.
[24] Soumaoro L T, Uetake H, Takagi Y, et al. Coexpression of VEGF-C and Cox-2 in human colorectal cancer and its association with lymph node metastasis[J]. Dis Colon Rectum, 2006, 49(3): 392-398.
[25] Renno W M, Al-Banaw A G, George P, et al. Angiotensin-(1-7) via the mas receptor alleviates the diabetes-induced decrease in GFAP and GAP-43 immunoreactivity with concomitant reduction in the COX-2 in hippocampal formation: an immunohistochemical study[J]. Cell Mol Neurobiol, 2012, 32(8): 1323-1336.
Mechanism of angiotensin-(1-7) suppress angiogenesis
LI Wenmin, XU Yang, CHEN Xiusheng, CHEN Si, YANG Xiaofan, CHEN Xinglu, Gao Yang★,DU Hongyan★
(School of Biotechnology, Southern Medical University, Guangdong, Guangzhou 510515, China)
Angiotensin-(1-7), an endogenous seven-amino acid peptide hormone, was discovered in the renin-angiotensin system. The antagonism of angiotensin-(1-7) and angiotensin II (Ang II) were obviously down-regulated the expression of vascular endothelial growth factor (VEGF), placental growth factor (PLGF) and cyclooxygenase-2 (COX-2) to inhibit angiogenesis and the growth of cancer cells, thereby prevented the tumor occurrence, development and metastasis in vivo. This paper reviewed the angiotensin-(1-7) inhibited tumor angiogenesis and the growth of tumor, and the research progress of clinical cancer trial, which was expected to provide new ways for the prevention and treatment of tumor.
Angiotensin-(1-7); Cancer; Antiangiogenesis; Research progress
国家高新技术研究发展计划(863计划)(2012AA020205);2012年广东省“大学生创新实验计划”(1212112026);国家级大学生创新创业训练计划创新训练项目(201312121024)
南方医科大学生物技术学院,广东,广州 510515
★通讯作者:高洋,杜红延,E-mail:gzduhongyan@126.com
注:高洋,杜红延为共同通讯作者
