乙草胺对玉米中谷胱甘肽转移酶的诱导作用
2013-07-12胡阿曼
陶 波,胡阿曼
(东北农业大学农学院,哈尔滨 150030)
乙草胺(Acetochlor)是美国孟山都公司于1971年开发成功的一种芽前选择性除草剂[1]。主要用于大豆、棉花、花生、玉米等作物防除一年生禾本科杂草及部分小粒种子阔叶杂草[2]。由于乙草胺具有杀草谱广、价格较低优点,在全国应用广泛。虽然乙草胺广泛用于玉米田,但乙草胺过量使用对玉米产生严重药害。目前,国外生产的乙草胺都加入安全剂来保护作物,减少作物遭受危害,从而解决乙草胺药害问题,而我国大多省份所用乙草胺均未加入相应的安全剂。因此,研究乙草胺对玉米的敏感性和乙草胺诱导玉米体内谷胱甘肽(Glutathione,GSH)和谷胱甘肽转移酶(Glutathione S-transferases,GST)产生抗除草剂作用具有重要意义。谷胱甘肽(GSH)是一种抗氧化剂,它在植物脱毒和维持氧化还原缓冲液中起重要作用[2-3]。GSH自身并不能起到脱毒作用,必须在谷胱甘肽转移酶(GST)催化下,才能与有毒物质产生反应,将其转化为无害或低毒物质[4-5]。国内外研究表明,玉米品种对乙草胺的敏感性存在显著差异,因乙草胺诱导不同玉米体内产生的GSH含量和GST活性不同。乙草胺在玉米体内主要降解反应是轭合作用,通常在玉米体内,乙草胺在谷胱甘肽转移酶(GST)催化下迅速与谷胱甘肽(GSH)进行轭合反应,使乙草胺丧失活性[6-9]。陶波等研究表明,在植物发育期除草剂能够诱导GST表达[10-11]。利用浸种处理方法诱导玉米高量GSH和GST未见报道。因此,本试验验证在除草剂乙草胺浸种处理下能否诱导出玉米中GSH含量和GST活力,研究GST活性的诱导因子[12-15],为明确乙草胺在玉米中的作用机制、培育具有抗逆及抗除草剂转基因作物和提高玉米田中使用乙草胺安全性提供理论依据。
1 材料与方法
1.1 供试材料
供试玉米品种:Lx347(自交系)、P138(自交系)、东青1号(杂交种)、东农0701B(杂交种),以上品种均由东北农业大学玉米教研室提供。
1.2 供试药剂
1.2.1 除草剂
乙草胺(Acetochlor,孟山都公司生产,90%禾耐斯)。
1.2.2 供试试剂
5%TCA;10 mmol·L-1DTNB(溶于 0.5 mol·L-1pH 8磷酸缓冲液配制);酶提取液(0.1 mol·L-1pH 6.5磷酸钾缓冲液内含5%聚乙烯吡咯烷酮及1 mmol·L-1偏重亚硫酸钠);3.0 mmol·L-1谷胱甘肽(溶于0.1 mol·L-1pH 6.5磷酸钾缓冲液);20 mmol·L-1溶于96%乙醇的CDNB。
1.3 方法
1.3.1 玉米的培养及诱导
将精选玉米种子用60℃左右温水浸泡30 min(加热至60℃后拿出水浴锅,将种子置于水中),再用0.6%多菌灵浸泡30 min,用蒸馏水冲洗干净,分别用乙草胺(浓度为10、20、40、60 mg·L-1)浸种12 h左右,再用蒸馏水清洗干净,放在温度27℃、湿度75%的培养箱内,催芽24 h左右。
将干净的玻璃板上平铺一张与平板相同大小的湿润滤纸,选择同一处理的玉米种子10粒,脐部朝下,均匀摆放平板上,再在种子上面覆盖一层湿润滤纸,将平板垂直放置在水槽中,每个处理重复3次,将水槽放置培养箱内培养(温度27℃、湿度75%、光照8 h,黑暗各16 h循环培养)。每天向水槽中加水,保持水位一致,当玉米生长7 d后,测定玉米GSH含量和GST活力。
1.3.2 GSH含量的测定
标准曲线的绘制,参照采用Ellman原理,用磷酸缓冲液配制 500 μg·mL-1GSH 母液,分别取 0、 5、 25、 50、 100、 150、 200、 250、 500、1 000 μL,各加入5%TCA,分别向配好的系列标准液加入适量DTNB显色,20℃水浴5 min使其充分显色,在412 nm下测定OD值。
分别取玉米植株的根、茎、叶各0.2 g,加5%TCA,在0~4℃下研磨,放入离心管中离心(15 000 g)20 min,取部分离心后的上清液放入试管,加入pH 8.0磷酸缓冲液,再加入DTNB显色,20℃水浴5 min使其充分显色,然后在412 nm下测定OD值。

1.3.3 GST活性测定
应用Habig和陶波方法[4],并稍作改进,分别取玉米植株的根、茎、叶各0.2 g,加入酶GST提取液,在0~4℃下研磨,放入离心管中离心(15 000 g)20 min,上清液为待测酶液。取出待测酶液,向待测酶液中加入pH 6.5磷酸钾缓冲液,最后加入溶于96%乙醇的CDNB,340 nm反应5 min,每隔1 min测定OD值。
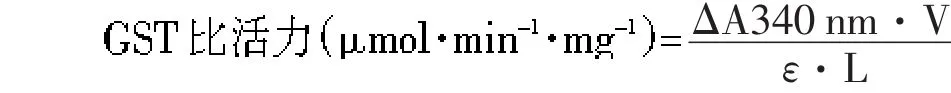
式中,ΔA340 nm为每分钟光吸收的变化值,V为酶促反应体积,ε为产物的消光系数(0.0096 L·μmol-1·cm-1),L为比色杯光程(1 cm)。

2 结果与分析
2.1 乙草胺对玉米不同品种生长发育的影响
如表1所示,不同玉米品种对乙草胺的敏感性不同,同一玉米品种苗和根的敏感性也不同,敏感性与乙草胺浓度具有显著的相关性。按照株高抑制率GR50(抑制株高50%的值,即抑制中浓度)从大到小为:Lx347、P138、东青1号、东农0701B。由此可知,对乙草胺的敏感性从低到高为:Lx347、P138、东青1号、东农0701B,自交系Lx347和P138比杂交种东青1号和东农0701B的抗性高,并且根长与株高GR50趋势相同,但是株高的GR50明显低于根长GR50,因此株高对乙草胺敏感高于根长。

表1 乙草胺对不同玉米品种株高和根长的敏感性Table 1 Sensibility of acetochlor on plant height and root length of different maize varieties
2.2 乙草胺对玉米谷胱甘肽(GSH)的影响
2.2.1 不同浓度乙草胺对玉米谷胱甘肽(GSH)含量的影响

图1 不同浓度乙草胺对玉米叶片GSH含量的影响Fig.1 Effect of different concentrations of acetochlor on GSH content of maize leaves
从图1可以看出,对四种玉米品种叶片中GSH含量进行测定,结果表明,随着乙草胺处理剂量的增加对不同玉米品种叶片的GSH含量影响不同,在低浓度时随着浓度的增高GSH含量增加,其中在40 mg·L-1时各品种GSH含量增长率达到最高,在60 mg·L-1GSH含量增长率开始下降。在乙草胺40 mg·L-1诱导下,不同玉米品种GSH含量的增长率有明显差异,Lx347品种增长率达到26.32%,其他品种增加幅度不明显,增长率最小为东农0701B。由此可知,乙草胺对玉米的敏感性与玉米体内GSH含量有关。
2.2.2 乙草胺对玉米各部位谷胱甘肽(GSH)含量的影响
图2为乙草胺浓度为40 mg·L-1浸种诱导,结果表明,不同品种GSH含量有明显差异,同一品种各部位GSH含量增长率也明显不同,对叶部的诱导作用大于茎部和根部,其中Lx347叶部GSH增长率最高,是其他玉米品种的1倍左右。根部GSH含量的增加幅度不大,东农0701B品种根部基本没有受到诱导作用。由此可知,乙草胺对玉米叶部GSH含量产生影响最为明显,这同玉米根长比株高对乙草胺敏感相对应,并且进一步说明玉米对乙草胺的敏感性与玉米叶的GSH含量有关。
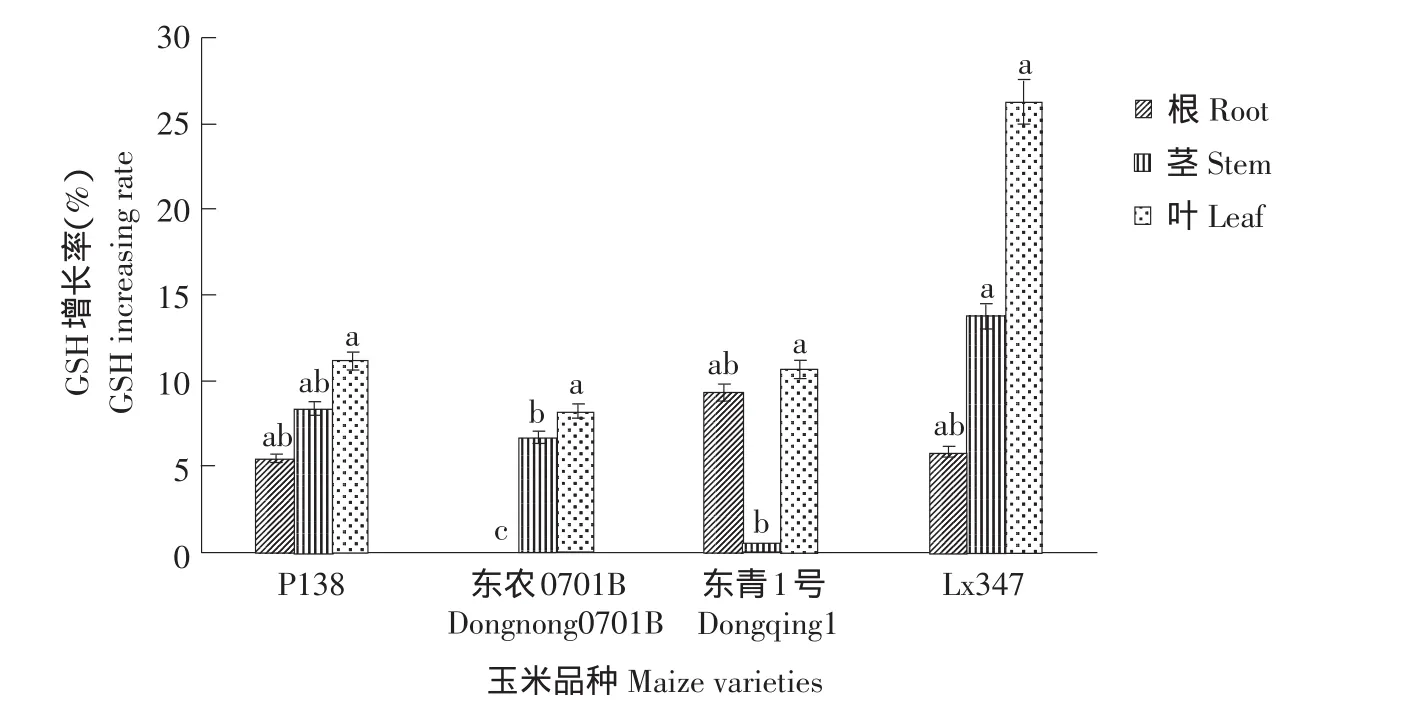
图2 乙草胺对玉米各部位GSH含量的影响Fig.2 Effect of acetochlor on GSH content of maize varieties parts
2.3 乙草胺对不同玉米品种GST活性的影响
2.3.1 不同浓度乙草胺对玉米谷胱甘肽转移酶(GST)活性的影响
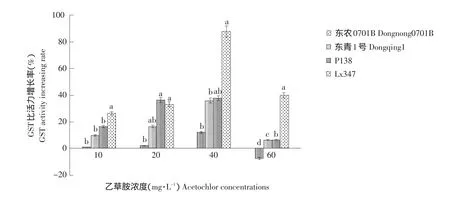
图3 不同浓度乙草胺对玉米叶片GST活性的影响Fig.3 Effect of different concentrations of acetochlor on GST activity of maize leaves
由图3可知,不同浓度乙草胺浸种处理对玉米叶部GST比活力有明显影响,且呈现一定的规律性,不同乙草胺处理剂量下,各品种GST活性有显著差异,其中在40 mg·L-1时各品种GST比活力增长量达到最高,在60 mg·L-1时,GST比活力增长量开始下降,并且对乙草胺敏感的东农0701B GST比活力呈负增长现象。这种规律与试验测得的GSH含量增长规律相同。因此,乙草胺对玉米的敏感性和乙草胺诱导玉米体内的GSH和GST产生抗除草剂作用相关。GSH通过GST催化与乙草胺产生轭合反应,因此玉米体内GSH含量和GST活性是影响玉米对乙草胺敏感性不同的原因。
2.3.2 乙草胺对玉米各部位谷胱甘肽转移酶(GST)的影响
结果见图4。
图4为乙草胺浓度为40 mg·L-1浸种诱导,结果表明,同一品种各部位GST比活力增长率也明显不同,对叶部GST比活力的诱导效果最为明显,诱导作用大于根部和茎部。其中GST比活力增长最高的Lx347品种叶部增长率可达83.3%,是东农0701B叶部GST比活力的7倍。根部和茎部GST比活力增幅不大,Lx347品种叶部GST比活力是东农0701B根部比活力的83倍。由此可知,乙草胺对玉米叶部GST比活力诱导效果最为明显,这与玉米根长比株高对乙草胺敏感相对应,试验测定玉米叶部GSH含量增长量高于其他部位相同。
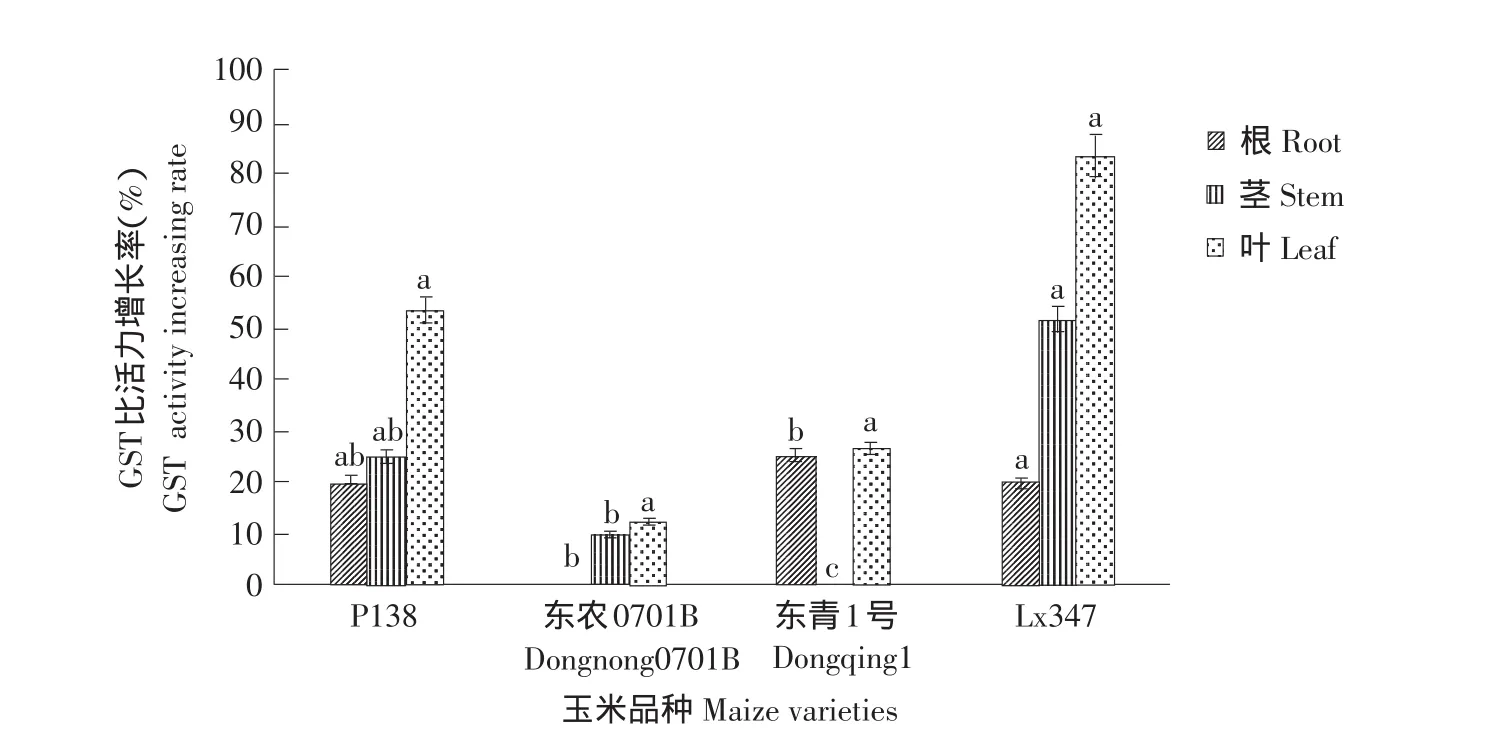
图4 乙草胺对玉米各部位GST比活力的影响Fig.4 Effect of acetochlor on GST activity of maize varieties parts
3 讨论
大量研究表明,乙草胺对玉米体内抗除草剂酶(GST)的诱导作用明显。研究表明,不同玉米组织部位的GST活性具有显著差异[8-9]。李美等曾提出自交系对乙草胺的敏感性低[10]。本试验结果表明,不同玉米品种对乙草胺的敏感性不同,自交系比杂交种抗性高。这一结果与前人研究结果基本一致,但是与金益提出的玉米杂种优势结果[17]不同,这可能是由于玉米杂交种不一定具有杂种优势,反而自交系能够稳定遗传。因此,在使用除草剂乙草胺除草的区域,应选择对乙草胺耐药性较高的玉米品种进行种植,如Lx347自交系,提高玉米品种对乙草胺耐药性,减轻乙草胺对玉米造成的药害损失。
有学者提出玉米对乙草胺耐受程度不同是由于玉米体内谷胱甘肽含量和谷胱甘肽转移酶活性不同引起的[4]。谷胱甘肽转移酶(GST)能够催化谷胱甘肽(GSH)与有毒物质发生轭合反应达到脱毒、抗逆和抗除草剂目的。本研究发现,适量浓度的乙草胺能有效促进玉米产生大量GSH和GST,并且不同玉米品种GSH含量增长率和GST比活力增长率有明显差异。对乙草胺安全性高的品种GSH含量增长量和GST比活力增长量都相对较高。这一结果说明了不同玉米品种对乙草胺敏感性不同的原因。综上所述,适量浓度乙草胺诱导玉米产生的大量GSH和GST能够使玉米抵御外界不良环境和其他伤害。这一发现也为某些化学诱导剂提高植物的抗逆性和抗除草剂性能奠定理论基础。
4 结论
通过生物化学方法,测定乙草胺诱导后玉米的生长发育指标、各部位GSH含量和GST比活力。试验结果表明,不同玉米品种对乙草胺的敏感性不同,杂交种东农0701B玉米品种敏感性最高,自交系Lx347玉米品种敏感性最低。在乙草胺不同浓度诱导下,玉米体内GSH含量和GST比活力增长量有显著差异,诱导浓度为40 mg·L-1时,各品种不同部位GSH含量和GST比活力都达到最大值,叶部增长量显著高于根部和茎部。
[1]苏少泉.酰胺类除草剂评述[J].农药,2002,41(11):1-5.
[2]张岩,胡军,郭长虹,等.植物谷胱甘肽-S-转移酶的分子生物学研究进展[J].哈尔滨师范大学自然科学学报,2007,23(4):76-79.
[3]杨海灵,聂力嘉,朱圣庚,等.谷胱甘肽硫转移酶结构与功能研究进展[J].成都大学学报:自然科学版,2006,25(1):19-24.
[4]Ding W,Ma F M,Zhuo Cheng,et al.Effect of chlorimuron-ethyl on biochemical mechanism in tolerant sugar beet[J].Agricultural Sciences in China,2010,9(12):1771-1776.
[5]Zhang C H,Ying G.Response of glutathione and glutathione s-transferase in rice seedlings exposed to cadmium stress[J].Rice Science,2008,15(1):73-76.
[6]Xu G,Tao B.Induction of glutathione and glutathione s-transferase in several crops with the treatment of acetochlor[J].Journal of Northeast Agricultural University:English Edition,2003,10(2):161-165.
[7]Rossini L,Frova C,Pã¨M E,et al.Alachlor regulation of maize glutathione S-transferase genes[J].Pesticide Biochemistry and Physiology,1998,60(3):205-211.
[8]郭玉莲,陶波,高希武.玉米谷胱甘肽转移酶(GSTs)特性及除草剂的诱导作用[J].玉米科学,2008,16(1):122-125.
[9]郭玉莲,陶波,郑铁军,等.植物谷胱甘肽S-转移酶(GSTS)及除草剂解毒剂的诱导作用[J].东北农业大学学报,2008,39(7):136-139.
[10]李美,赵德友,孙作文,等.玉米对乙草胺的敏感性研究[J].农药学学报,2001,3(4):44-48.
[11]陶波,何钟佩.谷胱甘肽对除草剂的解毒作用[J].西北植物学报,2000,20(6):1119-1124.
[12]胡廷章.植物的谷胱甘肽转移酶家族[J].重庆三峡学院学报,2004,20(5):121-124.
[13]Edwards R,Dixon D P.In herbicides and their mechanisms of action[M]//Cobb A H,Kirkwood R C.Sheffield:Sheffield Academic Press,2000:33-71.
[14]Tahir H M,Butt A,Khan S Y,et al.Herbicide on the survival and avoidance behaviour of spiders[J].African Journal of Biotechnology,2011,10(33):6265-6268.
[15]Zhang J G,Qi L,Liang W J.Effect of acetochlor and carbofuran on soil nematode communities in a Chinese soybean field[J].African Journal of Agricultural Research,2010,5(20):2787-2794.
[16]童淑媛,杜震宇,徐洪文,等.不同株型玉米叶片净光合速率差异研究[J].东北农业大学学报,2011,42(4):42-47.
[17]金益.玉米杂种优势关系的研究[J].东北农业大学学报,2011,42(4):1-7.
