实时荧光定量PCR法与基因芯片法检测HPV的比较
2013-07-08曾华刘晓强庄豪郑明慧李烈军
曾华刘晓强庄豪郑明慧李烈军
•论 著•
实时荧光定量PCR法与基因芯片法检测HPV的比较
曾华1刘晓强1庄豪1郑明慧1李烈军2★
目的比较基于PCR的基因芯片方法和实时荧光定量PCR方法检测女性子宫颈脱落细胞HPV DNA的相关性。方法收集2050份样本采用基因芯片法和实时荧光定量PCR方法进行比对试验,两者结果不符的进行测序验证,并对检测结果进行一致率及阳性率统计分析。结果两种方法总一致率、阳性一致率及阴性一致率都在95.0%以上;荧光定量PCR法检测HPV16阳性率50.0%,HPV18阳性率13.9%。结论两种方法检测的一致性良好,本实验中所使用的新型12+2高危型人乳头状瘤病毒核酸检测试剂盒适合应用于育龄期妇女的宫颈癌筛查及随访。
基因芯片法;实时荧光PCR;12+2高危HPV;21分型
自1977年,Laverty在电镜中观察到宫颈癌活检组织中人乳头状瘤病毒(human papilloma virus,HPV)颗粒的存在[1],目前,已通过DNA检测技术发现90%以上的宫颈癌病人都存在HPV持续感染。至今发现的HPV约有100多种,根据HPV感染人体后可致宫颈癌的相关性,分为低危型HPV以及高危型HPV。研究表明[2],宫颈癌组织中HPV16和HPV18型感染率最高,故本文对12型高危HPV进行定性检测,同时定量检测HPV16、HPV18型。
1 材料和方法
1.1 研究对象
本研究对象为2011年4月至2011年12月在中山大学孙逸仙纪念医院妇科门诊和体检中心进行妇科检查的2050例女性患者。年龄为36.48±9.38(±s),最小17岁,最大73岁。
1.2 样本采集
1.2.1 标本采集要求
①3天内不使用阴道内药物或对阴道进行冲洗;②24小时内不应有性行为;③检查应在非月经期内进行;④检查前阴道不进行醋酸或碘液涂抹。
1.2.2 标本采集及保存
标本采集:由医生以窥阴器暴露宫颈,用棉拭子将宫颈过多的分泌物擦去。将宫颈刷置于宫颈口,轻轻搓动宫颈刷使其顺时针旋转3~5圈。慢慢取出宫颈刷,将其放入装有细胞保存液的样品管中。在管口处将多余的刷柄折断,将刷头留在样品管中,旋紧管盖,做好标本标识并保持洗脱管直立放置送检验室检测。
标本保存:送检标本如不能马上送检,存放于4℃保存,并于2个星期之内进行检测。
1.3 试剂及仪器
使用试剂及仪器情况见表1。
1.4 检测方法
1.4.1 DNA模板的准备
①取宫颈脱落细胞标本0.5~1 mL(如果细胞数量少可以加大体积到2 mL)。②13000 r/min 离心1 min。③弃上清,加入0.5 mL细胞保存液重悬细胞。④13000 r/min离心1 min,尽量弃干净上清。⑤每样本加入50μL细胞裂解液,充分振荡重悬细胞,煮沸10 min。⑥13000 r/min离心10 min,保留上清备用(上清中为释放的DNA)。
1.4.2 实时荧光PCR检测
用提取的DNA作为模板在ABI7500上扩增,严格按照说明书操作。
1.4.3 基因分型检测
采用HPV分型检测试剂盒(PCR+膜杂交法)检测21种HPV基因型。用提取的DNA作为模板在ABI9600 PCR仪上扩增,之后将PCR产物在HybriMax医用核酸分子快速杂交仪HHM-2I完成杂交分型。
1.4.4 测序
对于荧光定量PCR法和基因芯片法检测结果不一致的样本,将PCR产物及相应测序引物交英潍捷基(上海)贸易有限公司进行DNA序列测定,并以测序法结果作为金标准。
1.5 统计学处理
基于Excel数据库,统计分析用SPSS17.0®处理。
2 结果
2.1 荧光定量PCR法与基因芯片法检测结果
荧光定量PCR法检测可对16、18分型,合并检测31、33、35、39、45、51、52、56、58、59、66、68,实验结果见图1。当荧光定量PCR法检测结果为阳性,若型别与基因芯片法检测的结果不一致,则定义为不相符,共有92例,分析结果见表2。由表2见,荧光定量PCR法检测与基因芯片法检测的总一致率为95.5%(1958/2050);阳性一致率为95.9%(786/820);阴性一致率为95.3%(1172/1230)。
2.2 测序法检测结果
两种方法检测结果不一致共有92例,采用测序的方法进行验证,测序图见图2。一致性分析见表3,以测序结果为金标准,荧光定量PCR法检测结果吻合例数率为45%;基因芯片法检测结果吻合率为55%。

表1 使用试剂及仪器情况Table 1 The reagent and instrument

表2 荧光定量PCR法与基因芯片法检测结果一致性分析Table2 Consistency analysis between real-time fl uorescent PCR and gene-chip
2.3 荧光定量PCR法检测阳性结果型别分类
将荧光定量PCR法检测阳性的798例标本进行型别分析,HPV16阳性有399例,占50.0%;HPV18阳性有111例,占13.9%;其余12型高危阳性有288例,占36.1%。(表4)
3 讨论
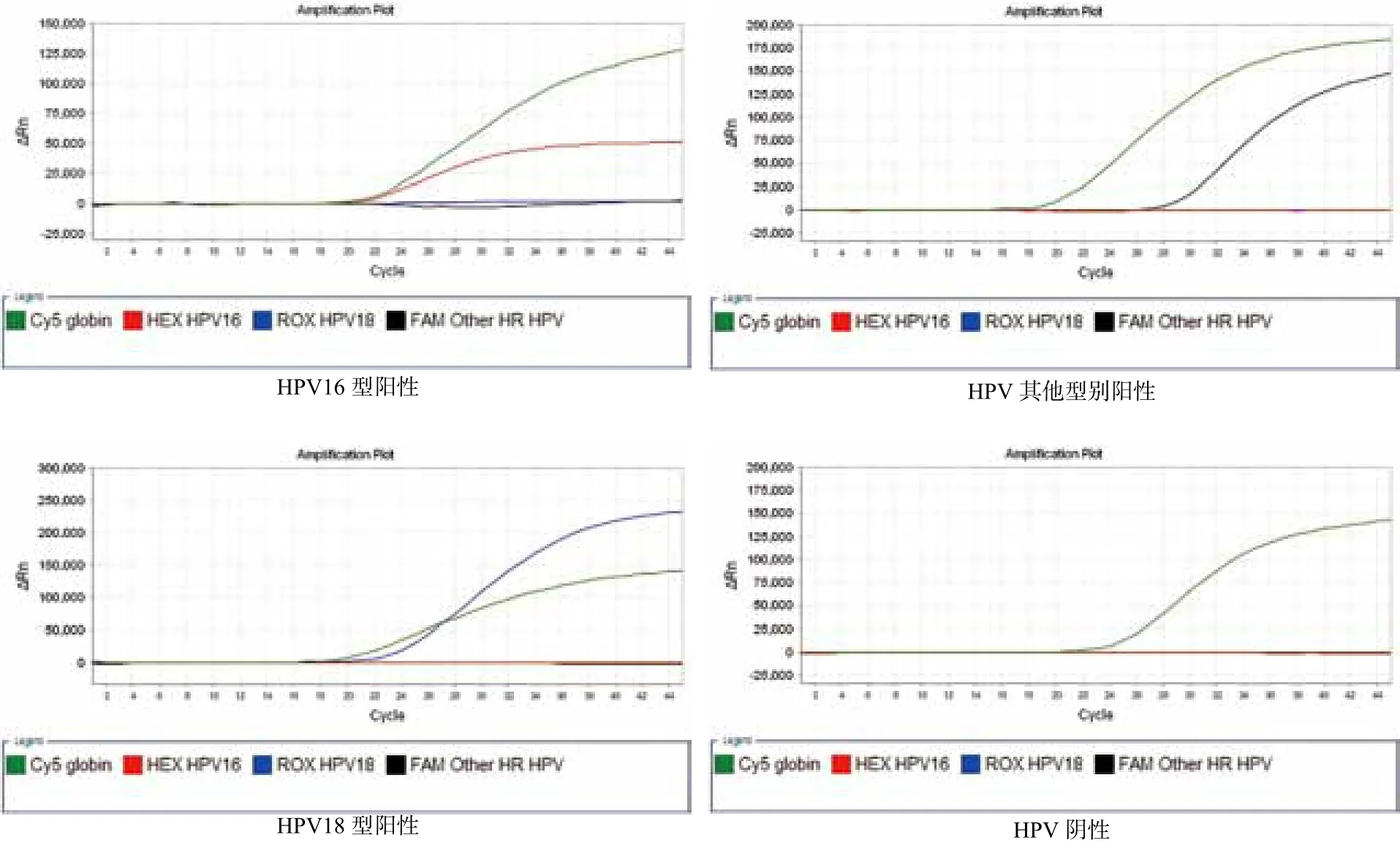
图1 荧光定量PCR检测结果Figure 1 Result of PCR- fl uorescence probing assay
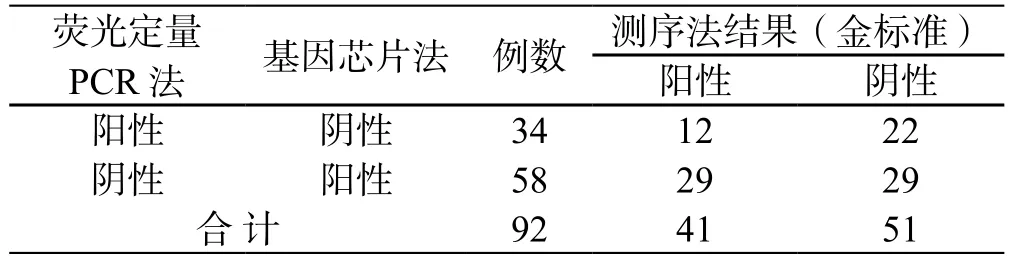
表3 两种检测方法与测序结果的一致性分析Table 3 Consistency analysis between sequencing fi gure and two detection methods
图2 HPV各型别阳性测序图Figure 2 HPV sequencing fi gure

表4 荧光定量PCR法检测阳性检测结果分类Table 4 The classi fi cation of positive results in real-time fl uorescent PCR
早在1977年,Laverty[3]在电镜中观察到宫颈癌活检组织中有HPV颗粒的存在,以及Zur Hausen[4]提出HPV病毒与宫颈癌发病相关联的假设后,国内外学者进行了大量的研究,并在1995年的IARC专题讨论会上达成了HPV感染是宫颈癌的主要原因的观点。根据HPV感染人体后可致宫颈癌的相关性,将其分为低危型HPV以及高危型HPV。低危型HPV可导致生殖器尖锐湿疣,影响生活质量;高危型HPV除可引起外生殖器疣外,更重要的是引起外生殖器癌、宫颈癌及高度宫颈上皮内瘤样病变,其已明确的高危型HPV型别主要有HPVl6、18、31、33、35、39、45、51、52、56、58、59、68型等。宫颈癌患者中,HPV16和HPV18型感染率最高[5]。
高危型HPV导致癌症的机会较高,在99.8%的宫颈癌患者中发现HPV的感染[6],现已知至少有13种高危型HPV与95%的早期浸润和浸润性子宫颈癌有关[7]。世界卫生组织明确提出13种HPV高危型应该单独或联合细胞学应用于宫颈癌筛查[8]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)宫颈癌筛查实践指南及美国阴道镜检查与宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)[9]另外指出,检测高危型HPV时,HPV16和HPV18必须特别重视。他们明确指出即使宫颈细胞学无异常而HPV阳性的30岁以上女性,如其为HPV16、HPV18感染者,应立即进行阴道镜检查。亚洲妇女宫颈癌组织中HPV常见型别最新报道显示[10]:无论是在西亚和东亚地区,HPV16和HPV18都是感染率最高的型别。
由于宫颈病变的严重程度与感染HPV的具体亚型相关,在单一感染型别中,HPV16占居首位并随病变级别增加而阳性率逐步增高。Clifford等[11]发现HPV16在宫颈浸润癌(invasive cervical cancer)患者中的检出率是低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL) 中 的 2倍,HPV18是1.5倍,说明感染HPV16、HPV18更容易进展为宫颈浸润癌。同时研究表明,HPV16的感染由于清除率降低可能更易导致持续性感染,发生CIN2、3(cervical intraepithelial neoplasia II,III),甚至SCC(squamous cell carcinoma)[12]。因此对于HPV感染患者不仅需要重视其是否已经导致宫颈病变,还要重视其感染的具体型别,特别是HPV16、HPV18型感染患者应密切随访。综上所述,HPV分型检测,特别是HPV16、HPV18的分型检测比13种高危型综合笼统归类检测更具临床指导意义。故本文研究的HPV12+2高危型检测试剂盒应用于育龄期妇女的宫颈癌筛查及随访意义重大。
目前临床上常用的宫颈细胞学检查方法主要有两种:巴氏涂片法(即宫颈刮片)和液基薄层细胞学检查法(TCT)[13],由于主观因素的影响,这两种方法的假阴性较高,容易造成漏诊。因此,采用合理、廉价的筛查方法,对提早预防、诊断和治疗宫颈癌有非常重要的意义。
本研究采用的HPV基因分型检测试剂盒(PCR+膜杂交法),现已广泛应用于宫颈疾病的诊治全过程,可降低宫颈病变的漏诊以及避免过度治疗,目前已成为宫颈疾病的随访指标,在临床中发挥着重要作用。但该试剂盒存在成本较高,操作步骤复杂等,临床应用受到一定限制。美国HC2捕获杂交法(13种高危型检测试剂盒)及国内现有的13种高危型HPV核酸扩增荧光检测试剂盒,具有操作简单,自动化程度高的优点,但不能直接对HPV进行分型,特别是无法直接鉴定HPV16和HPV18,在临床应用中存在一定的不足。
而本研究中所使用的12+2高危型人乳头状瘤病毒核酸检测试剂盒,以实时荧光定量PCR核酸检测为技术平台,在同一试管中,既能检测12种高危型HPV,又能同时将HPV16、HPV18分型(表4),且操作简单。因此,通过本研究,比较此新型12+2高危HPV核酸检测试剂盒与市场上已有质量较好的基因分型试剂盒在临床上的使用情况,评价这种新型试剂盒的使用价值,而根据试验结果可推断,此12+2高危HPV检测试剂盒用于临床检验是有效和安全的。
[1] Walboomers J M, Jacobs M V, Manos M M, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. J Pathol, 1999, 189(1): 12-19.
[2] Moscarini M, Lukic A, Franco C. Anti human papillomavirus vaccine: the checkmate to human papillomavirus[J]. Eur J Gynaecol Oncol, 2004, 25(2): 151-156.
[3] Bekkers R L, Massuger L F, Bulten J, et al. Epidemiological and clinical aspects of human papillomavirus detection in the prevention of cervical cancer[J]. Rev Med Virol, 2004, 14(2): 95-105.
[4] 程娇影, 卞美璐, 马莉, 等. 杂交捕获二代与核酸扩增荧光检测宫颈癌前病变及宫颈癌的临床价值[J]. 中国实用妇科与产科杂志, 2010, 26(5): 365-367.
[5] 钟奇志. 第二代捕获杂交法(HC-II)检测HPV-DNA在宫颈癌筛查中应用[J]. 中国妇幼保健, 2008, 23(7): 974-975.
[6] Rowe L R, Aldeen W, Bentz J S. Prevalence and typing of HPV DNA by hybrid capture II in women with ASCUS, ASC-H, LSIL, and AGC on ThinPrep Pap tests[J]. Diagn Cytopathol, 2004, 30(6): 426-432.
[7] 杨玲, 章文华, 李爱玲, 等. 山西子宫颈癌筛查方法比较的可行性研究[J]. 中国肿瘤, 2000, 9(9): 391-392.
[8] Ye J, Cheng X, Chen X, et al. Prevalence and risk profile of cervical human papillomavirus infection in Zhejiang Province, southeast China: a population-based study[J]. Virol J, 2010, 7: 66.
[9] Bouvard V, Baan R, Straif K, et al. A review of human carcinogens-Part B: biological agents[J]. Lancet Oncol, 2009, 10(4): 321-322.
[10] 李霓, 张思维, 陈万青, 等. 亚洲妇女宫颈癌中人乳头状瘤病毒型别分布的Meta分析[J]. 中国肿瘤, 2010, 19(3): 195-202.
[11] Clifford G M, Smith J S, Plummer M, et al. Human Papillomavirus types in invasive cervical cancer worldwide: a meta-analysis[J]. Br J Cancer, 2003, 88(1): 63-73.
[12] 毕蕙, 赵健, 陈锐, 等. 人乳头瘤病毒感染亚型与宫颈上皮内瘤变的相关性[J]. 中国实用妇科与产科杂志, 2010, 26(5): 362-364.
[13] Liu S S, Leung R C, Chan K K, et al. Evaluation of a newly developed GenoArray human papillomavirus (HPV) genotyping assay and comparison with the Roche Linear Array HPV genotyping assay[J]. J Clin Microbiol, 2010, 48(3): 758-764.
Real-time quantitative PCR and Gene-chip in detecting human papilloma virus
ZENG Hua1, LIU Xiaoqiang1, ZHUANG Hao1, ZHENG Minghui1, LI Liejun2★
(1.Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangdong, Guangzhou 510120, China; 2.Chaozhou Hybribio Limited Corporation, Guangdong, Chaozhou 521000, China)
Objective To explore the correlation of HPV DNA test between gene-chip based on PCR technique and real-time fl uorescent PCR in cervical exfoliated cells. Methods 2050 samples were measured by the gene-chip and real-time fl uorescent PCR, which inconsistent results would be veri fi ed by sequencing, and statistical analysis of the consistent rate and positive rate. Results The total concordance rate, the positive concordance rate and the negative concordance rate of the two detection methods were more than 95.0%. The positive rate of HPV16 and HPV18 detected by fl uorescence quantitative PCR method were 50.0% and 13.9%, respectively. Conclusion The consistence of two detection methods was good, and HPV12+2 type detection kit was suitable for application in the childbearing age women at risk of cervical cancer screening and follow-up.
Gene-chip; Real-time fl uorescent PCR; High risk HPV12+2; 21 types
1.中山大学孙逸仙纪念医院检验科,广东,广州 510120 2.潮州凯普生物化学有限公司,广东,潮州 521000
★通讯作者:李烈军,E-mail:ljli@hybribio.cn
