球磨法制备Ni-Mn-Zn三元氢氧化物及电化学性能
2013-07-02李晓峰宋延华董会超夏同驰
李晓峰, 李 正,宋延华,董会超,夏同驰
(郑州轻工业学院材料与化工学院河南省表界面重点实验室,河南 郑州 450002)
镍基二次碱性电池,如镉镍电池和氢镍电池,广泛应用于便携式电器、电动工具和电动车辆。但是,目前这类电池遇到具有更高比容量的锂离子电池的强烈竞争,为了拓展其应用领域,降低其成本显得尤为必要。由于氢氧化镍优异的电化学性能,商业化电池中普遍使用球形的氢氧化镍。然而,制备球形氢氧化镍的化学沉淀工艺相当复杂,例如,在沉淀过程中需要严格控制溶液的pH,沉淀反应后的产物需要陈化相当长的时间等,大大增加了材料的制备成本。
近年来,球磨法被用于制备各种电池材料。该方法是一种粉末处理工艺,可以由粉末混合物直接得到成分均一的产物。例如,Li C等人以LiOH、FePO4和葡萄糖为原料、水为介质,采用球磨法制备出LiFePO4/C复合电极材料[1]。Du H等人以金属Co和碳纳米管(CNT)粉末为原料,直接合成出Co/CNT复合物并应用于二次碱性电池[2]。球磨法同样被用于进一步改进氢氧化镍的性能。研究表明,球形氢氧化镍经过球磨处理能够提高其粉末的表面积,减小颗粒,减少β-Ni(OH)2的结晶度,从而提高材料的电化学活性[3-4]。
另一方面,由于近年来金属镍价格显著上涨,采用其它元素部分取代镍可以有效降低氢氧化镍价格,从而降低电池成本。研究较多的元素包括Al、Fe和Mn等。通常,用这些元素的三价离子部分取代镍后,能够得到电化学可逆性更好的α-Ni(OH)2,当取代量超过0.2后,α-Ni(OH)2能够在强碱性溶液中保持结构稳定[5-8]。
为了降低氢氧化镍成本,本文采用球磨法直接制备出Mn代氢氧化镍[Ni1-xMnx(OH)2]。与化学沉淀法相比,球磨法制备氢氧化镍能够在数小时内完成,并且能够节约大量的水。Zn元素也被引入氢氧化镍晶格中以进一步提高Ni1-xMnx(OH)2电极的放电性能。本文较为详细地研究了这些材料的电化学性能。
1 实验
1.1 球磨法制备氢氧化镍
采用行星式球磨机进行球磨,其中球磨罐体积为50 mL,不锈钢球质量为50 g。球磨过程分两步进行。首先,将化学计量比的 NiSO4·6 H2O、MnSO4·H2O 和 ZnSO4·7 H2O 加入球磨罐内,球料质量比为8∶1,转速为350 r/min,球磨15 min以使MnSO4和ZnSO4均匀分散在NiSO4中。然后将化学计量比的NaOH加入球磨罐内,在同样的转速下继续球磨15 min以发生如下反应:

得到的粉末转移到去离子水中并在70℃下陈化4 h,然后反复水洗以除去SO42-,过滤,在80℃下干燥得到最终材料。采用X射线衍射法(XRD)测试材料的结构。
1.2 模拟电池组装
采用“三明治”的镉镍模拟电池研究球磨氢氧化镍的电化学性能。采用市售的大面积镉电极为对电极,PP/PE混合型隔膜,电解液为7 mol/L的KOH水溶液。以泡沫镍为基体,采用涂膏法制备Ni(OH)2电极,其中正极物质的配方为:2%(质量分数)PTFE粘接剂,5%(质量分数)CoO和93%(质量分数)球磨氢氧化镍。
1.3 电化学性能测试
模拟电池首先以0.1C充电15 h,再以0.2C放电至终止电压1.0 V;然后以0.2C充电7 h并以0.2C放电至1.0 V,如此充放电循环3次以使其容量稳定。接着,电池以0.5C充电2.6 h,再以1C(或3C)放电至1.0 V(或0.9 V)以测试其大电流放电性能。
氢氧化镍电极的循环伏安测试以Pt电极为辅助电极,Hg/HgO电极为参比电极,扫描速率20 mV/min,扫描电位范围0~600 mV(vs.Hg/HgO,下同)。
电极的循环性能测试方法为:模拟电池以1C充电1.2 h,静置10 min,然后以1C放电至1.0 V,充放电循环300次。
2 结果和讨论
2.1 Mn元素取代对球磨氢氧化镍结构和电化学性能的影响
图1是含不同Mn取代量的球磨氢氧化镍的XRD图谱。与无Mn取代的样品相比,四种含Mn取代的样品仍然保持了β-Ni(OH)2的结构,这与文献[6-8]中采用化学沉淀法得到α型的Mn代氢氧化镍有所不同。XRD图谱上20.1°、34.4°和39.9°附近的衍射峰分别表征β-Ni(OH)2的001、100和101晶面。XRD图谱上并没用出现Mn化合物相关的衍射峰,说明Mn取代Ni后进入氢氧化镍晶格。但Mn取代Ni后氢氧化镍的衍射峰右移,且随着取代量的增加衍射峰强度明显下降,表明Mn的取代增加了氢氧化镍的晶格缺陷,导致其结晶度降低。
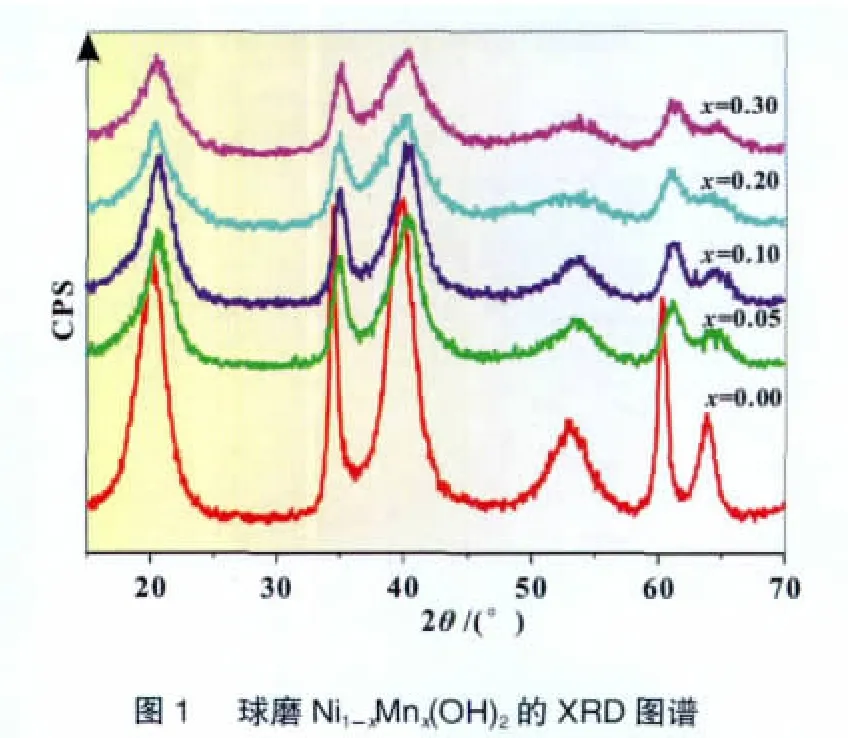

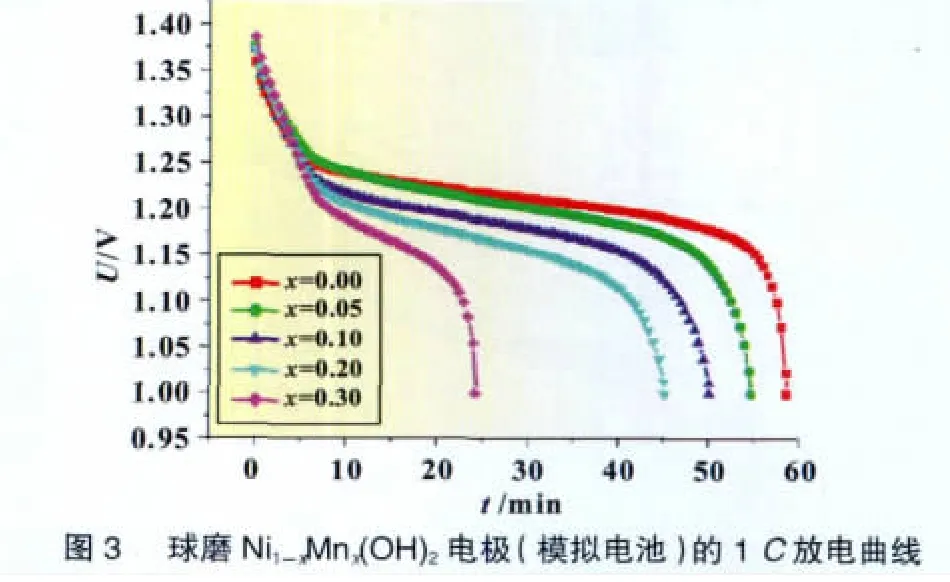
图2和图3为以球磨Mn代氢氧化镍电极为正极的模拟电池的充放电曲线。由图2可见,球磨法制备的无Mn氢氧化镍的0.2C容量达到290 mAh/g,这充分说明球磨法的优越性[3-4]。但随着Mn取代量的增加,模拟电池的放电容量和放电电压逐渐下降,尤其是当放电电流增加至1C后下降尤为明显;同时,电池在充电初期的电压也逐渐下降。另外,当Mn取代量增加至x=0.3时,电池的放电容量急剧下降,说明在氢氧化镍晶格中引入过多的Mn将降低其电化学活性。综合考虑材料的成本和电化学性能,选择总取代量x=0.2进行下一步研究。
2.2 Mn、Zn元素共取代对球磨氢氧化镍结构和电化学性能的影响
在氢氧化镍晶格中引入少量Zn元素有利于提高其电化学活性[9-10];同时,Zn也是一种廉价材料。因此,本文选择将Zn元素引入上述Ni1-xMnx(OH)2以进一步提高其电化学性能。图4是Zn、Mn共取代的球磨氢氧化镍的XRD图谱。由图4可见,其仍然保持了β-Ni(OH)2的结构;同时随着Zn取代量的增加,XRD图谱上氢氧化镍的衍射峰强度进一步降低,同样表明其结晶度的下降。
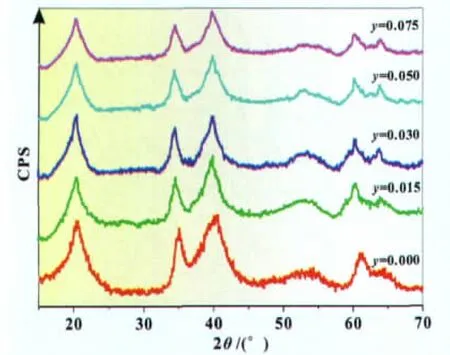
图4 球磨Ni0.8Mn0.2-yZny(OH)2的XRD图谱
图5和图6给出以Zn、Mn共取代的球磨氢氧化镍电极为正极的模拟电池的充放电曲线。由图5可见,模拟电池在充电后期于1.65 V附近出现一个充电平台,这对应着氧气的析出;而当Zn的取代量增加至0.03和0.05时,该充电平台的出现时间明显延迟,表明Zn元素的引入有利于提高氢氧化镍电极的析氧过电位。同时,随着Zn取代量的增加,电池的放电电压逐渐上升。当Zn的取代量为0.03时,电极的放电比容量达到281 mAh/g。由图6可见,当放电电流增加至1C时,Zn元素对电池放电电压的提高更加明显。综合上述实验结果,最佳的Zn取代量确定为0.05。


本文将球磨法制备的Ni0.8Mn0.2-yZny(OH)2与市售的球形氢氧化镍进行电化学性能比较。图7为两种电极的循环伏安曲线。由图7可见,对于球磨Ni0.8Mn0.2-yZny(OH)2电极,在0.4 V附近出现表征Mn(IV)形成的氧化峰P1[11],然后在0.55 V附近出现表征NiOOH形成的氧化峰P2;回扫时,在0.23 V附近出现一个还原峰P3。生成Mn(IV)说明Mn参与了电极的充放电反应,但回扫时没有出现Mn(IV)的还原峰,说明P3对应着Ni-Mn-O复合物的还原。而对于球形氢氧化镍电极,由于Ni(II)的氧化和氧气的生成相互竞争,循环伏安曲线上没有出现氧化峰P2,回扫时则在0.29 V附近出现NiOOH的还原峰P3'。P2峰的消失意味着充电时球形氢氧化镍电极上氧气的析出将早于球磨Ni0.8Mn0.2-yZny(OH)2电极;而Ni-Mn-O复合物的还原电位低于NiOOH的还原电位,则解释了Mn取代Ni后氢氧化镍电极放电电位下降的原因。
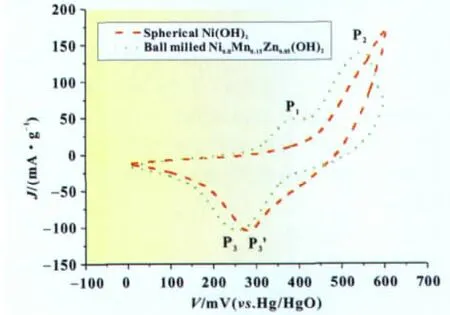
图7 氢氧化镍电极的循环伏安曲线
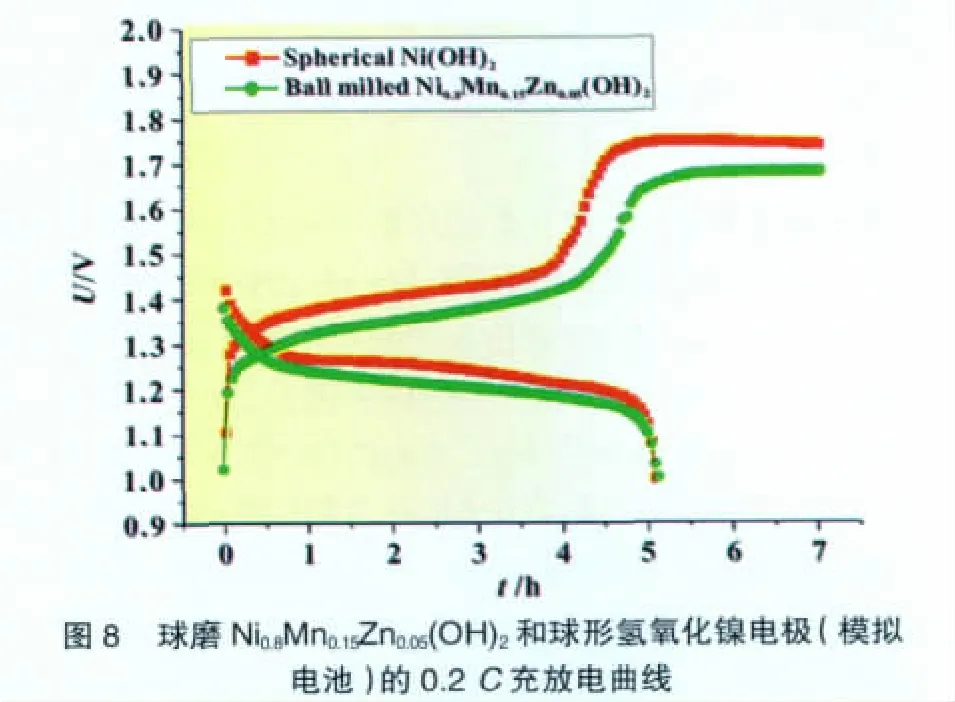
图8和图9给出两种电极的充放电曲线。由图8可见,球磨Ni0.8Mn0.15Zn0.05(OH)2电极的0.2C充放电电压均低于球形氢氧化镍电极,但两者的0.2C容量相当(约265 mAh/g),同时充电后期球磨Ni0.8Mn0.15Zn0.05(OH)2电极上氧气的析出明显推迟。当放电电流增加至3C(图9)时,球磨Ni0.8Mn0.15Zn0.05(OH)2电极表现出更高的放电电压,说明其具有更好的大电流性能。
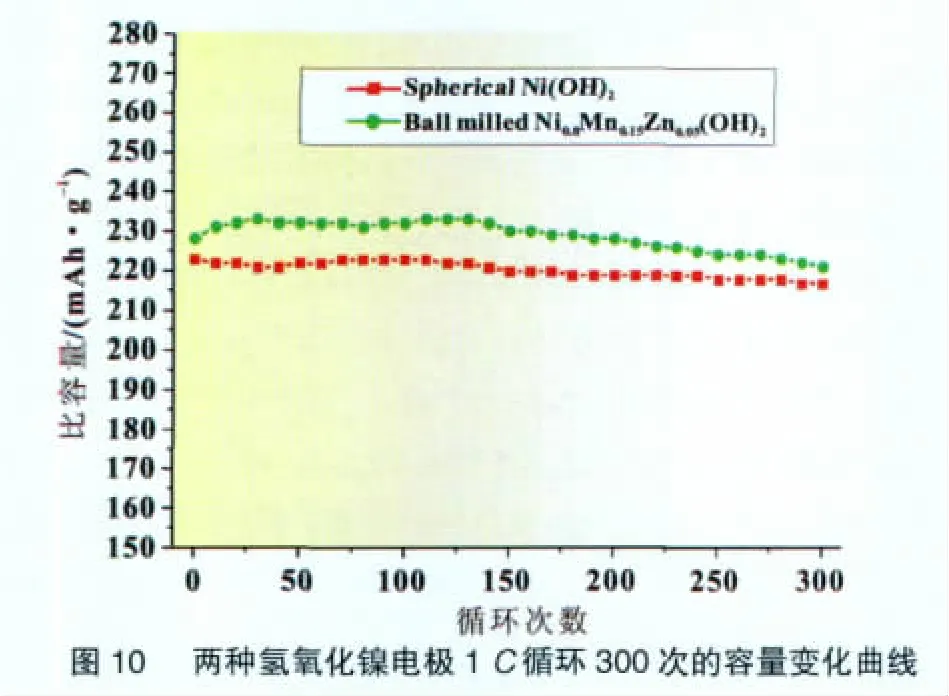
氢氧化镍电极反应可以表示为:
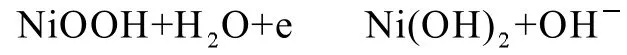
一般认为,该反应的实质是H+在固相中的嵌入和脱嵌。由于Zn和Mn的取代,氢氧化镍晶格中的缺陷增加,提供了更多的H+嵌入/脱嵌通道,从而提高其大电流放电性能。
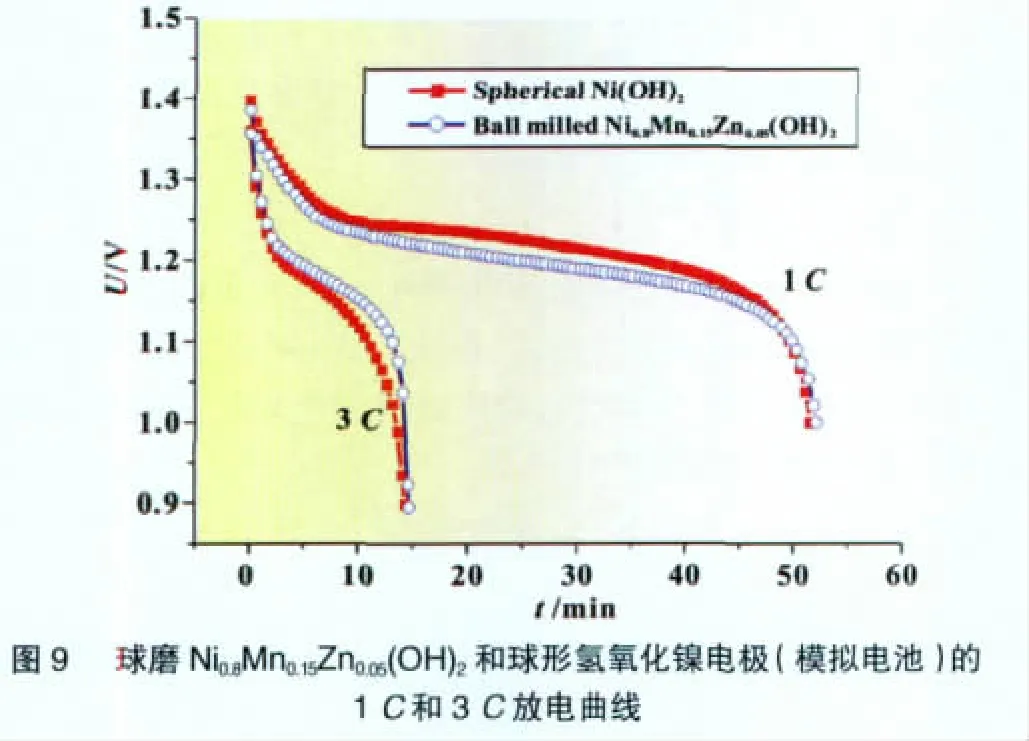
图10给出两种电极的1C循环性能。由图10可见,球磨Ni0.8Mn0.15Zn0.05(OH)2电极表现出与球形氢氧化镍相似的循环性能,经过300次循环后,两者的容量衰减率在3%左右。
3 结论
采用球磨法制备出Mn和Zn取代的氢氧化镍。XRD测试表明,它们均具有β-Ni(OH)2的结构。与不含取代元素的氢氧化镍相比,随着Mn取代量的增加,Ni1-xMnx(OH)2电极的放电容量和放电电位均逐渐下降;而Zn的取代能够提高Ni0.8Mn0.2-yZny(OH)2电极的放电电位。最佳的总取代量为0.2,其中Zn的取代量为0.05。
循环伏安测试表明,与市售的球形氢氧化镍相比,球磨法制备的Ni0.8Mn0.15Zn0.05(OH)2电极表现出Ni-Mn-O复合物的还原峰,且峰电位低于NiOOH的还原峰电位。恒电流充放电测试表明,两种电极的0.2C容量和1C循环性能接近,但Ni0.8-Mn0.15Zn0.05(OH)2电极的大电流性能更佳。
[1]LI C,HUA N,WANG C,et al.Chelation-assisted method for the preparation of cathode material LiFePO4[J].J Solid State Electrochem,2011,15:1971-1976.
[2]DU H,JIAO L,WANG Q,et al.Structure and electrochemical properties of ball-milled Co-carbon nanotube composites as negative electrode material of alkaline rechargeable batteries[J].J Power Sources,2011,196:5751-5755.
[3]SONG Q,CHIU C,CHAN S.Effects of ball milling on the physical and electrochemical characteristics of nickel hydroxide powder[J].J Appl Electrochem,2006,36:97-103.
[4]CHEN H,WANG J,PAN T,et al.Effects of high-energy ball milling(HEBM)on the structure and electrochemical performance of nickel hydroxide[J].Int J Hydrog Energy,2003,28:119-124.
[5]QI J,XU P,LV Z,et al.Effect of crystallinity on the electrochemical performance of nanometer Al-stabilizedα-nickel hydroxide[J].J Alloy Comp,2008,462:164-169.
[6]ZHAO Y,WANG J,CHEN H,et al.Different additives-substituted α-nickel hydroxide prepared by urea decomposition[J].Electrochim Acta,2004,50:91-98.
[7]KOSOVA N,DEVYATKINA E,KAICHEV V.Mixed layered Ni-Mn-Co hydroxides:crystal structure,electronic state of ions and thermal decomposition[J].J Power Sources,2007,174:735-740.
[8]JAYASHREE R,KAMATH P.Layered double hydroxides of Ni with Cr and Mn as candidate electrode materials for alkaline secondary cells[J].J Power Sources,2002,107:120-124.
[9]PROVAZI K,GIZ M J,DALLANTONIA L H,et al.The effect of Cd,Co and Zn as additives on nickel hydroxide opto-electrochemical behavior[J].J Power Sources,2001,102:224-232.
[10]RAMESH T N,VISHNU K P.The effect of crystallinity and structural disorder on the electrochemical performance of substituted nickel hydroxide electrodes[J].J Solid State Electrochem,2009,13:763-771.
[11]LI X,SONG Y,WANG L,et al.Self-discharge mechanism of Ni-MH battery by using acrylic acid grafted polypropylene separator[J].Int J Hydrog Energy,2010,35:3798-3801.
