壳聚糖接枝聚乙烯亚胺的合成与表征
2013-06-28吕滋建李爱香李秋红
吕滋建,李爱香,李秋红,韩 冰,张 伟
(山东理工大学材料科学与工程学院,山东淄博255091)
壳聚糖接枝聚乙烯亚胺的合成与表征
吕滋建,李爱香,李秋红,韩 冰,张 伟
(山东理工大学材料科学与工程学院,山东淄博255091)
用一种简单有效的方法合成了稳定的壳聚糖接枝聚乙烯亚胺接枝共聚物(CHI-g-PEI).首先利用高碘酸盐对壳聚糖进行氧化,合成含醛基的壳聚糖;然后利用PEI上的氨基与醛基的席夫碱反应进行接枝;最后用硼氢化钠(NaBH4)还原亚胺,得到稳定的接枝共聚物CHI-g-PEI.研究了反应时间和反应温度对氧化壳聚糖产率的影响,以及PEI用量对接枝率的影响.产物和中间体用红外光谱(IR)、核磁谱图(1H-NMR)和紫外可见光谱(UV-Vis)等进行了表征.
壳聚糖;聚乙烯亚胺;接枝聚合物;基因载体
基因治疗是将人的正常基因或有治疗作用的基因通过一定方式导入人体靶细胞以纠正基因的缺陷或者发挥治疗作用,从而发挥治疗疾病目的的生物医学技术.基因治疗的关键之一在于开发安全、高效的基因递送体系(基因载体).目前常用的基因载体主要有病毒载体和非病毒载体两大类.常见的病毒载体包括逆转录病毒、腺病毒、腺伴随病毒和疱疹病毒等.病毒载体对大多数靶细胞具有高效的转染率,但是价格比较昂贵,容易引起机体强烈的免疫反应并可能致癌,安全性不高.而非病毒载体具有低细胞毒性和低免疫反应、安全性高等特点,可以克服病毒载体的致命缺陷,已经引起研究者的广泛关注.近年研究较多的是阳离子脂质体和阳离子聚合物两大类,由于永久正电荷的存在,它们可以通过静电相互作用与带有负电荷的DNA形成复合物.但是阳离子脂质体经过静脉注射后,会与血清蛋白结合,被单核巨噬细胞吞噬,导致靶向性差且转染率较病毒载体低;并且作为基因载体,它的毒性较大,产量也不高.因此,安全、高效的阳离子聚合物在基因治疗方面显示了巨大的潜力.目前应用于基因载体的阳离子聚合物常见的有聚乙烯亚胺(PEI)、聚-L-赖氨酸(PLL)、明胶和壳聚糖等.PEI是阳离子聚合物的典型代表,它具有高正电荷密度,并在较宽p H范围内具有很强的缓冲能力,通过静电作用结合DNA分子,是目前公认转染率较高、应用最为广泛的阳离子类基因载体[1].但它也对细胞产生较大的毒性,PEI的体内毒性和PEI/DNA复合物粒子易聚集的特性都限制了它的临床应用.壳聚糖是安全无毒、生物相容性好的多聚阳离子,且免疫原性低、生物黏附性好,并具有独特的跨细胞膜运输能力,是一种有效的基因传递载体,从分子量只有几千的寡聚壳聚糖到分子量几十万的高分子量壳聚糖,都已被证明具有基因转染作用[2-4].但其相对较低的转染效率和生理p H环境下的难溶性仍是其应用中的主要障碍[5].因而,近年来,研究者们将目光转向了壳聚糖的各种改性衍生物[6-13].
本文研究用一种相对简单有效的方法合成稳定的壳聚糖接枝聚乙烯亚胺接枝共聚物(CHI-g-PEI),并对反应过程和产物进行详细表征.
1 实验部分
1.1 实验原料
壳聚糖(CHI,分子量20 000Da,脱乙酰度90%)从济南海得贝海洋生物工程有限公司购买;支化聚乙烯亚胺(PEI,分子量1 800Da)从Sigma-Aldrich公司购买.高碘酸钾,硼氢化钠,冰醋酸,醋酸钠从上海试剂一厂购买.
1.2 CHI-g-PEI的合成
CHI-g-PEI分三步合成.首先用高碘酸钾氧化壳聚糖.将壳聚糖(2 mmol/L)和高碘酸钾(78 mmol/L)分别溶解在p H=4.5的醋酸/醋酸钠缓冲溶液中,分别用N2鼓泡脱气,并冷至4℃,将两溶液混合反应12h,加入乙二醇终止(10%V/V)反应.溶液用截留分子量为3 500的透析袋在0.2mol/L p H=4.5的NaCl溶液中透析3d,然后再在p H= 4.5的缓冲溶液中透析3d,取50m L溶液再用去离子水透析3d,冻干测试,其余溶液用于下一步的接枝反应.
然后,用PEI和氧化壳聚糖的溶液在p H=4.5的缓冲溶液中4℃反应48h,取50m L反应液在去离子水中透析3d冻干测试,其余的溶液用于下一步的反应.
最后,反应液用硼氢化钠还原(2g硼氢化钠/1g壳聚糖),4℃反应48h,在去离子水中透析3d,冻干.
1.3 产物及其中间体的表征
共聚物CHI-g-PEI及其中间体的组成采用核磁(1H-NMR)和红外光谱(IR)测定.1H-NMR采用采用D2O为溶剂,用Bruker AV300核磁光谱仪上测定;FT-IR分析采用KBr压片法,20SX分光光度计测定.氧化壳聚糖的氧化产率在上海精密科学仪器有限公司生产的723型紫外分光光度计上进行测定.
2 结果与讨论
CHI-g-PEI的合成路线如图1所示.首先用高碘酸钾氧化壳聚糖,得到含醛基的壳聚糖;然后使PEI与壳聚糖的上的醛基发生席夫碱反应,得到接枝共聚物;最后用NaBH4还原亚胺得到稳定的CHI-g-PEI.

图1 CHI-g-PEI的合成路线
2.1 壳聚糖的氧化反应
我们选择用高碘酸钾对壳聚糖进行氧化.氧化产率可以在将反应液透析、冻干得到固体之后通过核磁氢谱测定,此方法比较准确,但不方便;为了更方便快捷的测定氧化产率,我们利用紫外可见分光光度计法测定.首先选择波长为245nm做p H=4.5时高碘酸钾的工作曲线,如图2所示.然后,反应过程中取样用紫外可见测试剩余高碘酸钾的浓度,根据消耗的高碘酸钾的量计算氧化产率.得到反应时间与氧化产率的关系如图3所示.
从图3中可看出,随着反应时间的增加,壳聚糖的氧化产率随之增加.反应开始时,由于高碘酸钾的初始浓度较高,氧化产率增加很快,反应1h氧化产率就达到47.1%;随着反应的进行,高碘酸钾的浓度逐渐降低,反应速率减慢,当反应5h时,氧化产率为53%,反应6h时,氧化产率为53.1%,增加很小.因此,我们选择6h时结束反应.

图2 高碘酸钾工作曲线图
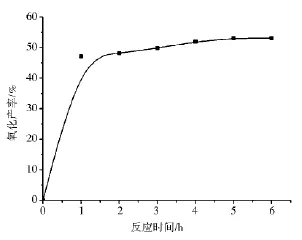
图3 反应时间与氧化产率关系图
考虑到反应温度可能对最终壳聚糖氧化产率有影响,我们采用不同的温度做了对比实验,得到产物的氧化产率,结果见表1.由表1可见,不同温度下壳聚糖的最终氧化产率相差不大,说明反应温度对氧化产率的影响不大.

表1 反应温度对壳聚糖氧化产率的影响
图4为壳聚糖的核磁谱图.化学位移δ=3.0处对应于壳聚糖上与氨基相连的碳上的质子峰,δ= 3.3~4.1处对应于壳聚糖糖环上的5个氢的质子峰,δ=3.3~4.1和δ=3.0处的质子峰的峰面积之比为4.7.与图5氧化壳聚糖的1H-NMR相比,化学位移δ=3.0处质子峰峰面积大大减小,说明壳聚糖被氧化.比较化学位移δ=3.0和δ=3.3~4.1处质子峰的峰面积,可以计算出氧化产率YH%,计算公式如下:

其中,YH%为氧化产率,I1为δ=3.0处的质子峰的峰面积,I2为δ=3.3~4.1处的质子峰的峰面积.由上式计算出,壳聚糖的氧化产率为50.5%.与紫外光谱法所得结果53.1%接近,因而,我们可以用紫外光谱法监测反应过程.

图4 壳聚糖(CHI)的1H-NMR谱图

图5 氧化壳聚糖的1H-NMR谱图
2.2 壳聚糖的接枝聚合和还原反应
高碘酸钾氧化得到的氧化壳聚糖上醛基与PEI上的端胺基进行席夫碱反应,得接枝聚合物CHI-g-PEI,然后用硼氢化钠还原亚胺,得最终产物.图6为硼氢化钠还原后CHI-g-PEI的1H-NMR谱图.化学位移δ=2.3~2.9处对应于PEI上的质子峰(4个H),δ=3.3~4.1对应于壳聚糖环上的质子峰.说明成功进行了接枝反应.并且,比较这两处质子峰的峰面积,可计算出接枝率.具体公式如下:

其中:1 800和20 000分别是PEI和CHI的分子量,43和161分别是PEI和CHI结构单元的分子量,I1/I2是化学位移δ=2.3~2.9的峰面积与δ= 3.3~4.1的峰面积的比值,n为接枝率.由数据求得PEI的接枝率为7.9%.
壳聚糖在水中溶解度很小,接枝反应完成后,壳聚糖接枝物在水中可完全溶解,也说明接枝反应是成功的.
图7是CHI和还原后接枝产物CHI-g-PEI的IR谱图.CHI-g-PEI在1 100cm―1波数处的吸收峰比壳聚糖的弱,且CHI-g-PEI在1460cm―1波数处比壳聚糖有一个更强的吸收峰,这些现象也说明成功合成了CHI-g-PEI接枝共聚物.

图6 CHI-g-PEI的1H-NMR谱图

图7 CHI和CHI-g-PEI的IR谱图
为了探究PEI的加入量对接枝率的影响,固定壳聚糖的量不变,氧化产率不变,取不同质量的PEI做对比实验,结果表明,PEI的用量不同,所得接枝率也不同.当PEI的质量为0.9g时,接枝率为7.9%;而将PEI的质量提高至1.4g,接枝率增加至19.6%.PEI的用量越大,所得接枝率越高.这是因为,PEI加入量越多,所含端氨基的数目也就越多,与氧化壳聚糖上的醛基反应的几率也就越大,因而接枝率越高.因此,我们可以通过控制PEI的加入量来得到各种不同接枝率的接枝共聚物.
3 结束语
通过高碘酸钾对壳聚糖进行氧化的含醛基的壳聚糖,然后利用PEI上的氨基与醛基的席夫碱反应进行接枝,最后还原得到壳聚糖接枝聚乙烯亚胺共聚物.研究结果表明,氧化反应在6h结束,可用紫外可见光谱监测反应过程.反应温度对壳聚糖的氧化反应产率影响不大.红外光谱和产物的水溶性说明接枝反应成功进行,且接枝率随PEI的用量而增加.
[1]张璇,潘仕荣.非病毒基因载体聚乙二醇-聚乙烯亚胺共聚物缓冲容量的研究[J].中南药学,2009,7(4):259-262.
[2]Liu W G,Yao K D.Chitosan and its derivatives-a promising non-viral vector for gene transfection[J].J Controlled Release, 2002,83(1):1-11.
[3]Chae S Y,Son S,Lee M,et al.Deoxycholic acid-conjugated chitosan oligosaccharide nanoparticles for efficient gene carrier[J]. J Controlled Release,2005,109(1-3):330-344.
[4]Kim D G,Jeong Y I,Nah J W.All-trans retinoic acid release from polyion-complex micelles of methoxy poly(ethylene glycol) grafted chitosan[J].J Appl Polym Sci,2007,105(6):3246-3254.
[5]Hirano S,Yamaguchi Y,Kamiya M.Novel N-saturated-fatty-acyl derivatives of chitosan soluble in water and in aqueous acid and alkaline solutions[J].Carbohydr Polym,2002,48(2):203-207.
[6]张未,潘仕荣,张璇,等.聚乙二醇-壳聚糖共聚物作为基因传递载体的体外研究[J].药学学报,2008,43(8):848-854.
[7]Jiang X,Dai H,Leong K W,et al.Chitosan-g-PEG/DNA complexes deliver gene to the rat liver via intrabiliary and intraportal infusions[J].J.Gene.Med.,2006,8(4):477-487.
[8]Wong K,Sun G B,Zhang X Q,et al.PEI-g-chitosan,a novel gene delivery system with transfection efficiency comparable to polyethylenimine in vitro and after liver administration in vivo[J].Bioconjugate Chem.,2006,17:152-158.
[9]Jiang H L,Kim You K Y,Rohidas A,et al.Chitosangraftpolyethylenimine as a gene carrier[J].Journal of Controlled Release,2007,117:273-280.
[10]Lun L Y,Shiang P Y,Hung C B,et al.Poly(ethyleneimine)-g-chitosan using EX-810 as a spacer for nonviral gene delivery vectors[J].J.Biomed.Mater.Res.A,2009,88(4):1058-1068.
[11]Li M C,Su S,Xin M H,et al.Relationship between N,N-dialkyl chitosan monolayer and corresponding vesicle[J].J Colloid and Interface Science,2007,311:285-288.
[12]金旭,朱敦皖,张超,等.十二烷基化壳聚糖基因支架血管内基因转运的实验研究[J].生物医学工程与临床,2006,10(6):342-345.
[13]Wang X,Yao J,Zhou J P,et al.Synthesis and evaluation of chitosan-graft-polyethylenimine as a gene vector[J].Pharmazie, 2010,65:572-579.
(编辑:姚佳良)
Synthesis and characterization of chitosan graft polyethyleneimine
LYU Zi-jian,LI Ai-xiang,LI Qiu-hong,HAN Bing,ZHANG Wei
(School of Materials Science and Engineering,Shangdong University of Technology,Zibo 255091,China)
Chitosan graft polyetheneimine copolymers(CHI-g-PEI)were synthesized by a facile method.Firstly,CHI containing formyl group was prepared through oxidation reaction of CHI by periodate potassium.Then graft reaction was carried out between amino of PEI and formyl groups of CHI,and stable graft copolymer of CHI-g-PEI was obtained by reduction reaction by sodium borohydride(NaBH4).The effects of reaction time and temperature on the yield of oxidation CHI and the effect of PEI amount on grafting yield were studied.The product and its precursors were characterized by IR,1H-NMR,and UV-Vis.
chitosan;polyethyleneimine;graft copolymer;gene therapy
1672―6197(2013)01―0001―04
O631
A
2013- 01- 01
山东省优秀中青年科学家科研奖励基金资助项目(2010BSB01009);山东省自然科学基金资助项目(ZR2012BQ008);山东理工大学青年教师发展支持计划.
吕滋建,男,alv@sdut.edu.cn;通信作者:李爱香,女,axl@sdut.edu.cn
