联吡啶[3,2-a:2ʹ,3-c]-7-氮杂-吩嗪铜(I)配合物的合成、表征及其与DNA的相互作用
2013-06-23高云燕欧植泽王雪松
高云燕 曹 璐 欧植泽 陈 晨 李 嫕 王雪松
(1西北工业大学理学院,空间应用物理与化学教育部重点实验室,西安710072;2中国科学院理化技术研究所,光化学转换与功能材料重点实验室,北京100190)
1 引言
顺铂类化合物是目前最有效的抗癌药物之一.顺铂能与DNA发生共价相互作用,从而阻止DNA的转录和复制,最终导致细胞死亡或凋亡.1,2然而,顺铂的毒副作用大,易于引起中毒性肾损害、呕吐、神经毒性等临床反应,且长期使用会产生严重的抗药性.3铜作为体内不可缺少的微量元素,参与多种生物化学反应.4铜配合物表现出较高的抗癌活性和较低的毒副作用,且具有潜在的肿瘤靶向作用,因而被认为是铂类抗癌药物的替代药品之一.5−7
Cu配位化合物在紫外或可见光照射条件下产生的活性氧可氧化DNA的碱基,特别是鸟嘌呤(G);或与DNA的糖基发生抽氢反应,表现出较强的DNA光损伤能力.8,9能够光损伤DNA的化合物有望在生物技术、过渡金属药物领域或光动力治疗领域获得应用.10目前大多数Cu配合物为二价铜配合物,一价铜配合物的光动力作用研究的相对较少.11−13邻菲罗啉铜(I)对DNA具有识别作用,主要对TAT序列位点具有较高的亲和性,并能够通过羟基自由基等活性氧在结合位点附近对DNA进行损伤.14铜(I)配合物与DNA作用的结合常数通常较小(<105mmol·L−1),15,16且对DNA的损伤效率较低,有时需要较高浓度的配合物或外加还原剂,这限制了Cu(I)配合物的进一步应用.17,18近年来,通过引入多个金属中心、合成不同结构的邻菲罗啉配体,调节邻菲罗啉铜配合物的氧化还原电位及其与DNA的结合方式,可以有效地促进邻菲罗啉铜配合物对DNA的氧化断裂.19联吡啶[3,2-a:2ʹ,3ʹ-c]-氮杂-吩嗪(dpapz)是一种具有较大共轭芳香环的邻菲罗啉衍生物配体,其钌配合物与DNA具有较强的相互作用.20−22但是dpapz及其相关配合物的光物理性质、光损伤DNA的机理尚未得到详细研究.本文通过改进dpapz的合成方法,提高了产率,进一步制备得到[Cu(dpapz)2]PF6配合物,采用多种光谱方法研究了配合物与DNA的作用方式,并对其光损伤DNA的机制进行了探讨.
2 实验部分
2.1 试剂和仪器
小牛胸腺DNA(CT DNA)、溴乙锭(EB)、[Cu(CH3CN)4]PF6均为分析纯试剂(纯度大于99%),购自美国Aldrich公司.硝基四氮唑蓝(NBT)、对苯醌(PBQ)、9,10-二苯基蒽(DPA)、1,4-二氮杂二环[2.2.2]辛烷(DABCO)、3,4-二氨基吡啶均为分析纯试剂(纯度大于99%),购自美国Acros公司.1,10-邻菲罗啉-5,6-二酮参照文献23合成.其余试剂均为分析纯,购自北京化工厂.所有溶剂经无水处理,使用前重蒸.所用缓冲溶液均为Tris-HCl溶液(10 mmol·L−1,pH 7.0),采用二次蒸馏水配制.CT DNA溶液按照文献24的方法配制,并利用260 nm处的吸光度确定CT DNA的浓度(摩尔消光系数为6600 mol·L−1·cm−1).
所用仪器:Hitachi U-3100紫外-可见吸收光谱仪,日本;Hitachi F-4600荧光分光光度计,日本;Bio-Rad Universal Hood II凝胶成像系统,美国;Bruker Avance 400核磁共振波谱仪,德国;Waters GCT Premier高分辨质谱仪(HR ESI-MS),美国;北京六一DYCP-44N凝胶电泳仪,上海华辰CHI 660D电化学分析仪.
2.2 配合物的合成与表征
2.2.1 配体dpapz的合成
将 1,10-邻菲罗啉-5,6-二酮(0.5 g,2.5 mmol)和3,4-二氨基吡啶(0.5 g,4.5 mmol)溶于50 mL重蒸无水乙醇中,80°C回流6 h,得黄色溶液,冰水浴冷却1 h后有固体析出,抽滤,用冷的无水乙醇洗涤,干燥,得浅黄色固体0.55 g,产率为75%.1H NMR(CDCl3,400 MHz)δ:9.778(s,1H);9.547(m,2H);9.274(m,2H);8.945(d,1H);8.106(d,1H);7.766(m,2H).IR(KBr),ν/cm−1:3060 w,1577 s,1529 m,1473 m,1433 m,1388 m,1342 m,1247 w,1220 w,1124 m,1070 m,1026 m,977 m,893 m,821 s,739 s,628 m,580 m.
2.2.2 配合物[Cu(dpapz)2]PF6(2)的合成
将dpapz(76 mg,0.2682 mmol)溶于5 mL重蒸氯仿,通入氮气除氧30 min后,缓慢加入5 mL[Cu(CH3CN)4]PF6(50 mg,0.1341 mmol)的甲醇溶液,50°C下反应6 h,有棕黑色沉淀产生.沉淀用二次蒸馏水、丙酮和无水乙醚洗涤数次后真空干燥,得棕黑色固体60 mg,产率为71%.1H NMR(DMSO-d6)δ:9.860(br s,6 H),9.083(bs s,6 H),8.311(br s,3 H).HR ESI-MS(MeCN):629.0985,[C34H18CuN10],m/z=629.1011([M-PF6]+).元素分析:实验值(计算值)(%),C 64.72(64.81),H 2.94(2.88);N 22.34(22.23).IR(KBr),ν/cm−1:3084 w,1588 m,1487 m,1446 m,1380 s,1346 m,1299 m,1139 m,1080 m,831 m,729 m,640 m,582 m.
2.3 紫外-可见滴定实验
配制 dpapz(10 μmol·L−1)及[Cu(dpapz)2]PF6(5 μmol·L−1)的缓冲溶液,逐渐滴加DNA(初始浓度为1.5 mmol·L−1)溶液,室温静置15 min.采用1 cm石英比色皿,以相应浓度DNA的缓冲溶液为参比,测定230−750 nm范围内的紫外-可见光谱.
2.4 溴乙锭(EB)荧光竞争实验
用缓冲溶液配制试样,固定CT DNA浓度为10 μmol·L−1,EB 浓度为5 μmol·L−1,将反应液混合均匀,室温静置2 h后,逐渐增大dpapz及其Cu(I)配合物的浓度,静置15 min进行荧光光谱测试,激发波长为510 nm,扫描范围为530−750 nm.
2.5 DNA熔解曲线的测定
用缓冲溶液配制试样,固定CT DNA浓度为50 μmol·L−1,dpapz浓度为20 μmol·L−1,或[Cu(dpapz)2]PF6浓度为 10 μmol·L−1,将反应液混合均匀,室温静置2 h后,由24°C逐渐加热到96°C,升温速率控制为1°C·min−1.将双链CT DNA在260 nm处的吸收变化值分别进行归一化后对温度作图,中间拐点处的温度即为DNA的熔解温度.
2.6 循环伏安实验
工作电极使用玻碳电极,对电极使用铂电极,参比电极使用饱和甘汞电极(SCE),实验前待测溶液通氮气除氧气20 min,实验过程中始终保持氮气气氛.配制30 μmol·L−1dpapz及[Cu(dpapz)2]PF6的缓冲溶液,支持电解质为50 mmol·L−1NaCl,测定加入CT DNA前后化合物的峰电位和峰电流的变化,扫描速率为0.1 V·s−1,测定−1.2−0.5 V范围的循环伏安曲线.
2.7 超氧负离子自由基()测试
配体dpapz和[Cu(dpapz)2]PF6的超氧负离子自由基产生能力通过硝基四氮唑蓝(NBT)与O2−·的反应测定.25光源为300 W高压汞灯(λ>300 nm).光照dpapz及其配合物(10 μmol·L−1)与NBT(50 μmol·L−1)的DMSO混合溶液,每隔3 min取样,利用600 nm处的吸收变化值对光照时间作图得到的曲线可比较不同光敏剂产生超氧负离子自由基的能力.
2.8 单重态氧(1O2)的测定
配体dpapz及[Cu(dpapz)2]PF6的1O2量子产率采用9,10二苯基蒽(DPA)光氧化法测定.26固定DPA的浓度为8×10−5mol·L−1,采用300 W高压汞灯(λ>300 nm)样品,每隔10 min取样,测定其紫外可见吸收光谱.利用DPA在374 nm处吸收值降低程度与光照时间的关系作图,可比较不同光敏剂产生单重态氧的相对量子效率.
2.9 DNA光损伤实验
取30µL pBR322 DNA溶液(0.5µg·mL−1,pH 7.0)与dpapz或[Cu(dpapz)2]PF6溶液混合,室温暗处静置20 min后,采用高压汞灯光照20 min(λ>300 nm).利用0.9%的琼脂糖凝胶电泳对DNA进行分离,溴乙锭染色后,采用Bio-Rad Universal Hood II凝胶成像系统测定DNA相应组分的荧光强度.获得超螺旋结构DNA(Form I,supercoiled)、带切口的DNA(Form II,nicked)和线性DNA(Form III,linear)的相对百分含量.
3 结果与讨论
3.1 化合物合成
通过提高反应物3,4-二氨基吡啶和1,10-邻菲罗啉-5,6-二酮的投料比,改变反应溶剂和延长反应时间,配体联吡啶[3,2-a:2ʹ,3ʹ-c]-7-氮杂-吩嗪(dpapz)的收率由文献21报道的42%提高到75%.配体dpapz与[Cu(CH3CN)4]PF6在CHCl3和甲醇的混合溶剂中回流可得到配合物[Cu(dpapz)2]PF6(图1).配体dpapz的结构不具有对称性,邻菲罗啉环上氢原子的1H NMR谱图表现出多重峰(图2(a)).与Cu(I)配位后,dpapz的邻菲罗啉环上2位氢原子的1H NMR峰位明显向低场移动,表明Cu(I)主要与配体的邻菲罗啉部分配位,而不是与吡啶环部分配位(图2(b)).[Cu(dpapz)2]PF6的1H NMR峰均为宽峰(图2(b)),可能是Cu(I)配合物在溶液中形成了无定形聚集态引起的.27红外光谱显示,dpapz在3060 cm−1处的C―Harom伸缩振动峰在配位后向高波数方向移至3084 cm−1.同时,dpapz在1400−1600 cm−1范围内的邻菲罗啉部分的特征峰在配位后均发生了明显的位移,进一步表明邻菲罗啉基团参与了配位.28
高分辨质谱图中,629.0985处的峰可归属于[Cu(dpapz)2]+的分子离子峰(理论值为m/z=629.1012),387.0408处的峰可归属于[Cu(dpapz)(CH3CN)]+的分子离子峰(理论值为m/z=387.0419)(图3).同时还可观测到dpapz配体在284.0919处的分子离子峰(理论值为m/z=284.0858).尽管质谱图中能观测到[Cu(dpapz)(CH3CN)]+的分子离子峰,但在配合物的红外图谱中未能观测到CH3CN的特征红外吸收,因此[Cu(dpapz)(CH3CN)]+的分子离子峰可能是质谱检测过程中产生的.如果配体dpapz与Cu2+配位,应该可以检测到[Cu(II)(dpapz)2]2+的分子离子峰(m/z=314.5506),或的分子离子峰(m/z=774.0659).但是在高分辨质谱图中没有检测到这些Cu2+配合物的质谱峰(图3).说明dpapz主要与铜(I)配位形成配合物,且配合物[Cu(dpapz)2]PF6具有良好的稳定性.实验过程中,溶剂经过严格处理,采用Cu(NO3)2等二价铜化合物与dpapz配位时,最终产物也只有Cu(I)配合物.一价铜离子的电子构型为d10,倾向于形成四面体空间结构;而二价铜离子的电子构型为d9,主要形成具有更好平面结构的配合物.由于邻菲罗啉类配体具有较大的空间位阻,使得具有平面结构的二价铜配合物相对不稳定,在还原剂存在条件下,邻菲罗啉衍生物的铜(II)配合物易于被还原形成铜(I)配合物.29,30文献报道,Cu2+能被溶剂中存在的微量还原剂或溶剂本身还原,反应生成Cu(I)配合物,具体机理还有待于进一步研究.31,32

图1 配体dpapz和配合物[Cu(dpapz)2]PF6的合成路线Fig.1 Synthetic routes for the ligand dpapz and the complex[Cu(dpapz)2]PF6
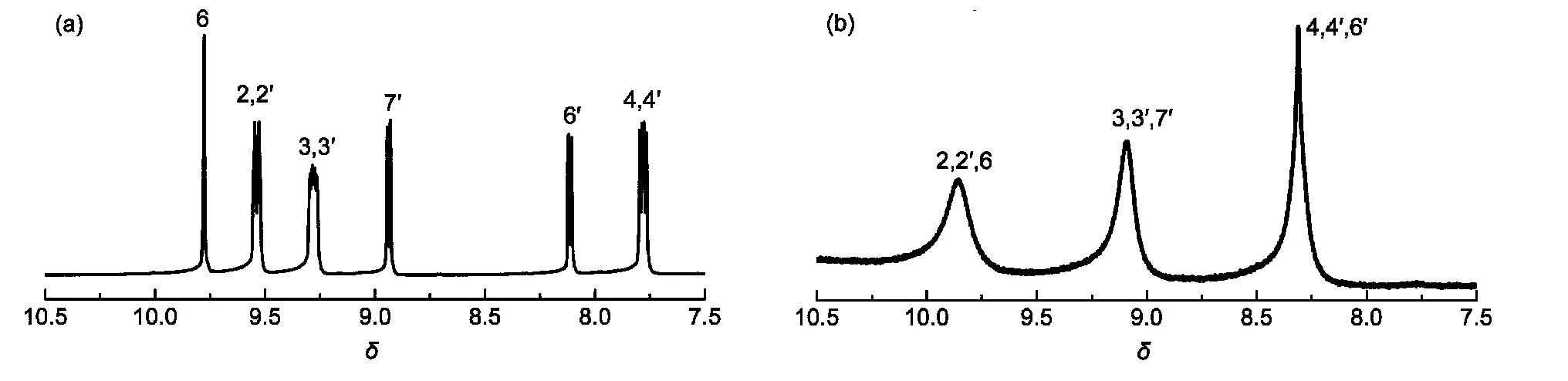
图2 (a)配体dpapz和(b)配合物[Cu(dpapz)2]PF6的1H NMR图Fig.2 1H NMR spectra of ligands(a)dpapz and(b)[Cu(dpapz)2]PF6

图3 [Cu(dpapz)2]PF6在乙腈溶剂中的HR ESI质谱图Fig.3 High resolution electrospray ionization mass spectrum(HR ESI-MS)of complex[Cu(dpapz)2]PF6in acetonirile
3.2 紫外吸收光谱
配体dpapz在261、290、301和359 nm处有四个吸收峰,其中261、290和301 nm处的峰可归属于配体的π→π*跃迁,而359 nm处的吸收为配体的n→π*跃迁(图4(a)).33随着CT DNA的加入,dpapz的各吸收峰的强度逐渐下降.当CT DNA与dpapz的浓度比为2.5时,261和290 nm处吸收峰的减色效应分别为27.9%和23.4%,表明CT DNA与dpapz具有较强的相互作用.配体dpapz与CT DNA的结合常数可以通过公式(1)求得:
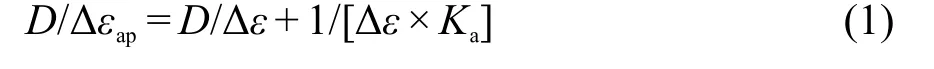
式中,D为 DNA的浓度,Δεap=|εa−εf|,Δε=|εb−εf|,εa为化合物的表观消光系数(εa=Aobs/[化合物]),即用加入不同浓度DNA后化合物的吸光度值Aobs除以化合物浓度得到.εf为未加入DNA时,化合物的消光系数.εb为所有的化合物与DNA结合后的消光系数.Ka为化合物与DNA的结合常数.以D/Δεap对D作图,线性拟合后得到的斜率与相应截距的比值为结合常数.利用dpapz在261 nm处的吸收峰强度的变化进行线性拟合,求得dpapz与DNA的结合常数为2.88×105mol·L−1.
配合物[Cu(dpapz)2]PF6在267和361 nm处有两个主要吸收峰,在289和301 nm处可观测到两个肩峰(图4(b)).随着CT DNA的加入,这些峰的强度明显下降.当CT DNA与[Cu(dpapz)2]PF6的浓度比为2.5时,267和361 nm处吸收峰的减色效应分别为75.9%和57.0%,且吸收峰分别红移至270和363 nm处.利用267 nm处吸收峰强度的变化进行线性拟合作图,求得[Cu(dpapz)2]PF6与CT DNA的结合常数为 5.32×105mol−1·L.[Cu(dpapz)2]PF6与 CT DNA 的结合常数与文献20报道的dpapz钌配合物与DNA的结合常数相当.配体结构对铜配合物与DNA的结合常数和相互作用方式有较大影响.文献15,16报道邻菲罗啉或含吡啶环希夫碱的Cu(I)配合物与DNA的结合常数分别为4.7×104,7.23×104mol−1·L.而dpapz具有较大的芳香环面积,因而[Cu(dpapz)2]PF6与CT DNA的结合常数较高.
加入CT DNA后,[Cu(dpapz)2]PF6的减色效应大于dpapz,且CT DNA与[Cu(dpapz)2]PF6的结合常数大于与dpapz作用的结合常数,说明[Cu(dpapz)2]PF6与CT DNA的作用要强于dpapz.文献报道,当化合物以插入方式与DNA结合时,其吸收光谱会表现出减色效应或者峰位的红移.34但对Cu(dpapz)2]PF6而言,加入DNA后,配合物的吸收峰红移较小(2−3 nm),且二者的结合常数要小于经典的DNA插入作用化合物(如[Ru(phen)2(DPPZ)]2+和溴乙锭(EB)等)与DNA作用的结合常数(106−107mol−1·L),35,36这说明[Cu(dpapz)2]PF6与DNA的作用可能为部分插入作用.与配体dpapz相比,[Cu(dpapz)2]PF6具有金属离子中心,还能够通过静电作用和CT DNA结合,因此[Cu(dpapz)2]PF6与CT DNA的作用要强于配体dpapz本身.

图4 不同浓度CT DNA存在下(a)dpapz和(b)[Cu(dpapz)2]PF6的紫外吸收光谱Fig.4 UV-Vis absorption spectra of(a)dpapz and(b)[Cu(dpapz)2]PF6with different concentrations of CT DNA
3.3 CT DNA熔解温度
熔解作用是DNA的一个极其重要的物理化学性质.测定DNA的熔解温度(Tm)是研究化合物对DNA稳定性影响的常用方法.在Tris-HCl缓冲溶液中,CT DNA的熔解温度为72.0°C(图5).加入dpapz和[Cu(dpapz)2]PF6后,CT DNA的熔解温度分别上升为79.8 °C(ΔTm=7.8 °C)、83.1 °C(ΔTm=11.1 °C),说明dpapz及[Cu(dpapz)2]PF6均能很好地稳定CT DNA.化合物与双链DNA以扦插方式作用时能引起DNA的熔解温度上升10°C以上.37因此,[Cu(dpapz)2]PF6与CT DNA具有扦插作用,这与紫外吸收光谱测定实验结果一致.而dpapz使得CT DNA的熔解温度上升相对较小(7.8°C),且dpapz与CT DNA作用时未观察到吸收峰红移并且减色效应较小(图4(a)),进一步表明dpapz与CT DNA的结合不是扦插作用,而可能采取沟槽结合的方式与CT DNA发生相互作用.38
3.4 与溴乙锭的竞争实验
溴乙锭为共轭芳香环的平面分子,是一种荧光染料,其本身荧光强度很弱,当EB插入DNA碱基对时,形成EB-DNA复合物,使得其荧光大为增强.若其它不产生荧光的分子与DNA作用时,部分地将EB从EB-DNA复合物中挤出,从而导致EB-DNA体系的荧光强度减弱,根据Stern-Volmer方程(公式(2))得到化合物的荧光猝灭常数:39

式中I0和I分别为加入配体或配合物前后EB-DNA体系的荧光强度,r=[complex]/[DNA],KSV为猝灭常数.
随着dpapz和[Cu(dpapz)2]PF6浓度的增加,EBDNA体系在592 nm处的荧光强度逐渐减小(图6).以I/I0对r作图,求得dpapz及[Cu(dpapz)2]PF6的荧光猝灭常数分别为4.52和9.86.[Cu(dpapz)2]PF6以扦插作用的方式与DNA结合,能够与EB竞争DNA碱基对的作用位点,因而具有较大的荧光猝灭常数.40而配体dpapz以沟槽作用的方式与DNA结合,与DNA作用相对较弱,因而荧光猝灭常数相对较小.41
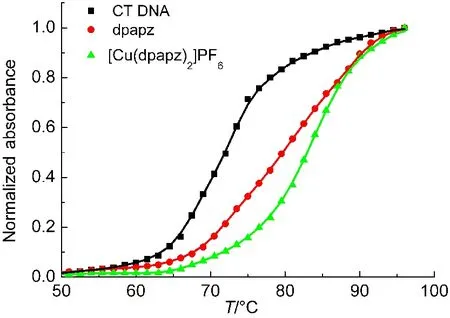
图5 加入dpapz(20 µmol·L−1),[Cu(dpapz)2]PF6(10 µmol·L−1)对CT DNA(50 µmol·L−1)的熔解温度的影响Fig.5 Normalized melting curves of CT DNA(50 µmol·L−1)with the addition of dpapz(20 µmol·L−1),[Cu(dpapz)2]PF6(10 µmol·L−1)

图6 (a)dpapz和 (b)[Cu(dpapz)2]PF6对 EB-DNA体系荧光光谱的影响Fig.6 Emission spectra of EB-DNAin the absence and presence of(a)dpapz and(b)[Cu(dpapz)2]PF6
3.5 循环伏安测试
电化学方法是研究体系氧化还原性能的重要方法,也可以对光谱实验结果进行有力的补充,有利于更深入地了解化合物与CT DNA的作用方式.在Tris-HCl缓冲溶液中,dpapz的还原电位分别位于−0.362和−1.025 V(vsSCE),可归属于吩嗪42和邻菲罗啉环43的还原电位峰(图7(a)).加入DNA后,dpapz的还原峰位和峰电流都变化较小,说明dpapz以非插入方式与DNA作用.44

图7 (a)dpapz(30 μmol·L−1)和(b)[Cu(dpapz)2]PF6(30 μmol·L−1)与0和10 μmol·L−1CT DNA在10 mmol·L−1 Tris-HCl,50 mmol·L−1NaCl缓冲溶液(pH 7.0)中相互作用的循环伏安曲线Fig.7 Cyclic voltammograms of(a)dpapz(30 μmol·L−1)and(b)[Cu(dpapz)2]PF6(30 μmol·L−1)in the presence of 0 and 10 μmol·L−1CT DNAin Tris-HCl(10 mmol·L−1,pH 7.0)buffer containing NaCl(50 mmol·L−1)
[Cu(dpapz)2]PF6在Tris-HCl缓冲溶液的还原电位分别位于−0.440和−1.110 V(vsSCE)(图7(b)),要低于配体相应的还原电位.加入CT DNA后,[Cu(dpapz)2]PF6的还原峰分别正移至−0.410和−1.080 V(vsSCE),且峰电流明显下降,说明配合物中dpapz配体部分与CT DNA有较强的相互作用.一般来说,插入作用导致金属配合物还原峰电势正移.同时,配合物与DNA进行插入作用形成稳定配合物后,溶液中自由配合物浓度降低,使得单位时间内迁移至电极表面的配合物分子数减少,从而导致配合物的还原峰电流降低.45在0.1398和0.2534 V(vsSCE)处分别还可检测到一对可逆的氧化还原峰,可归属于[Cu(dpapz)2]PF6中的Cu(II)/Cu(I)的氧化还原峰.46加入DNA后,[Cu(dpapz)2]PF6中Cu(II)/Cu(I)的还原峰由0.1398 V正移至0.1409 V(vsSCE),而氧化峰则由0.2534 V正移至0.2978 V(vsSCE),说明Cu(I)离子也参与了配合物与DNA的相互作用.但是Cu(II)/Cu(I)的氧化峰电流和还原峰电流在加入DNA后都增加,说明配合物[Cu(dpapz)2]PF6中Cu(I)与DNA作用方式可能是静电相互作用.47Cu(I)配合物一般采取四面体结构配位,因而配体与DNA进行部分插入作用,而Cu(I)离子本身采取静电作用的方式与DNA结合,12这也与紫外吸收和DNA溶解温度变化实验研究结果相符合.
3.6 超氧负离子自由基的产生

图8 三乙胺存在下利用硝基四氮唑蓝(NBT,50 μmol·L−1)法测定dpapz和[Cu(dpapz)2]PF6的O2−•的产率Fig.8 Relative quantum yields of O2−• by dpapz and[Cu(dpapz)2]PF6via nitro blue tetrazolium(NBT,50 μmol·L−1)method in the presence of triethylamine
3.7 单重态氧的产生
9,10-二苯基蒽(DPA)能与单重态氧发生环加成反应,并引起DPA的吸收下降.通过比较DPA的特征吸收峰在374 nm处的下降(图9),可了解光敏剂产生单重态氧的能力.图9插图为[Cu(dpapz)2]PF6和DPA的乙醇溶液经光照后,在350−400 nm范围内吸收光谱的变化.加入单重态氧猝灭剂DABCO后,溶液的吸收光谱的下降明显减弱,说明DPA的吸收下降是由于单重态氧引起的.图9的结果表明[Cu(dpapz)2]PF6和dpapz产生单重态氧的能力相当.
3.8 DNA的光损伤测定
超螺旋结构双链质粒DNA(Form I)中的一条DNA链段受到损伤时,可形成结构相对松弛的环状DNA(单链断裂,Form II).环状DNA的切口附近发生损伤后,进一步形成线性DNA(双链断裂,Form III).49利用琼脂糖凝胶电泳可将这三种具有不同构象的DNA进行分离,并采用凝胶成像仪进行定量分析.本文采用pBR322 DNA作为模型DNA,研究光照条件下dpapz和[Cu(dpapz)2]PF6对DNA的光损伤作用.将dpapz或[Cu(dpapz)2]PF6与DNA暗处静置20 min,或单独光照DNA溶液均未观测到明显的DNA损伤,仅有少量的Form II结构DNA(相对含量<5%),可能是DNA自发裂解引起的(图10(a)Lane 1和图10(b)Lane 1).当采用高压汞灯光照dpapz与DNA 的混合溶液 20 min时(λ>300 nm),pBR322 DNA的组成发生了变化,超螺旋结构DNA的含量为55.31%(图10(a)Lane 2和图10(b)Lane 2).而[Cu(dpapz)2]PF6与DNA溶液经过光照20 min后,大部分质粒DNA转变成为环状DNA(54.97%)或线性DNA(38.01%),仅剩余少部分超螺旋结构DNA(7.02%)(图10(a)Lane 6和图10(b)Lane 6),说明[Cu(dpapz)2]PF6对DNA的光损伤作用要强于配体dpapz.
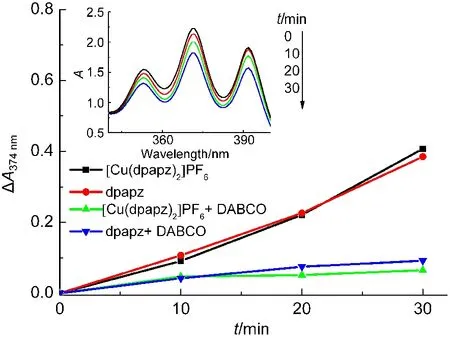
图9 9,10-二苯基蒽(DPA,80 μmol·L−1)光氧化法测定dpapz和[Cu(dpapz)2]PF6在乙醇中的单重态氧量子产率Fig.9 9,10-Diphenylanthracene(DPA,80 μmol·L−1)bleaching method for measuring the quantum yields of 1O2of dpapz and[Cu(dpapz)2]PF6in ethanol solution
加入不同活性氧的猝灭剂,可研究光敏剂光损伤DNA的机理.加入超氧负离子自由基猝灭剂对苯醌PBQ后,dpapz和[Cu(dpapz)2]PF6对DNA的光损伤作用明显减弱,超螺旋结构DNA的含量分别升高为65.26%和57.89%(图10(a),Lanes 3和7;图10(b),Lanes 3和7).而单重态氧猝灭剂DABCO和羟基自由基猝灭剂甘露醇的加入对dpapz和[Cu(dpapz)2]PF6光损伤DNA的影响相对较小(图10(a)Lanes 4,5,8和9;图10(b),Lanes 4,5,8和9).上述结果表明,超氧负离子自由基、单重态氧和羟基自由基均参与了dpapz和[Cu(dpapz)2]PF6的DNA光损伤作用.

图10 (a)dpapz(5 μmol·L−1)和[Cu(dpapz)2]PF6(5 μmol·L−1)光损伤pBR322质粒DNA的琼脂凝胶电泳图;(b)不同泳道中质粒DNA成分的百分含量Fig.10 (a)Agrose gel electrophoresis patterns of pBR322 plasmid DNAfor the light-induced DNAcleavage activity of dpapz(5 μmol·L−1)and[Cu(dpapz)2]PF6(5 μmol·L−1);(b)the percentage of plasmid DNAform in different lanes
DNA中的G碱基具有较低的氧化电位,能够与多种光敏剂发生光诱导电子转移反应.50配体dpapz或[Cu(dpapz)2]PF6与DNA发生电子转移反应生成负离子自由基和DNA正离子自由基(公式(3)).而dpapz或[Cu(dpapz)2]PF6负离子自由基与氧反应生成超氧负离子自由基(公式(4)),超氧负离子自由基以及通过歧化反应生成的羟基自由基都可以损伤DNA,这使得超氧负离子自由基成为引起DNA损伤的主要活性氧物种.[Cu(dpapz)2]PF6通过静电作用和部分扦插作用等多种方式与DNA作用,结合常数更高,因而[Cu(dpapz)2]PF6产生的活性氧能够更有效地对DNA进行光损伤.

4 结论
合成了dpapz及其配合物[Cu(dpapz)2]PF6,并采用多种方法对其结构进行了表征.[Cu(dpapz)2]PF6具有良好的稳定性,保持了产生超氧负离子自由基和单重态氧的能力.[Cu(dpapz)2]PF6通过静电作用和部分扦插作用与DNA结合,具有较高的结合常数.在光照条件下,[Cu(dpapz)2]PF6光损伤DNA的效率明显高于配体dpapz,说明选择合适的配体是增强Cu(I)配合物对DNA的亲和性和提高DNA光损伤能力的有效途径.
(1) Jamieson,E.R.;Lippard,S.J.Chem.Rev.1999,99,2467.doi:10.1021/cr980421n
(2) Reedijk,J.Chem.Rev.1999,99,2499.doi:10.1021/cr980422f
(3) Giaccone,G.;Herbst,R.S.;Manegold,C.;Scagliotti,G.;Rosell,R.;Miller,V.J.Clin.Oncol.2004,22,777.doi:10.1200/JCO.2004.08.001
(4) Frausto da Silva,J.J.R.;Williams,R.J.P.The Biological Chemistry of the Elements;Clarendon:Oxford,U.K.,1991.
(5) Yoshida,D.;Ikeda,Y.;Nakazawa,S.J.Neurooncol.1993,16,109.doi:10.1007/BF01324697
(6) Coates,R.J.;Weiss,N.S.;Daling,J.R.;Rettmer,R.L.;Warnick,G.R.Cancer Res.1989,49,4353.
(7) Gupta,S.K.;Shukla,V.K.;Vaidya,M.P.;Roy,S.K.J.Surg.Oncol.1993,52,172.
(8) Goswami,T.K.;Roy,M.;Nethaji,M.;Chakravarty,A.R.Organometallics2009,28,1992.doi:10.1021/om900012b
(9) Lahiri,D.;Bhowmick,T.;Pathak,B.;Shameema,O.;Patra,A.K.;Ramakumar,S.;Chakravarty,A.R.Inorg.Chem.2009,48,339.doi:10.1021/ic800806j
(10) Armitage,B.Chem.Rev.1998,98,1171.doi:10.1021/cr960428+
(11) Sun,H.;Yu,Z.;Yang,W.Q.;He,W.J.;Guo,Z.J.Chem.J.Chin.Univ.2011,32,437.[孙 辉,余 臻,杨玮琪,何卫江,郭子建.高等学校化学学报,2011,32,437.]
(12) Sathyadevi,P.;Krishnamoorthy,P.;Butorac,R.R.;Cowley,A.H.;Dharmaraj,N.Metallomics2012,4,498.doi:10.1039/c2mt00004k
(13) Robertazzi,A.;Vargiu,A.V.;Magistrato,A.;Ruggerone,P.;Carloni,P.;de Hoog,P.;Reedijk,J.J.Phys.Chem.B2009,113,10881.doi:10.1021/jp901210g
(14) Sigman,D.Accounts Chem.Res.1986,19,180.doi:10.1021/ar00126a004
(15) Sathiyaraj,S.;Sampath,K.;Butcher,R.J.;Pallepogu,R.;Jayabalakrishnan,C.Eur.J.Med.Chem.2013,64,81.doi:10.1016/j.ejmech.2013.03.047
(16) Veal,J.M.;Rill,R.L.Biochemistry1991,30,1132.doi:10.1021/bi00218a035
(17) Tsiaggalia,M.A.;Andreadou,E.G.;Hatzidimitriou,A.G.;Pantazaki,A.A.;Aslanidis,P.J.Inorg.Biochem.2013,121,121.doi:10.1016/j.jinorgbio.2013.01.001
(18) Pan,C.Q.;Johnson,R.C.;Sigman,D.S.Biochemistry1996,35,4326.doi:10.1021/bi952040z
(19) Xia,S.F.;Lu,X.M.Chem.Bull.2011,74,1069.[夏寺丰,鲁晓明.化学通报,2011,74,1069.]
(20) Chen,X.;Gao,F.;Yang,W.;Sun,J.;Zhou,Z.;Ji,L.Inorg.Chim.Acta2011,378,140.doi:10.1016/j.ica.2011.08.047
(21) Tan,L.;Xiao,Y.;Liu,X.;Zhang,S.Spectrochim.Acta,Part A2009,73,858.doi:10.1016/j.saa.2009.04.021
(22) Wu,B.Y.;Gao,L.H.;Wang,K.Z.Chem.J.Chin.Univ.2005,26,1206.[吴宝燕,高丽华,王科志.高等学校化学学报,2005,26,1206.]
(23) Paw,W.;Eisenberg,R.Inorg.Chem.1997,36,2287.doi:10.1021/ic9610851
(24) Karlsson,H.J.;Eriksson,M.;Perzon,E.;Akerman,B.;Lincoln,P.;Westman,G.Nucleic Acids Res.2003,31,6227.doi:10.1093/nar/gkg821
(25)Yamakoshi,Y.;Umezawa,N.;Ryu,A.;Arakane,K.;Miyata,N.;Goda,Y.;Masumizu,T.;Nagano,T.J.Am.Chem.Soc.2003,125,12803.doi:10.1021/ja0355574
(26) Miyamoto,S.;Martinez,G.R.;Martins,A.P.B.;Medeiros,M.H.G.;Mascio,P.D.J.Am.Chem.Soc.2003,125,4510.doi:10.1021/ja029262m
(27) Rondelez,Y.;Bertho,G.;Reinaud,O.Angew.Chem.Int.Edit.2002,41,1044.
(28)Yang,S.P.;Han,L.J.;Pan,Y.;Wu,Z.M.;He,X.R.;Chen,L.J.Acta Chim.Sin.2012,70,519.[杨树平,韩立军,潘 燕,吴争鸣,何欣然,陈丽娟.化学学报,2012,70,519.]doi:10.6023/A1109102
(29) Nishikawa,M.;Nomoto,K.;Kume,S.;Nishihara,H.J.Am.Chem.Soc.2012,134,10543.doi:10.1021/ja3028873
(30) Ruthkosky,M.;Kelly,C.A.;Castellano,F.N.;Meyer,G.J.Coord.Chem.Rev.1998,171,309.doi:10.1016/S0010-8545(98)90045-5
(31) Rader,R.A.;McMillin,D.R.;Buckner,M.T.;Matthews,T.G.;Casadonte,D.J.;Lengel,R.K.;Whittaker,S.B.;Darmon,L.M.;Lytle,F.E.J.Am.Chem.Soc.1981,103,5906.doi:10.1021/ja00409a048
(32) Jin,J.;Xu,X.T.;Cong,S.M.;Li,L.;Zhang,G.N.;Niu,S.Y.Acta Phys.-Chim.Sin.2012,28,2549.[金 晶,徐晓婷,丛盛美,李 雷,张广宁,牛淑云.物理化学学报,2012,28,2549.]doi:10.3866/PKU.WHXB201207311
(33) Díaz,R.;Reyes,O.;Francois,A.;Leiva,A.M.;Loeb,B.Tetrahedron Lett.2001,42,6463.doi:10.1016/S0040-4039(01)01289-8
(34) Pyle,A.M.;Rehmann,J.P.;Meshoyrer,R.;Kumar,C.V.;Turro,N.J.;Barton,J.K.J.Am.Chem.Soc.1989,111,3053.
(35) Waring,M.J.J.Mol.Biol.1965,13,269.doi:10.1016/S0022-2836(65)80096-1
(36) Deng,H.;Cai,J.;Xu,H.;Zhang,H.;Ji,L.Dalton Trans.2003,325.
(37) Ivanov,V.I.;Minchenkova,L.E.;Schyolkina,A.K.Biopolymers1973,12,89.
(38)Yin,W.F.;Ou,Z.Z.;Gao,Y.Y.;Hao,P.;Guo,C.L.;Wang,Z.L.Acta Chim.Sin.2010,68,1343.[殷卫峰,欧植泽,高云燕,郝 平,郭创龙,王中丽.化学学报,2010,68,1343.]
(39) Childs,L.J.;Malina,J.;Rolfsnes,B.E.;Pascu,M.;Prieto,M.J.;Broome,M.J.;Rodger,P.M.;Sletten,E.;Moreno,E.V.;Rodger,A.;Hannon,M.J.Chem.-Eur.J.2006,12,4919.
(40) Han,M.;Duan,Z.;Hao,Q.;Zheng,S.;Wang,K.J.Phys.Chem.C2007,111,16577.doi:10.1021/jp075194k
(41) Sheng,X.;Guo,X.;Lu,X.;Lu,G.;Shao,Y.;Liu,F.;Xu,Q.Bioconjugate Chem.2008,19,490.doi:10.1021/bc700322w
(42) Tietze,M.;Beuchle,A.;Lamla,I.;Orth,N.;Dehler,M.;Greiner,G.;Beifuss,U.ChemBioChem2003,4,333.doi:10.1002/cbic.v4:4
(43) Pellegrin,Y.;Sandroni,M.;Blart,E.;Planchat,A.;Evain,M.;Bera,N.C.;Kayanuma,M.;Sliwa,M.;Rebarz,M.;Poizat,O.;Daniel,C.;Odobel,F.Inorg.Chem.2011,50,11309.doi:10.1021/ic2006343
(44) Zhou,Y.Z.;Feng,J.N.;Yue,L.;Tu,S.J.;Zhu,H.J.Acta Chim.Sin.2009,67,1297.[周荫庄,冯静楠,岳 蕾,屠淑洁,朱惠菊.化学学报,2009,67,1297.]
(45) Pang,D.;Abruna,H.D.Anal.Chem.1998,70,3162.doi:10.1021/ac980211a
(46) Sun,Y.;Hou,Y.;Zhou,Q.;Lei,W.;Chen,J.;Wang,X.;Zhang,B.Inorg.Chem.2010,49,10108.doi:10.1021/ic101391x
(47) Carter,M.T.;Rodriguez,M.;Bard,A.J.J.Am.Chem.Soc.1989,111,8901.doi:10.1021/ja00206a020
(48) Shen,L.;Ji,H.F.;Zhang,H.Y.J.Photochem.Photobiol.A:Chem.2006,180,65.doi:10.1016/j.jphotochem.2005.09.019
(49) Neves,A.;Terenzi,H.;Horner,R.;Horn,A.;Szpoganicz,B.;Sugai,J.Inorg.Chem.Commun.2001,4,388.doi:10.1016/S1387-7003(01)00233-7
(50) Saito,I.;Takayama,M.;Sugiyama,H.;Nakatani,K.;Tsuchida,A.;Yamamoto,M.J.Am.Chem.Soc.1995,117,6406.
