睾丸原发性绒毛膜上皮癌伴未成熟畸胎瘤病理学特点及诊治分析
2013-06-22赵俊军张竹青
李 平,赵俊军,白 艳,张竹青
绒毛膜上皮癌是一种少见滋养叶细胞的高度恶性肿瘤,男女均可发病,但大多数见于女性[1-2]。绒毛膜上皮癌占睾丸生殖细胞肿瘤的0.19%,混有其他生殖细胞肿瘤成分者占睾丸生殖细胞肿瘤的8%。无论纯绒毛膜上皮癌,还是混有其他生殖细胞肿瘤成分,在睾丸高发国家每10万个男性中有0.8个患者[3]。我院近来有1例睾丸原发性绒毛膜上皮癌伴有未成熟畸胎瘤,并见腹膜后及肺转移,本文对其进行了详细的病理形态观察及免疫组织化学检查,探讨其临床表现、病理学特点及诊治方法。
1 资料与方法
1.1 一般资料 患者,男,21岁,以“发现右侧睾丸肿物1个月”于2011-10-08入院。既往身体健康。入院后查体:右侧睾丸明显增大,质硬,表面光滑,透光试验 (-),大小8 cm×5 cm;左侧睾丸及双侧附睾未见异常。实验室检查:血清人绒毛膜促性腺激素 (HCG) >10 000 U/L(参考范围0~3.0 U/L),血清甲胎蛋白 (AFP) >1 210 μg/L(参考范围0~7 μg/L)。B超检查右侧睾丸囊实性混合性占位,大小7.2 cm×5.0 cm,双侧精索静脉曲张。CT检查示腹膜后巨大占位,大小13.0 cm×7.8 cm×6.0 cm,考虑为腹膜后转移瘤。双肺CT可见多发结节灶,边缘光滑,直径<1.0 cm,考虑为肺转移瘤。肝胆脾超声未见异常。临床诊断:右侧睾丸肿瘤,腹膜后转移,肺转移。
1.2 方法 病理标本经4%中性甲醛溶液固定,石蜡包埋,4 μm厚切片,苏木精-伊红 (HE)染色。免疫组织化学检查采用SP法,操作按说明书进行。所用第一抗体包括HCG、细胞角蛋白 (CK)、AFP、胶质纤维酸性蛋白 (GFAP)及胎盘碱性磷酸酶 (PLAP)。试剂和试剂盒均购自福州迈新生物技术开发有限公司。
2 结果
2.1 病理组织检查
2.1.1 病理巨检 送检睾丸、附睾及精索,大小7 cm×6 cm×5 cm,睾丸剖开,可见白膜,睾丸内可见肿瘤大小6 cm×4 cm×4 cm,切面实性,灰红,灰白,质地中等,与周围组织界限清。
2.1.2 病理镜检 镜下可见在大量出血、坏死的背景中排列成不同结构的瘤细胞。部分为合体滋养层细胞,典型的有数个大而不规则的、深染、界不清的核,胞质嗜酸或嗜碱;部分为细胞滋养层细胞,胞质淡染或透明,有1个不规则多形核,有1个或2个核仁 (见图1);另一部分由数量不等的未成熟的胚胎组织构成,多为原始神经管及神经外胚层菊形团,神经上皮菊形团内衬拥挤的嗜碱粒细胞,核分裂像多见,可见嗜色素细胞,并见未成熟的间叶组织,为排列疏松的黏液样间质,伴灶状未成熟软骨组织 (见图2)。
2.1.3 免疫组织化学检查 滋养叶细胞阳性,HCG阳性 (见图 3),CK阳性(见图4),AFP阳性,神经管周围GFAP灶阳性,PLAP阴性。
2.1.4 病理诊断 睾丸原发性绒毛膜上皮癌伴未成熟畸胎瘤 (见图5)。
2.2 治疗与预后 患者于我院泌尿外科行根治性睾丸切除术,双肺肿瘤、腹膜后肿瘤未切除,术后转入肿瘤科进行化疗和放疗,化疗6个疗程,放疗1个月,化疗采用顺铂+博莱+VT16,临床有一定的疗效。入院时血清HCG>10 000 U/L,经过6次化疗后HCG为1.35 U/L;入院时血清AFP>1 210 μg/L,化疗6次后10.6 μg/L。目前随诊9个月,患者一般状况良好,CT显示肺转移灶缩小,入院时肺结节直径约为1.0 cm,化疗、放疗后结节直径约为0.8 cm。腹膜后肿瘤大小没有明显改变。
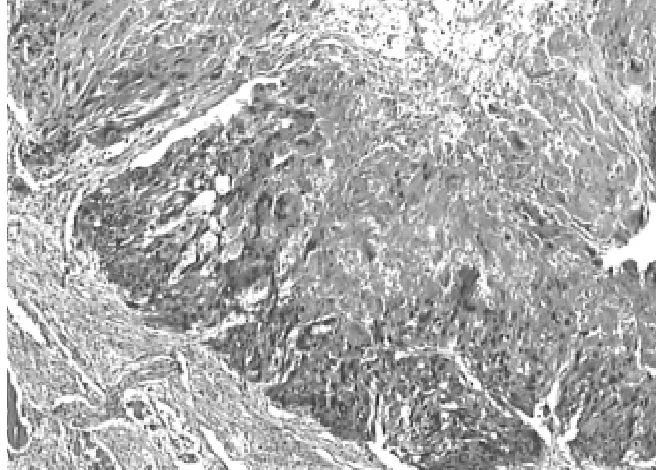
图1 绒毛膜上皮癌成分,镜下见合体滋养层细胞和细胞滋养层细胞,并见坏死 (HE×40)Figure 1 Chorionepithelioma component,syncytiotrophoblast cell,cytotrophoblast cell and necrosis seen under microscope
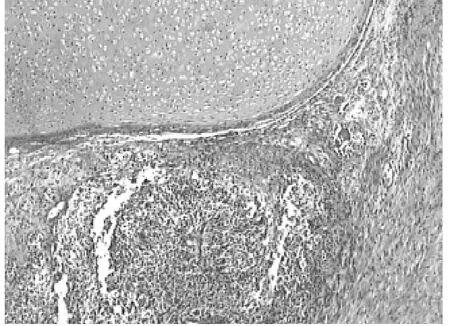
图2 未成熟畸胎瘤成分,镜下见原始神经管及未成熟的软骨 (HE×40)Figure 2 Immature teratoma component,archaeo-neural tube and immature cartilage seen under microscope
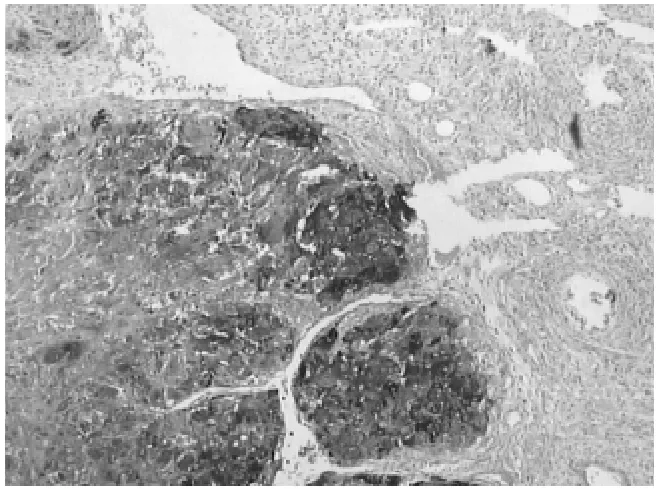
图3 绒毛膜上皮癌,免疫组织化学,HCG阳性 (HE×40)Figure 3 Immunohistochemical showing positive HCG in chorionepithelioma
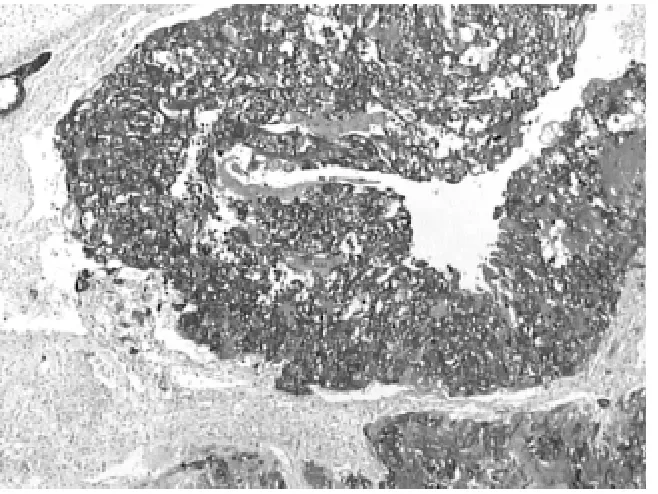
图4 绒毛膜上皮癌,免疫组织化学,CK阳性(HE×40)Figure 4 Immunohistochemical showing positive CK in chorionepithelioma

图5 右上角绒毛膜上皮癌成分,左下角未成熟畸胎瘤成分 (HE×40)Figure 5 Chorionepithelioma component on the upper-right corner and immature teratoma component on the lower-left corner under microscope
3 讨论
3.1 流行病学 美国统计睾丸生殖细胞肿瘤的发病率为3.5/10万 (白人)和0.9/10万 (黑人),其中睾丸绒毛膜上皮癌占1%;我国睾丸生殖细胞肿瘤发病率约1/10万[3]。无论是绒毛膜上皮癌,还是混有其他生殖细胞肿瘤成分,在睾丸癌高发国家每10万个男性中有0.8个患者[4]。
3.2 组织学发生 目前对绒毛膜上皮癌的发生无一致的认识。一些研究认为是生殖细胞自卵黄囊沿生殖嵴从前后移行过程中,部分停留在中途,后因某种分化呈绒毛膜上皮癌,所以在体轴附近部位始发。还有研究认为,畸胎发生学说,即多能原始生殖细胞在分化过程中,由于某种原因而形成生殖细胞肿瘤,所以绒毛膜上皮癌经常与生殖细胞肿瘤并存[5]。
3.3 临床表现 多为年轻患者,平均年龄25~30岁,最常见的症状是转移性病变的相关症状。一般以肺部转移症状常见[6],包括咯血、呼吸困难、中枢神经异常、呕血、黑便、低血压、贫血等[7]。本例患者睾丸发现肿瘤时,双侧肺及腹膜后已有转移。患者血中HCG明显增高,由于HCG与黄体生成素有交叉反应,造成睾丸间质细胞增生,约10%的患者有男性乳腺发育,HCG还可与促甲状腺素有交叉反应,患者可以有甲状腺功能亢进症状[8]。AFP一般在睾丸单纯绒毛膜上皮癌不增高,本例患者混有未成熟畸胎瘤,故HCG、AFP均增高。B超检查对睾丸绒毛膜上皮癌的诊断可以提供较大的帮助,绒毛膜上皮癌易出现出血和坏死,B超显像多表现为边界欠清的混合回声块影伴无回声区,如果睾丸的原发灶很小,B超仅能发现局灶性回声异常,易被遗漏。所以,一旦怀疑睾丸患生殖细胞肿瘤,应该反复对双侧睾丸进行B超检查。
3.4 病理特点 肉眼可见肿瘤组织有较广泛的出血、坏死结节,这是绒毛膜上皮癌的一大特征。睾丸绒毛膜上皮癌常混有其他生殖细胞肿瘤成分。镜下可见两部分组成,大部分区域为绒毛膜上皮癌成分,肿瘤由合体滋养层细胞和细胞滋养层细胞构成,本例合并少部分由未成熟的胚胎组织,其内可见原始神经管及未成熟的软骨组织等。免疫组织化学:滋养叶细胞阳性,HCG阳性,CK阳性,AFP阳性,神经管周围GFAP灶阳性,PLAP阴性。
3.5 鉴别诊断
3.5.1 精原细胞瘤 精原细胞瘤是睾丸最常见的肿瘤,占睾丸生殖细胞肿瘤的40% ~50%。多发生在35~45岁,平均年龄40岁,绝大多数患者临床表现为睾丸肿大,1%~3%的患者首发症状是转移[9]。光镜:肿瘤细胞较大,大小一致,核大圆形,位于中央,核膜清,病理性核分裂常见。肿瘤呈片状分布,间质可见数量不等的淋巴细胞浸润。部分精原细胞瘤中含有合体滋养层细胞,需与绒毛膜上皮癌鉴别。绒毛膜上皮癌由合体滋养层和细胞滋养层两种细胞组成,并见广泛出血坏死。
3.5.2 胚胎性癌 胚胎性癌约占男性生殖细胞源性肿瘤的20%,常见于20~30岁[7]。临床表现为睾丸无痛性肿大,多为单侧,约1/3患者初次诊断时已伴有淋巴结、肺、肝转移。光镜:肿瘤细胞多形性,细胞核大,不规则,染色质颗粒状,核仁明显,病理性核分裂多见。肿瘤细胞呈腺泡状、小管状、实性巢状或乳头状排列,部分肿瘤除上皮成分外,可见间叶成分如软骨或肌肉等成分。免疫组织化学检查:CK、AFP、PLAP均为阳性。
3.5.3 卵黄囊瘤 卵黄囊瘤是一种向卵黄囊、尿囊和胚外中胚层分化的生殖细胞肿瘤,是青春期前儿童常见的生殖细胞肿瘤。发病年龄为新生儿至9岁儿童。青春期后患者单纯性卵黄囊瘤罕见。临床表现为睾丸肿大,少数成人以转移肿瘤有关症状或男性乳腺发育就医。光镜:组织结构多样性,有腺样、疏松网状和内胚窦样结构 (S-D小体),细胞立方形、偶见梭形或圆形,核圆,大小一致,空泡状,胞质丰富,胞质内可见PAS阳性红染嗜酸小球。绒毛膜上皮癌缺乏S-D小体和嗜酸小球样结构。免疫组织化学检查:AFP弥漫阳性,PLAP部分阳性。
3.5.4 畸胎瘤恶变 睾丸畸胎瘤恶变少见。大体为囊实性,界限清楚,灰白色,质地不均匀,可见出血、坏死。镜下:除成熟畸胎瘤成分外,可见肿瘤性上皮成分癌,如鳞癌、腺癌。还可以伴发多种体细胞型肿瘤、肉瘤等。
3.5.5 睾丸出血性坏死 睾丸出血性坏死常由睾丸扭转、创伤和凝血障碍引起,睾丸痛性肿大,镜下:睾丸组织凝固性坏死,可见睾丸组织影像。而睾丸绒毛膜上皮癌常无痛,镜下:出血坏死灶中无睾丸组织轮廓,免疫组织化学检查HCG阳性有助于绒毛膜上皮癌诊断。
3.6 治疗与预后 目前睾丸肿瘤的治疗倾向于综合治疗,根治性睾丸切除术及联合化疗[10]。文献报道转移性绒毛膜上皮癌对化疗的敏感性相差较大。多数文献报道化疗效果欠佳 (数月至2年死亡)。一些报道认为女性妊娠性绒毛膜上皮癌的化疗方案用于男性非妊娠性绒毛膜上皮癌的治疗效果不理想[10]。绒毛膜上皮癌可能由于其有浸润血管倾向,因此确诊时肿瘤往往已经扩散,大多数患者均为晚期,而且预后差。血清HCG越高,可能反映肿瘤块较大,预后越差。
1 陈乐真.妇产科诊断病理学[M].北京:人民军医出版社,2010:378-379.
2 袁鸿,杨志峰.葡萄胎子宫切除术15年后发生绒毛膜癌 1例 [J].疑难病杂志,2009,8(4):200.
3 Eble JN.泌尿系及男性生殖器官肿瘤和遗传学[M].冯晓莉,译.北京:人民卫生出版社,2006:270.
4 吴刚,杨华,靳风烁,等.睾丸纯绒毛癌2例报告并文献复习 [J].临床泌尿外科杂志,2006,21(9):667-669.
5 曹冬焱,向阳,杨秀玉,等.非妊娠性绒毛膜癌17例临床分析[J].中华妇科杂志,2003,38(5):284-286.
6 陈成华,张宁.绒毛膜癌肺转移的X线诊断[J].实用心脑肺血管病杂志,2010,18(9):1309.
7 刘格利.绒毛膜癌转移二例误诊分析[J].实用心脑肺血管病杂志,2012,20(7):1249.
8 Gleason PE,Elliontt DS,Zimmerman D,et al.Metatic testicular choriocarcinoma and secondary hyperthyrodism:case report and review of the lierture [J].J Urol,1994,151(4):1063-1064.
9 刘彤华,李维华,刘鸿瑞,等.诊断病理学[M].2版.北京:人民卫生出版社,2006:457-459.
10 徐振群,回保龄,詹运洪,等.1例睾丸未成熟型畸胎瘤伴精原细胞瘤的临床分析[J].中华男科学杂志,2011,17(2):177-178.
