NK细胞与CIK细胞体外诱导扩增及其活性比较
2013-06-20赵杨祉崔久嵬徐东升金浩范梁婷婷王冠军
赵杨祉,崔久嵬,徐东升,牛 超,金浩范,梁婷婷,李 红,王冠军,李 薇
(吉林大学第一医院肿瘤中心,吉林 长春 130021)
NK细胞与CIK细胞体外诱导扩增及其活性比较
赵杨祉,崔久嵬,徐东升,牛 超,金浩范,梁婷婷,李 红,王冠军,李 薇
(吉林大学第一医院肿瘤中心,吉林 长春 130021)
目的:探讨体外诱导和扩增NK细胞和CIK细胞的方法,比较二者的增殖能力及其对肿瘤细胞的杀伤活性。方法:提取肿瘤患者外周血单个核细胞(PBMCs),在细胞因子诱导下培养NK细胞和CIK细胞。观察2种细胞的形态学变化,采用流式细胞术检测CD3-CD56+NK细胞和CD3+CD56+CIK细胞比例,计算细胞扩增倍数;采用ELISA法检测NK细胞和CIK细胞分泌干扰素-γ(IFN-γ)的水平;采用CCK-8法检测NK和CIK细胞对K562细胞株的杀伤活性。结果:经过14d体外诱导培养后,NK细胞扩增(160.00±12.15)倍,CIK细胞扩增(110.00±15.48)倍,NK细胞的扩增能力强于CIK细胞(P<0.05);NK和CIK细胞分泌IFN-γ量分别为(4 227.75±731.94)和(525.96±304.84)μg·L-1,NK细胞分泌IFN-γ的能力强于CIK细胞(P<0.01);诱导扩增后NK和CIK细胞对K562细胞株具有较强的杀伤活性,随着效靶比的升高杀伤活性增强。在效靶比为25∶1时,NK细胞和CIK细胞对K562细胞的杀伤率分别为65.35%和57.68%,NK细胞的杀伤活性强于CIK细胞(P<0.01)。结论:在体外成功建立了NK细胞和CIK细胞的诱导扩增体系,NK细胞的扩增能力、IFN-γ分泌水平以及其对K562细胞株的杀伤作用均强于CIK细胞。
自然杀伤细胞;细胞因子诱导的杀伤细胞;杀伤活性
近年来,随着免疫学及分子生物学技术的发展,细胞生物治疗已经成为肿瘤治疗的第4种模式。常用的免疫细胞主要有细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)和自然杀伤细胞(natural killer cells,NK)等[1]。目前相关研究[2-3]已表明:能够在体外诱导扩增获得大量的CIK细胞,CIK细胞对于急慢性髓系白血病和多种实体肿瘤具有一定的临床疗效。但是对于NK细胞的体外诱导扩增和二者体外活性的对比研究则较少,高质量NK细胞的获得及其抗瘤活性的不明确仍是限制其临床应用的关键。本研究在体外成功诱导扩增NK细胞和CIK细胞,并比较了二者的体外活性,旨在为其进一步的临床应用提供实验基础。
1 资料与方法
1.1 标本来源及细胞株 选取2011年7月1日—8月1日就诊于本科的肿瘤患者27例(其中肺癌患者10例,胃癌患者10例,乳腺癌患者7例),男性15例,女性12例,中位年龄55岁。其中Ⅰ-Ⅱ期肿瘤患者17例,Ⅲ-Ⅳ期患者10例。K562细胞株为本实验室冻存细胞株,用含有10%FCS的RPMI-1640培养液传代培养,每2~3d换液1次。
1.2 主 要 试 剂 及 仪 器 rhIFN-γ、rhIL-2、rhIL-12和 rhIL-15(Peprotech 公 司, 美 国 ), 抗CD3McAb(Neo Markers公司,美国),胎牛血清FCS(Sigma公司,美国),DMSO(上海华壹生物科技有限公司),淋巴细胞分离液(Mediatech公司,美国),IFN-γELISA试剂盒(武汉博士德生物工程有限公司),CCK-8试剂盒(同仁公司,日本),RPMI-1640培养液、AIM-V无血清培养液(Gibico 公 司, 美 国 ),CD3-APC、CD56-PE 和CD16-FITC流式细胞荧光标记抗体(BD公司,美国)。倒置显微镜(Olympus公司,日本),流式细胞仪(BD公司,美国),离心机(上海森信实验仪器有 限 公 司),CO2培 养 箱 (RCO-3000TVBB,RECO公司,美国),生物安全柜(Thermo公司,美国),96孔细胞培养板(北京鼎国生物技术有限公司)。
1.3 外周血单核细胞的分离 抽取肿瘤患者静脉血10mL,肝素抗凝,PBS液等体积稀释,用淋巴细胞分离液进行密度梯度离心(1 800r·min-1、22℃、30min),获取外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),用RPMI-1640培养基洗涤2次,然后用AIM-V培养液悬浮细胞。
1.4 NK细胞的体外诱导扩增 将PBMCs密度调整为2×106mL-1,先后加入含有抗CD3McAb、rhIL-2、IL-12和IL-15的 AIM-V 培养基,置于37℃、5%CO2培养箱中培养,每隔3d半量换液,并补充相应的细胞因子和自体血浆。
1.5 CIK细胞的体外诱导扩增 将PBMCs密度调整为2×106mL-1,加入rhIFN-γ(终浓度为1 000IU·mL-1),置于37℃、5%CO2培养箱中培养24h,然后加入抗CD3McAb(终浓度为50mg·L-1)和rhIL-2(终浓度为1 000IU·mL-1)继续培养。每2~3d半量换液,并补加相应的细胞因子和自体血浆。
1.6 NK和CIK细胞体外增殖观察 在培养过程中每天观察细胞的形态、数量和生长状况等变化。在培养第7和14天分别收集NK和CIK细胞,用PBS液洗涤2次,将细胞浓度调整为5×106mL-1,取100μL细胞悬液置流式细胞仪专用试管中,加入CD3-APC和CD56-PE鼠抗人单克隆抗体,于室温下避光孵育15min,PBS液洗涤2次,300μL PBS悬起细胞,采用流式细胞术进行检测。
1.7 细胞因子IFN-γ分泌水平检测 分别收集培养第14天的NK和CIK细胞,将细胞浓度调整为5×105mL-1,取200μL加入96孔板中,每组设双复孔,于37℃、5%CO2培养箱中培养24h后,按照IFN-γELISA试剂盒说明书操作,检测培养液中IFN-γ水平。
1.8 NK和CIK细胞对K562细胞株杀伤活性检测 取对数生长期K562细胞,离心换液后将细胞浓度调整为4×105mL-1,将细胞轻轻吹打混匀后,接种于96孔板中,每孔100μL细胞悬液。按照效靶比6∶1、12∶1和25∶1分别调整NK和CIK细胞浓度,接种于96孔板,每孔100μL。铺板后将96孔板置于37℃、5%CO2培养箱中孵育24h后,每孔加入20μL CCK8溶液,37℃孵育1.5h,利用酶标仪在450nm处检测吸光度(A)值。按照如下公式计算效应细胞的杀伤活性:杀伤活性(%)=[靶细胞对照组A值-(实验组A值-效应细胞对照组A值)]/靶细胞对照组A值×100。靶细胞对照组为单纯K562细胞,效应细胞对照组为单纯CIK细胞或单纯NK细胞,实验组为CIK细胞+K562细胞或NK细胞+K562细胞。1.9 统计学分析 采用SPSS 13.0软件进行统计分析。NK、CIK细胞比例和IFN-γ分泌水平以±s表示,组间比较采用t检验。
2 结 果
2.1 诱导前后NK和CIK细胞形态学 诱导前PBMCs细胞体积较小,呈圆形;在诱导培养过程中,PBMCs细胞体积逐渐变大,细胞浆越来越丰富,细胞核逐渐增大;第3~4天细胞开始聚集,成簇状克隆样生长;此后细胞增殖更加显著,至第7天时胞体出现突起,且不规则。CIK和NK细胞形态相似,部分呈幼稚的淋巴细胞,有的似成熟的大淋巴细胞,并可见细胞克隆团。
2.2 NK和CIK细胞增殖情况 来自肿瘤患者的PBMCs能够在体外诱导培养出NK和CIK细胞,培养后NK和CIK细胞所占比例明显提高。NK细胞在培养的3~5d即出现增殖变化,而CIK细胞在培养7~10d出现增殖变化。在培养14d时,NK 细胞所占比例达(65.33±25.22)%,扩增(160.00±12.15)倍;CIK 细胞所占比例达(35.67±15.23)%,扩增(110.00±15.48)倍,NK细胞的诱导扩增效果明显优于CIK细胞(P<0.05)。见表1和图1。
表1 不同培养时间NK细胞和CIK细胞所占比例比较Tab.1 Comparison of the proportion of NK and CIK cells at different culture time [n=20,(±s)/%]

表1 不同培养时间NK细胞和CIK细胞所占比例比较Tab.1 Comparison of the proportion of NK and CIK cells at different culture time [n=20,(±s)/%]
*P<0.05 vs CD3-CD56+ NK group.
0 7 14 CD3-CD56+NK Group Cell proportion(t/d)6.23±3.45 41.24±6.57 65.33±25.22 CD3+CD56+CIK 2.56±0.19 12.54±2.76* 35.67±15.23*
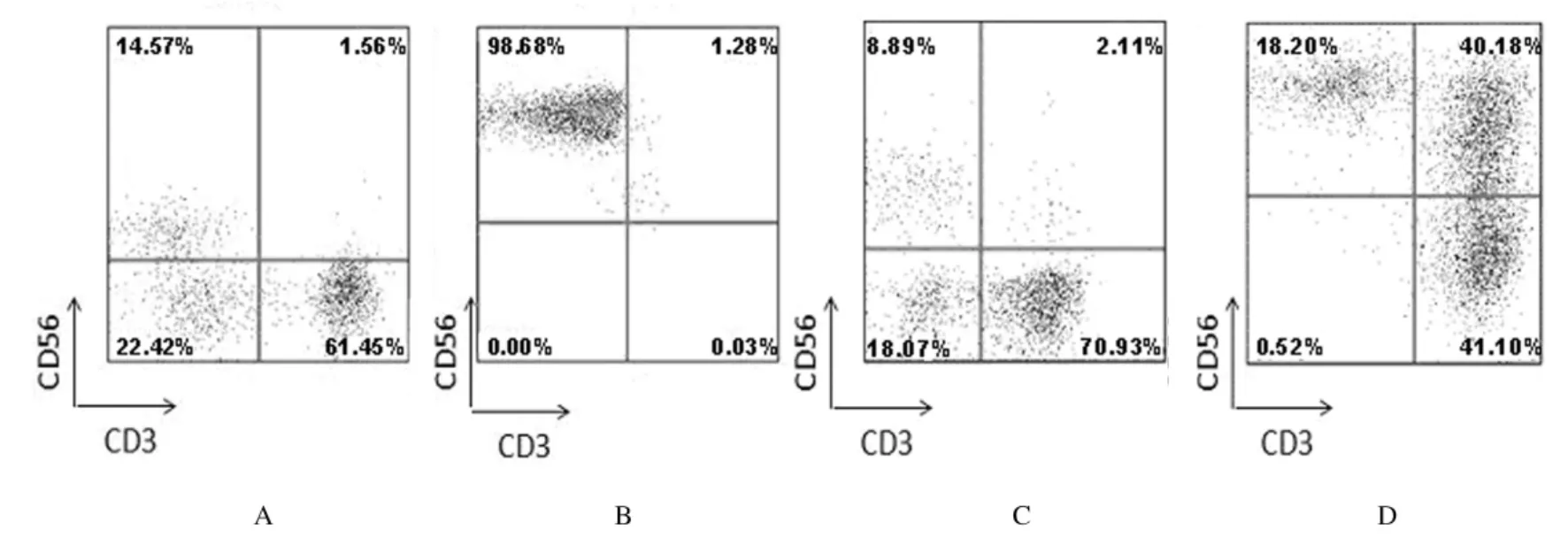
图1 诱导前后NK细胞和CIK细胞检测流式细胞图Fig.1 Flow cytometry graph of NK and CIK cells before and after induction
2.3 NK和CIK细胞分泌IFN-γ水平比较 在体外诱导培养14d后,NK和CIK细胞分泌IFN-γ量分 别 为 (4 227.75±731.94) 和 (525.96 ±304.84)μg·L-1,NK细胞IFN-γ的分泌水平明显高于CIK细胞 (P<0.01)。
2.4 效应细胞作用前后K562细胞的形态学变化倒置显微镜下,正常的K562细胞体积较大,胞膜完整,折光性好,生长旺盛;加入效应细胞24h后,效应细胞聚集在K562细胞周围,部分效应细胞融合胀大并发生吞噬作用。K562细胞轮廓模糊,细胞外形皱缩,细胞出现裂解。见图2和3。
2.5 NK和CIK细胞对K562细胞杀伤活性比较将体外培养的效应细胞分别与靶细胞作用,随着效靶比的升高,杀伤活性增强。在相同效靶比情况下,NK细胞对K562细胞的杀伤作用强于CIK细胞。在效靶比为25∶1时,NK细胞和CIK细胞对K562细胞的杀伤率分别为65.35%和57.68%,NK细胞的杀伤活性强于CIK细胞(P<0.01)。见图4。
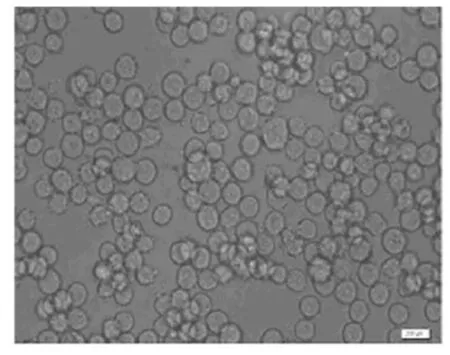
图2 正常K562细胞的形态(×400)Fig.2 Morphology of normal K562cells(×400)
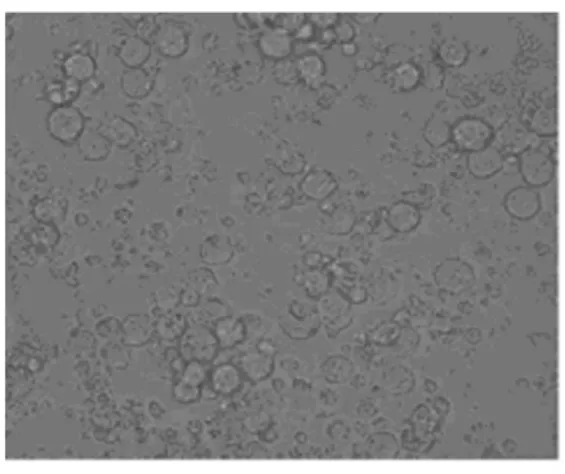
图3 效应细胞作用24h后K562细胞的形态(×400)Fig.3 Morphology of K562cells after treated with effector cells for 24h(×400)
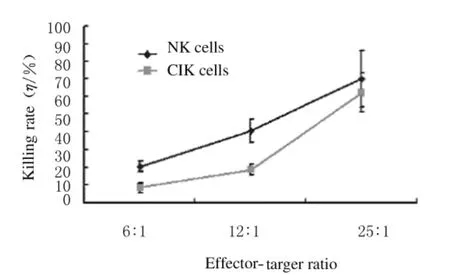
图4 不同效靶比时NK和CIK细胞对K562细胞杀伤活性Fig.4 Killing activities of NK and CIK cells against K562 cells at different effector-target ratios
3 讨 论
NK细胞是机体对抗病原体侵袭和正常细胞恶变的一种重要的天然免疫细胞,无需预先接触肿瘤特异性抗原即可杀伤肿瘤细胞[4],对肿瘤的增殖和转移扩散均具有 “抑制”作用[5-6]。NK细胞能够清除术后微小残留病灶,降低复发[7],因而被认为是肿瘤免疫治疗的重要免疫细胞。CIK细胞是由多种细胞因子,如IFN-γ、IL-2和抗CD3McAb等诱导而成的细胞毒性T淋巴细胞[8]。由于CIK细胞同时表达CD3和CD56 2种膜蛋白分子,因而又被称为 “NK细胞样T淋巴细胞”,同时具有T淋巴细胞强大的抗肿瘤活性以及NK细胞非主要组织相容性复合体 (MHC)限制性的杀瘤特性[9]。目前,多项临床研究[10-11]显示:CIK细胞对急慢性髓系白血病、肺癌、胃癌、肝癌、乳腺癌、肠癌和食道癌等多种恶性肿瘤均有一定的疗效。目前CIK细胞的体外诱导扩增技术已经比较成熟,但是如何在体外大量获得NK细胞及其抗瘤活性尚不够明确,仍是限制NK细胞临床应用的瓶颈[12]。本研究在应用多种细胞因子条件下,成功地在体外将NK细胞扩增激活,在培养14d时NK细胞出现增殖高峰,较培养0d时增加 (160.00±12.15)倍,而CIK细胞在体外培养14d时增加 (110.00±15.48)倍,提示可以在培养14d时进行细胞回输。NK细胞和CIK细胞不仅可通过细胞毒作用直接杀伤肿瘤细胞,而且可以通过分泌细胞因子IFN-γ间接发挥抗肿瘤活性[13-15]。本研究表明:NK细胞分泌IFN-γ的能力强于CIK细胞,预示着NK细胞在临床上可能会有更好的治疗效果。
体外诱导扩增的NK细胞和CIK细胞对K562细胞均显示出了明显的杀伤活性,进一步证实了NK细胞和CIK细胞的非MHC限制性的抗瘤特性。随着效靶比的增加,NK细胞和CIK细胞对K562细胞的杀伤活性亦显著增强,并且NK细胞对K562细胞的杀伤活性强于CIK细胞,这可能与NK细胞分泌IFN-γ的能力强于CIK细胞有关。
肿瘤患者机体免疫功能受抑制,免疫细胞的数量和活性均降低,本研究对肿瘤患者自体免疫细胞进行体外诱导扩增,获得了大量具有较强杀伤活性的NK和CIK细胞,本研究结果为体外大量获得免疫效应细胞应用于肿瘤免疫治疗提供了技术基础。
[1]Sangiolo D. Cytokine induced killer cells as promising immunotherapy for solid tumors [J]. Cancer,2011,2 (3):363-368.
[2]Yeh CL,Kam Hui.Cytokine-induced NK-like T cells:from bench to bedside[J].Biomed Biotechnol,2010,10 (10):435745-435753.
[3]Pievani A,Belussi C,Christian K,et al.Enhanced killing of human B-cell lymphoma targets by combined use of cytokineinduced killer cell (CIK ) cultures and anti-CD20 antibodies [J].Blood,2011,117 (2):510-518.
[4]Gonzales CM, Williams CB, Calderon VE, et al.Antibacterial role for natural killer cells in host defense to Bacillus anthracis [J].Infect Immun,2012,80 (1):234-242.
[5]Geller MA,Cooley S,Judson PL,et al.A phaseⅡstudy of allogeneic natural killer cell therapy to treat patients with recurrent ovarian and breast cancer[J].Cytotherapy,2011,13 (1):98-107.
[6]Triplett BM,Horwitz EM,Lyengar R,et al.Effects of activating NK cell receptor expression and NK cell reconstitution on the outcomes of unrelated donor hematopoietic cell transplantation for hematologic malignancies [J].Leukemia,2009,23 (7):1278-1287.
[7]Cho D,Campana D.Expansion and activation of nature killer cells for cancer immnotherapy [J].Lab Med,2009,29 (2):89-96.
[8]Kim HM,Kang JS,Lim J,et al.Antitumor activity of cytokine-induced killer cells in nude mouse xenograft model[J].Pharm Res,2009,32 (5):781-787.
[9]He M,Wang Y,Shi WJ,et al.Immunomodulation of inducible co-stimulator (ICOS)in hu-man cytokine-induced killer cells against cholangiocarcinoma through ICOS/ICOS ligand interaction[J].Digest Dis,2011,12 (5):393-400.
[10]Zhong R,Teng J,Han B,et al.Dendritic cells combining with cytokine induced killer cells synergize chemotherapy in patients with late-stage non-small cell lung cancer[J].Cancer Immunol Immunother,2011,60 (10):1497-1502.
[11]Zhang JP,Mao GH,Han YP,et al.The clinical effects of DC-CIK cells combined with chemotherapy in the treatment of advanced NSCLC[J].Clin Oncol,2012,11 (2):67-71.
[12]Sun JC,Beilke JN,Lanier LL.Adaptive immune features of natural killer cells[J].Nature,2009,457 (7229):557-561.
[13]Pievani A,Borleri G,Pende D,et al. Dual-functional capability of CD3+CD56+CIK cells,a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity [J].Blood,2011,118(12):3301-3310.
[14]赵 磊,王念跃,张红梅.AIDS患者与正常人CD8+CD25+、CD4+CD25+、B淋巴细胞、NK细胞与NKT细胞计数对照研究 [J].中国实验诊断学,2012,16 (10):1857-1859.
[15]艾金霞,崔焕波.SBHL对S180荷瘤小鼠肿瘤生长及免疫功能的影响 [J].中国实验诊断学,2010,14 (6):828-830.
Induction and expansion of NK and CIK cellsinvitroand comparison of their activities
ZHAO Yang-zhi,CUI Jiu-wei,XU Dong-sheng,NIU Chao,JIN Hao-fan,LIANG Ting-ting,LI Hong,WANG Guan-jun,LI Wei
(Cancer Center,First Hospital,Jilin University,Changchun 130021,China)
Objective To explore the methods to induce and expand the NK and CIK cellsinvitroand to compare the proliferation abilities and anti-tumor activities of NK and CIK cells.Methods Peripheral blood mononuclear cells(PBMCs)were separated from the peripheral blood of cancer patients.The PBMCs were induced by cytokines to culture NK and CIK cells.The morphological changes of NK and CIK cells were observed.The percentages of CD3-CD56+NK and CD3+CD56+CIK cells were detected by flow cytometry.And the expansion folds of NK and CIK cells were calculated.The levels of interferon-γ(IFN-γ)secreted by NK and CIK cells were detected by ELISA method.And the killing activities of NK and CIK cells against K562cell strain were detected by CCK-8method.Results After induction and expansioninvitrofor 14d,the NK cells expanded(160.00±12.15)folds,and the CIK cells expanded(110.00±15.48)folds.The expansion ability of the NK cells was higher than that of the CIK cells(P<0.05).The secretion levels of IFN-γin the supernatant of NK and CIK culture system raised to(4 227.75±731.94)and(525.96±304.84)μg·L-1,respectively.The secretion level of IFN-γof the NK cells was higher than that of the CIK cells(P<0.01).After induction and expansion,the cytotoxicities of NK and CIK cells against K562cells were enhanced with the increase of effector-target ratio.The killing rates of NK and CIK cells against K562cells were 65.35%and 57.68%at 25∶1effector-target ratio,respectively.The killing activity of NK cells was higher than that of CIK cells at the same effector-target ratio(P<0.01).Conclusion The induction and expansion system of NK and CIK cellsinvitrois established successfully,and the expansion capability,the secretion level of IFN-γ,and the cytotoxicity of the NK cells are higher than those of the CIK cells.
natural killer cells;cytokine induced killer cells;killing activity
R733
A
1671-587Ⅹ(2013)03-0477-05
10.7694/jldxyxb20130311
2012-10-25
教育部科研基金资助课题 (311015);吉林省财政厅科研基金资助课题 (3D5116523428);吉林省科技厅科研基金资助课题 (20100749)
赵杨祉 (1985-),女,吉林省长春市人,医师,医学硕士,主要从事肿瘤免疫治疗研究。
李 薇 (Tel:0431-88782794,E-mail:drweili@yahoo.com)
