赖氨大黄酸和紫杉醇对肺癌细胞增殖的抑制作用和凋亡诱导作用
2013-06-20甄永占林雅军章广玲林小虎王梅梅魏静波
甄永占,林雅军,章广玲,林小虎,王梅梅,李 冉,魏静波
(1.河北联合大学基础医学院组织学与胚胎学教研室,河北 唐山 063000;2.卫生部北京医院老年医学研究所,北京 100730;3.河北省迁西县人民医院胸外科,河北 唐山 064300)
赖氨大黄酸和紫杉醇对肺癌细胞增殖的抑制作用和凋亡诱导作用
甄永占1,林雅军2,章广玲1,林小虎3,王梅梅1,李 冉1,魏静波1
(1.河北联合大学基础医学院组织学与胚胎学教研室,河北 唐山 063000;2.卫生部北京医院老年医学研究所,北京 100730;3.河北省迁西县人民医院胸外科,河北 唐山 064300)
目的:研究赖氨大黄酸(RHL)、紫杉醇单独和两者联合对人肺癌H460细胞增殖和凋亡的影响,阐明其作用机制。方法:选取处于对数生长期肺癌细胞株H460,随机分为对照组(不加药物)、紫杉醇组(1μmol·L-1紫杉醇)、RHL组(100μmol·L-1RHL)和紫杉醇联合RHL组,并设空白组。采用 MTT法和流式细胞术分别检测各组处理后48h的细胞增殖率和凋亡率;采用Western blotting方法检测凋亡相关蛋白和MEK/ERK蛋白的表达水平。结果:细胞培养48h后,联合用药组细胞增殖率显著低于对照组、紫杉醇组和RHL组 (P<0.05),联合用药组细胞凋亡率显著高于对照组、紫杉醇组和RHL组(P<0.05),联合用药组caspase-3和poly ADP-ribose polymerase(PARP)的切割片段蛋白表达强度明显高于对照组、紫杉醇组和RHL组,联合用药组Bcl-2和NF-κB蛋白表达强度明显低于对照组、紫杉醇组和RHL组,同时RHL组紫杉醇上调的MEK和ERK蛋白磷酸化强度降低。结论:紫杉醇和RHL均可抑制肺癌H460细胞增殖,诱导细胞凋亡;RHL通过降低ERK活性、上调caspase-3和PARP的切割片段蛋白表达,增强紫杉醇抑制肺癌细胞增殖和凋亡诱导作用。
赖氨大黄酸;紫杉醇;肺癌;细胞凋亡;联合用药
大黄酸是传统中药大黄中的一个重要蒽醌类化合物,可抑制多种肿瘤细胞增殖,并诱导其凋亡,具有广泛的生物学活性[1-3]。蒽醌类化合物的共同特点是不溶于水,因此限制了其在肿瘤治疗方面的应用。目前国内外多采用不溶于水的大黄酸进行研究,本实验室对大黄酸进行结构改造,获得了水溶性好的赖氨大黄酸(rhein lysinate,RHL),与大黄酸比较,RHL溶解度提高为8g·L-1[1]。本研究观察RHL联合紫杉醇对人肺癌H460细胞增殖、凋亡的影响及其作用机制,为大黄酸在肿瘤治疗中的应用提供依据。
1 材料与方法
1.1 细胞株和主要试剂 人肺癌细胞株(H460)由本室传代保存。使用前用含10%胎牛血清(Hyclone)的高糖DMEM培养液(Gibco公司),置于37℃、5%CO2饱和湿度条件下培养,2d传代1次,实验用细胞为对数生长期细胞。RHL由本室合成,分子式为C21H22N2O8,相对分子质量为430,纯度93%。主要试剂:赖氨酸为北京市科海军舟生物科技发展中心产品。实验用紫杉醇(中国医学科学院肿瘤研究所),蛋白定量试剂盒(BCATMprotein assay kit,Pierce公司产品),宽范围蛋白预染 Marker(New England Biolabs公司),蛋白质印迹发光液和PVDF膜(Millipore公司),FITC-AnnexinⅤ 凋亡检测试剂盒(北京宝赛生物技术有限公司),β-actin抗体sc-1616(Santa Cruz公司),HRP标记的羊抗兔、兔抗羊和羊抗小鼠IgG抗体(北京中杉金桥有限责任公司),丝裂原活化蛋白激酶家族成员抗体试剂盒,磷酸化丝裂原活化蛋白激酶家族成员抗体试剂盒和凋亡信号通路试剂盒(Cell Signaling Technology公司)。
1.2 细胞增殖活性检测 应用MTT法检测细胞存活率。取对数生长期细胞,轻轻吹打分散成细胞悬液,记数后以每孔4×103密度接种于96孔细胞培养板中,每孔加入200μL培养液,24h后各组分别加入相应的药物:紫杉醇组加入1μmol·L-1紫杉醇,RHL组加入100μmol·L-1RHL,紫杉醇联合 RHL组加入1μmol·L-1紫杉醇和100μmol·L-1RHL,实验设无细胞对照孔和无药对照孔各3孔,空白组无细胞、无药物,对照组有细胞,但无药物。继续培养48h,每组至少3个平行孔。实验结束前加入5g·L-1MTT 20μL,继续培养4h后小心吸去上清液,加入二甲基亚砜150mL,振荡溶解结晶后用酶标仪(Thermo Labsystems公司,Multiskan MK3)于570nm处测定每个孔的吸光度(A570)值。按下面公式计算细胞的增殖率:细胞增殖率 =(加药组A570值-空白组A570值)/(对照组 A570值-空白组 A570值)×100%。实验重复3次。
1.3 Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率 取对数生长期细胞3mL,按每孔5×104接种于6孔板,24h后各组分别加入相应的药物:紫杉醇组加入1μmol·L-1紫杉醇,RHL组加入100μmol·L-1RHL,紫杉醇联合RHL组加入1μmol·L-1紫杉醇和100μmol·L-1RHL,对照组不加药物,继续培养48h,收集细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,将待测细胞数调整为(5~10)×108L-1,取1mL细胞于4℃、1 000r·min-1离心10min,弃上清液,PBS洗涤,将细胞重悬于binding buffer 300μL,加入 Annexin V/FITC 10μL,轻轻摇匀,室温反应1h,加入PI 5μL轻轻摇匀,室温反应15min,细胞经200目尼龙网过滤后,采用流式细胞术进行检测,结果以细胞凋亡率表示。
1.4 蛋白质提取及 Western blotting检测 分别收集1μmol·L-1紫杉醇组、100μmol·L-1RHL组、1μmol·L-1紫杉醇和100μmol·L-1RHL联合用药组作用48h和未加药处理的H460细胞,用预冷的1×PBS洗3遍,加入新鲜配制的细胞裂解液(50mmol·L-1Tris-HCl,pH 7.5;1%NP-40;150mmol·L-1NaCl;1mmol·L-1Na3VO4;1mmol·L-1NaF,使用前加入3种蛋白酶抑制剂:1% 抑蛋白酶肽、10g·L-1亮抑酶肽和1mmol·L-1苯甲基磺酰氟)100μL,细胞与裂解液充分混合,冰浴20min。于4℃、13 000r·min-1离心15min,收集上清液于新的微量离心管中,采用BCA法测定蛋白表达水平。取各样品等量总蛋白30μg加入0.25倍体积的5×上样缓冲液,煮沸变性5min后,在10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)胶上进行电泳。电泳后转移到硝酸纤维素膜上,1%BSA封闭1h,一抗4℃孵育过夜后,加相应二抗孵育2h,膜上滴加化学发光增强剂(Santa Cruz biotechnology SC-2048),按照试剂盒说明进行操作,结果在凝胶成像仪上照相并使用Bio-Rad公司Quantity One分析软件测量条带灰度值,目的条带与β-actin条带灰度值比值即为该目的蛋白的相对表达量。
1.5 统计学分析 采用SPSS 13.0统计软件进行统计学分析,各组细胞增殖率、细胞凋亡率以(±s)%表示,组间比较采用单因素方差分析。
2 结 果
2.1 紫杉醇和RHL单独或联合作用后细胞增殖率 H460细胞给药48h后,紫杉醇联合RHL组细胞增殖率明显低于紫杉醇组和RHL组(P<0.05);紫杉醇和RHL单独用药组细胞增殖率低于对照组(P<0.05)。紫杉醇和RHL联合用药组细胞增殖抑制作用明显高于紫杉醇和RHL单药组。见表1。
表1 各组H460细胞增殖率Tab.1 The proliferation rates of H460cells in various groups [n=3,(±s)/%]

表1 各组H460细胞增殖率Tab.1 The proliferation rates of H460cells in various groups [n=3,(±s)/%]
*P<0.05 vs control group;△P<0.05 vs RHL group;#P<0.05 vs taxol group.
Group Cell proliferation rate Control 100.0±0.0 Taxol 54.2±3.3*RHL 54.9±3.8*Taxol combined with RHL 11.8±1.2*△#
2.2 紫杉醇和RHL单独或联合作用后细胞凋亡率 紫杉醇组和RHL组的细胞凋亡率分别为18.9%±1.3%和21.1%±1.6%,与对照组的凋亡率(3.1%±0.6%)比较差异有统计学意义(P<0.05),紫杉醇联合RHL组细胞凋亡率为53.3%±1.9% ,与紫杉醇和RHL单独用药组凋亡率比较差异有统计学意义(P<0.05)。见图1。
2.3 Western blotting法检测紫杉醇和RHL单独或联合作用细胞后凋亡相关蛋白的表达强度 紫杉醇联 合 RHL 组 poly ADP-ribose polymerase(PARP)和caspase-3的切割片段蛋白表达强度高于紫杉醇组和RHL组,而紫杉醇联合RHL组Bcl-2和NF-κB的表达强度低于紫杉醇组和RHL组。见图2。

图1 各组H460细胞凋亡率检测流式细胞图Fig.1 Flow cytometry graph of apoptotic rates detection of H460cells in various groups
2.4 Western blotting法检测紫杉醇和RHL单独或联合作用细胞后MEK和ERK蛋白的表达强度紫杉醇组磷酸化MEK和ERK蛋白表达强度高于对照组,RHL组磷酸化的MEK和ERK蛋白表达强度与对照组比较无明显变化,而紫杉醇联合RHL组磷酸化的MEK和ERK的表达强度明显低于单独应用紫杉醇组。见图3。
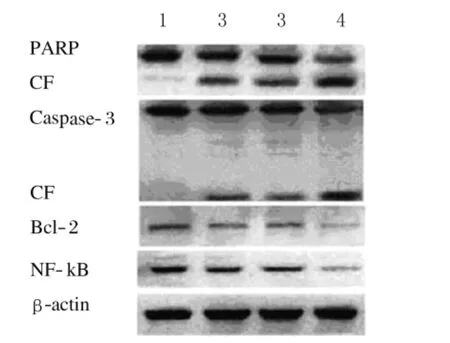
图2 Western blotting法检测H460细胞中凋亡相关蛋白表达电泳图Fig.2 Electrophoregram of expressions of apoptosis-related proteins of H460cells detected by Western blotting method
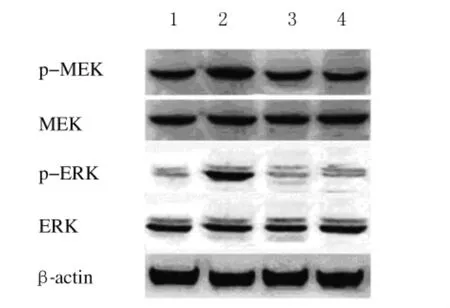
图3 Western blotting法检测H460细胞中MEK和ERK蛋白表达电泳图Fig.3 Electrophoregram of expressions of MEK and ERK proteins in H460cells detected by Western blotting method Lane 1:Control group;Lane 2:Taxol group;Lane 3:RHL group;Lane 4:Taxol combined with RHL group.
3 讨 论
肺癌是对人类威胁最大的恶性肿瘤之一,已位居我国恶性肿瘤死亡率第1位,在许多国家也是首位的癌症致死原因,其发病率和病死率均呈上升趋势。化疗在肺癌的综合治疗中占据着重要的地位。紫杉醇作为肺癌化疗中常用药物,虽有一定的效果,但仍不够理想,而且其对正常组织的毒性又常常导致患者不能长期坚持用药,故寻找高效低毒的肿瘤化疗增敏剂以增强紫杉醇的化疗效果,改善患者的生存率成为研究热点。
大黄酸是许多中药 (尤其是大黄)的主要有效成分,可抑制多种肿瘤细胞增殖,并诱导其凋亡,具有广泛的生物学活性[1-3]。对大黄酸进行结构改造获得了水溶性较高的RHL。本研究结果显示:紫杉醇和RHL均能抑制肺癌H460细胞增殖并诱导其凋亡,但两药联合后增殖抑制作用和凋亡诱导作用显著高于单用紫杉醇或RHL。
细胞发生凋亡的过程中,caspases家族蛋白酶在凋亡信号传导中起着关键性的作用。为了保持凋亡程序的正常进行,caspases在细胞中最初是以前体形式存在的。当起始caspases(initiator caspases)如caspase-8和caspase-9通过形成寡聚体被激活后,就可以发挥切割效应caspases(effector caspases) 如 caspase-3、caspase-6 和caspase-7[4-6]。激活的效应caspases反过来又可以切割一系列特异的细胞底物,caspases最主要的底物是PARP,该酶与DNA修复、基因完整性监护有关。在细胞凋亡启动时,相对分子质量为116 000的PARP被剪切成2个相对分子质量为31 000和85 000片段,结果使受PARP负调控影响的核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡。本研究结果显示:两药联合进一步增加了H460细胞caspase-3和PARP的切割片段蛋白表达强度,因此可以推断RHL能够通过调控caspases家族增强紫杉醇对H460细胞的凋亡诱导作用。另外,为了进一步探讨两药联合的分子机制,本研究还观察了Bcl-2和NF-κB蛋白表达强度的变化,两药联合显著下调了Bcl-2和NF-κB蛋白的表达水平。
NF-κB是一种与肿瘤生成有关的生存因子,其活化会使肿瘤细胞最终对凋亡产生抗性[7-10]。Bcl-2是一种抗凋亡蛋白,可以通过与Bax形成异源二聚体而起到抗凋亡作用,研究[9,11]认为:Bax与Bcl-2的表达比例决定细胞的生存与凋亡。同时RHL还能降低紫杉醇上调的MEK和ERK蛋白磷酸化强度。ERK的激活有利于细胞生存,也是肿瘤耐药的常见原因[12-16]。
综上所述,RHL能够通过抑制紫杉醇对MEK和ERK的激活增强紫杉醇对肺癌细胞增殖和凋亡诱导作用,提示RHL不仅自身有抗肺癌作用,而且还可以增强紫杉醇对肺癌H460细胞的杀伤作用和凋亡诱导作用,减少毒副作用。进一步研究RHL和紫杉醇两者联合治疗肺癌的作用机制和作用途径,可能为肺癌的综合治疗提供新思路、新线索和新方法。
[1]Lai WW,Yang JS,Lai KC,et al.Rhein induced apoptosis through the endoplasmic reticulum stress,caspase-and mitochondria-dependent pathways in SCC-4human tongue squamous cancer cells [J].In Vivo,2009,23 (2):309-316.
[2]Ip SW,Weng YS,Lin SY,et al.The role of Ca2+on rheininduced apoptosis in human cervical cancer CaSki cells[J].Anticancer Res,2007,27 (1A):379-389.
[3]Lin ML,Chen SS,Lu YC,et al.Rhein induces apoptosis through induction of endoplasmic reticulum stress and Ca2+-dependent mitochondrial death pathway in human nasopharyngeal carcinoma cells[J].Anticancer Res Nat Rev Drug Discov,2007,27 (5A):3313-3322.
[4]Enari M,Sakahira H,Yokoyama H,et al.A caspaseactivated DNase that degrades DNA during apoptosis,and its inhibitor ICAD[J].Nature,1998,391 (6662):43-50.
[5]Fiandalo MV,Kyprianou N.Caspase control:protagonists of cancer cell apoptosis[J].Exp Oncol,2012,34 (3):165-175.
[6]Fan TJ,Han LH,Cong RS,et al.Caspase family proteases and apoptosis [J]. Acta Acta Biochim Biophys Sin(Shanghai),2005,37 (11):719-727.
[7]Sohma I,Fujiwara Y,Sugita Y,et al.Parthenolide,an NF-κB inhibitor,suppresses tumor growth and enhances response to chemotherapy in gastric cancer [J]. Cancer Genom Proteom,2011,8 (1):39-47.
[8]Hayashi S,Sakurai H,Hayashi A,et al.Inhibition of NF-kappaB by combination therapy with parthenolide and hyperthermia and kinetics of apoptosis induction and cell cycle arrest in human lung adenocarcinoma cells [J].Int J Mol Med,2010,25 (1):81-87.
[9]Wang Y,Wang X,Zhao H,et al.Clusterin confers resistance to TNF-alpha-induced apoptosis in breast cancer cells through NF-kappaB activation and Bcl-2 overexpression[J].J Chemother,2012,24 (6):348-357.
[10]Yu JA,Kalatardi S,Dohse J,et al.Group IIa sPLA2 inhibition attenuates NF-κB activity and promotes apoptosis of lung cancer cells[J].Anticancer Res,2012,32 (9):3601-3607.
[11]刘 安 恒,曹 亚 南,张 卫 卫,等.DIDS 对 Bcl-2/Bax 在staurosporine诱导心肌细胞凋亡中表达的影响 [J].中国药理学通报,2009,25 (1):47-50.
[12]Ozaki K,Kosugi M,Baba N,et al.Blockade of the ERK or PI3K-Akt signaling pathway enhances the cytotoxicity of histone deacetylase inhibitors in tumor cells resistant to gefitinib or imatinib [J].Biochem Biophys Res Commun,2010,391 (4):1610-1615.
[13]Ko JC,Su YJ,Lin ST,et al.Emodin enhances cisplatininduced cytotoxicity via down-regulation of ERCC1and inactivation of ERK1/2 [J].Lung Cancer,2010,69 (2):155-164.
[14]Pelaia G,Gallelli L,Renda T,et al.Effects of statins and farnesyl transferase inhibitors on ERK phosphorylation,apoptosis and cell viability in non-small lung cancer cells[J].Cell Prolif,2012,45 (6):557-565.
[15]Sancho P,Galeano E,Estañ MC,et al.Raf/MEK/ERK signaling inhibition enhances the ability of dequalinium to induce apoptosis in the human leukemic cell line K562 [J].Exp Biol Med(Maywood),2012,237 (8):933-942.
[16]付军科,吴齐飞,张 勇.靶向下调FoxM1基因表达对肺癌细胞侵袭能力的影响 [J].西安交通大学学报:医学版,2013,34 (1):64-67.
Inhibitory effects on proliferation and induction of apoptosis of lung cancer cells of rhein lysinate and taxol
ZHEN Yong-zhan1,LIN Ya-jun2,ZHANG Guang-ling1,LIN Xiao-hu3,WANG Mei-mei2,LI Ran1,WEI Jing-bo1
(1.Department of Histology and Embryology,College of Basic Medicine,Hebei United University,Tangshan 063000,China;2.Beijing Hospital &Beijing Institute of Geriatrics,Ministry of Health,Beijing 100730,China;3.Department of Thoracic Surgery,People’s Hospital of Qianxi County,Tangshan 064300,China)
Objective To investigate the effects of rhein lysinate(RHL),taxol and their combination on the proliferation and apoptosis of lung cancer H460cells,and to clarify their mechanisms.Methods The lung cancer H460cells in logarithm growth phase were selected and randomly divided into control group(adding no drug),taxol group(1μmol·L-1taxol),RHL group(100μmol·L-1RHL)and taxol combined with RHL group;at the same time,blank control group was set up.MTT assay was used to detect the proliferation of H460cells and flow cytometry method was used to analyze the apoptotic rates in various groups 48hafter treatment.The expression levels of apoptosis-related proteins and MEK/ERK proteins were detected by Western blotting method.Results After culture for 48h,the cell proliferation rate in taxol combined with RHL group was lower than those in control,taxol,and RHL groups(P<0.05);the apoptotic rate in taxol combined with RHL group was higher than those in control,taxol,and RHL groups(P<0.05);the expressions of caspase-3and poly ADP-ribose polymerase(PARP)fragment protein in taxol combined with RHL group were higher than those in control,taxol,and RHL groups;whereas the expressions of Bcl-2and NF-κB proteins were lower than those in control,taxol,and RHL groups.Moreover,the phosphorylation levels of MEK and ERK proteins up-regulated by taxol in RHL group were decreased.Conclusion Both taxol and RHL can inhibit cell proliferation and induce apoptosis of lung cancer H460cells,and RHL can enhance the taxol-induced cytotoxicity and apoptosis by reducing the activity of ERK and increasing the expression levels of caspase-3and PARP fragment protein.
rhein lysinate;taxol;lung cancer;apoptosis;combination therapy
R734.2
A
1671-587Ⅹ(2013)03-0432-05
10.7694/jldxyxb20130302
2012-12-19
国家自然科学基金资助课题 (81001439);河北省自然科学基金资助课题 (H2012401030)
甄永占 (1970-),女,河北省唐山市人,副教授,医学博士,主要从事肿瘤分子药理学研究。
林雅军 (Tel:010-58115040,E-mail:linyajun2000@126.com)
