索拉菲尼、PDTC联用对胰腺癌细胞株PANC-1的作用研究
2013-06-09刘国忠石铮郭回希
刘国忠石铮郭回希
1.福建医科大学附属第一医院肝胆胰外科,福建 福州 350005;
2.福建医科大学附属第一医院消化内科,福建 福州 350005
索拉菲尼、PDTC联用对胰腺癌细胞株PANC-1的作用研究
刘国忠1石铮1郭回希2
1.福建医科大学附属第一医院肝胆胰外科,福建 福州 350005;
2.福建医科大学附属第一医院消化内科,福建 福州 350005
背景与目的:多分子靶向药物索拉菲尼(sorafenib)可抑制多种肿瘤细胞增殖并诱导其凋亡,具有广泛生物学活性,但单药治疗胰腺癌效果较差,可能与肿瘤中核转录因子-κB(nuclearfactor-kappa B,NF-κB)通路激活有关,因此有必要寻求联合NF-κB活化抑制剂吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)以提高疗效。本研究观测索拉菲尼联合PDTC对体外人胰腺癌细胞株PANC-1的细胞增殖、细胞周期的影响及其对细胞质中NF-κB表达的影响,并探讨其可能的作用机制。方法:以单药不同浓度的索拉菲尼(1.5、3.0、6.0、12.0 µmol/L)、PDTC(10.0、25.0、50.0、100.0 µmol/L)及低浓度联合用药(3.0 µmol/L索拉菲尼+25.0 µmol/L PDTC)进行分组,在用药后24、36、48、72 h,MTT法检测各组对胰腺癌细胞株PANC-1细胞增殖的抑制作用并分别计算出细胞半数抑制浓度(IC50);在用药后48 h,流式细胞仪检测各组药物对细胞周期的影响;在用药后48 h,免疫细胞化学方法观察各药物组NF-κB在细胞中表达水平的变化。结果:索拉菲尼和PDTC均能显著抑制胰腺癌细胞株PANC-1的增殖,但单药IC50值较高,低浓度联合用药组能显著提高细胞生长抑制率(P<0.05)。索拉菲尼、PDTC及低浓度联合用药组细胞均发生G0/G1期停滞(P<0.05),S期细胞减少,低浓度联合用药组效果优于单药组(P<0.05)。索拉菲尼诱导NF-κB在胰腺癌PANC-1细胞内表达明显增强,低浓度联合用药组诱导后胰腺癌PANC-1细胞中NF-κB的表达明显减弱(P<0.05)。结论:索拉菲尼和PDTC在体外对PANC-1细胞增殖均具有抑制作用,但单药效果不佳。PDTC和索拉菲尼联合应用能明显提高胰腺癌细胞株PANC-1细胞的生长抑制率,并使细胞发生G0/G1期停滞,其原因可能是PDTC通过抑制NF-κB活化,增强PANC-1细胞对索拉菲尼的敏感性。
索拉菲尼;吡咯烷二硫代氨基甲酸盐;细胞增殖;细胞周期;核转录因子-κB
胰腺癌目前是临床较常见的恶性肿瘤之一,已成为全球癌症相关死亡的第4大原因[1-2]。外科切除是可能治愈该病的唯一手段,但预后不佳。因此,如何更有效地治疗胰腺癌成为近年来医学研究和探讨的热点。
近年来的研究发现,多分子靶向药物索拉菲尼(sorafenib)可抑制实体性肿瘤的生长[3-4],但在抑制胰腺癌的过程中缺乏有效性,其原因可能与肿瘤中核转录因子-κB(nuclearfactorkappa B,NF-κB)通路激活有关[5]。吡咯烷二硫代氨基甲酸盐(pyrrolidinedithiocarbamate,PDTC)是一种可以通透细胞膜的NF-κB活化抑制剂,可以在多种细胞中抑制NF-κB的激活。本研究通过体外细胞实验,分别使用不同浓度索拉菲尼、PDTC及两药低浓度联合用药,观察其对胰腺癌细胞株PANC-1生长增殖及细胞周期的影响,探讨索拉菲尼对胰腺癌细胞株PANC-1的NF-κB通路的激活及PDTC对索拉菲尼激活的NF-κB信号通路的抑制作用,为胰腺癌的预防和治疗提供理论依据。
1 材料和方法
1.1 细胞与试剂
索拉菲尼购自拜耳公司,剂型为每片200 mg,用100%DMSO溶解,-20 ℃保存,实验时稀释,DMSO终浓度<0.5%。PDTC购自美国Sigma公司,用RPMI1640培养液调整浓度配制成为2 mmol/L备用,实验时再稀释。MTT购自美国Sigma公司,用PBS配制成浓度为5 mg/mL。兔抗人NF-κB多克隆抗体购自武汉博士德公司。SP免疫细胞化学检测试剂盒购自北京中杉金桥生物公司。胰腺癌细胞系PANC-1购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 细胞培养
胰腺癌PANC-1细胞在37 ℃,CO2体积分数为5%的培养箱中培养,培养液为含10%新生牛血清的RPMI-1640,取对数生长期细胞用于实验。
1.3 MTT法检测各药物组对胰腺癌PANC-1细胞的增殖抑制作用
取对数期生长的PANC-1细胞,以5.0×103/L密度接种于8个96孔板培养24 h后分别加入药物进行实验。
索拉菲尼浓度分别为1.5、3.0、6.0、12.0 μmol/L,每种浓度设5个复孔,另设空白对照组(未加药的培养液)。加药后分别培养24、36、48、72 h。
PDTC药物浓度分别为10、25、50、100 μmol/L,每种浓度设5个复孔,其中设空白对照组(未加药的培养液)。加药后分别培养24、36、48、72 h。
干预药物工作液分别为3.0 μmol/L索拉菲尼、25 μmol/L PDTC、3.0 μmol/L索拉菲尼+25 μmol/L PDTC,每种浓度设5个复孔,另设空白对照组(未加药的培养液)。加药后培养24 h。
进行上述实验后,每孔加MTT(5 mg/mL) 20 mL,继续培养4 h,吸去原培养液,加入DMS0 150 μL/孔,振荡10 min,用酶标仪(波长490 nm)测定每个孔的A值,计算细胞抑制率。抑制率(%)=( A对照组-A实验组)/ A对照组×100%。
1.4 流式细胞仪检测细胞周期
收集不同浓度药物(3.0 μmol/L索拉菲尼、25.0 μmol/L PDTC、3.0 μmol/L索拉菲尼+25.0 μmol/L PDTC,另设空白对照组)处理48 h的细胞,常规胰酶消化后,制成单细胞悬液,离心弃上清液,再经预冷的PBS缓冲液冲洗2次,依次加入20 mg/mL的核糖核酸酶10 μL及1 mg/mL碘化丙碇400 μL染色后流式细胞仪分析固定的样品。实验重复3次。
1.5 细胞免疫化学组化法检测NF-κB蛋白表达
将对数生长期的胰腺癌PANC-1细胞接种于含盖玻片的6孔板内,常规培养24 h后,加入不同药物浓度(3.0 μmol/L索拉菲尼、25.0 μmol/L PDTC、3.0 μmol/L索拉菲尼+25.0 μmol/L PDTC)后培养,设空白对照组(不含药物的培养液),常规培养48 h后,取出玻片,PBS缓冲液冲洗数次,4 ℃预冷的丙酮固定15 min备用。P-ERK免疫细胞化学染色,操作按试剂盒说明书进行。判断标准:将不同浓度处理组重复40次,每1张玻片置于光学显微镜下随机计测1 000个细胞(独立高倍视野)中阳性细胞数,用GATALICA等的半定量分析方法,即对每1张切片的阳性细胞率及阳性细胞着色强度分别进行分级计分,然后根据2向乘积确定其阳性强度。将染色强度分为4级:无染色为0分,弱染色1分,中等染色2分,强染色3分,阳性细胞百分率:<5%为0分,5%~25%为1分,26%~75%为2分,>75%为3分;然后进行组织评分H=I×P,0~1分为-(阴性),2~3分为+(弱阳性),4~6分为++(阳性),>6分为+++(强阳性)。本研究以++和+++记为阳性数据,以-和+记为阴性数据。
1.6 统计学处理
2 结 果
2.1 药物处理前后细胞形态的变化
光镜下观察发现,空白对照组的细胞呈形态各异,可呈椭圆形及类圆形,核大而圆,核质比增大,达1∶1~2∶1,核内核仁1~3个;药物处理组的细胞大小趋于均匀,形态趋于规则,核浆比例降低,增殖分裂减慢,部分细胞可见凋亡与坏死的现象,细胞数量和增殖速度明显低于空白对照组(图1、2)。
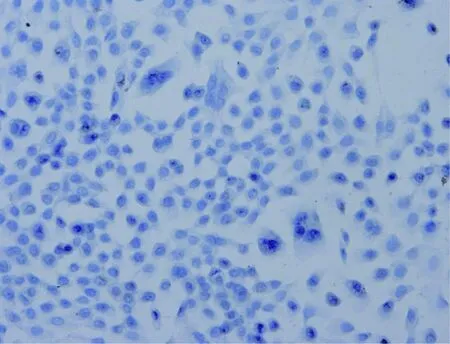
图 1 空白对照组细胞形态Fig.1 Blank control group in cell morphology (×400)

图 2 药物处理组细胞形态Fig.2 Drug treatment group of cell morphology (×400)
2.2 MTT法检测各药物组对细胞的增殖抑制作用
2.2.1 MTT法检测索拉菲尼对胰腺癌PANC-1细胞增殖的影响
实验和统计结果显示,与空白对照组相比,索拉菲尼可以抑制胰腺癌PANC-1细胞的增殖,同时呈时间和浓度依赖性,在相同的药物浓度下,随着作用时间(24、36、48、72 h)的延长,索拉菲尼对人胰腺癌PANC-1细胞的生长抑制作用逐渐增强,差异有统计学意义(P<0.05);在相同的干预时间,随着药物浓度(1.5、3.0、6.0、12.0 μmol/L)的增加,索拉菲尼对人胰腺癌PANC-1细胞的生长抑制作用也逐渐增强,差异有统计学意义(P<0.05)。以Probit Analysis计算48 h细胞的半数抑制浓度(IC50)为14.102 μmol/L,浓度值较高,说明抑制并不理想(表1)。
2.2.2 MTT法检测PDTC对胰腺癌PANC-1细胞增殖的影响
实验和统计结果显示,与空白对照组相比,PDTC可以抑制胰腺癌PANC-1细胞的增殖,同时呈时间和浓度依赖性,在相同的药物浓度下,随着作用时间(24、36、48、72 h)的延长,PDTC对人胰腺癌PANC-1细胞的生长抑制作用逐渐增强,差异有统计学意义(P<0.05);在相同的干预时间,随着药物浓度(10.0、25.0、50.0、100.0 μmol/L)的增加,PDTC对人胰腺癌PANC-1细胞的生长抑制作用也逐渐增强,差异有统计学意义(P<0.05)。以Probit Analysis计算48 h细胞的IC50为105.717 μmol/L,浓度值较高,说明抑制并不理想(表2)。

表 1 不同浓度索拉菲尼及不同作用时间对胰腺癌PANC-1细胞增殖抑制率的影响Tab. 1 Effects of different concentrations and action time of sorafenib on PANC-1 cells of pancreatic cancer proliferation

表 2 不同浓度 PDTC 及不同作用时间对胰腺癌PANC-1细胞增殖抑制率的影响Tab. 2 Effects of different concentrations and action time of PDTC on PANC-1 cells of pancreatic cancer proliferation
2.2.3 联合应用 PDTC 和索拉菲尼对胰腺癌PANC-1细胞增殖的影响
实验和统计结果显示,联合药物组(3.0 μmol/L索拉菲尼+25.0 μmol/L PDTC)应用48 h后,对胰腺癌PANC-1细胞生长抑制率达(82.092±1.325)%,明显优于空白对照组的(6.093±0.307)%、索拉菲尼单药组(3.0 μmol/L索拉菲尼)的(30.345±0.591)%及PDTC单药组(25.0 μmol/L PDTC)的(6.093±0.307)%,差异有统计学意义(P<0.05)。
2.3 流式细胞仪检测各组药物对细胞周期的影响
实验和统计结果显示,与空白对照组相比,3.0 μmol/L索拉菲尼和25.0 μmol/LPDTC处理48 h后PANC-1细胞的G0/G1期百分比升高,分别为(50.93±3.51)%和(48.07±1.70)%,而空白对照组为(37.97±1.21)%,差异有统计学意义(P<0.05);S期细胞数百分比减少,分别为(37.30±1.70)%和(38.17±0.51)%,而空白对照组为(45.33±2.03)%,差异有统计学意义(P<0.05),提示索拉菲尼及PDTC处理组细胞发生G0/G1期停滞。而联合药物组处理48 h后PANC-1细胞的G0/G1期百分比升高至(74.07±2.40)%,S期细胞数减少,百分比降低至(22.23±1.68)%,与空白对照组及单药组差异均有显著统计学意义(P<0.01);同时联合药物组G2/M期减少了(4.70±1.54)%,与空白对照组的(16.70±1.32)%相比明显增加,差异有统计学意义(P<0.05),提示联合药物组对细胞周期的抑制作用强于空白对照组及单药组(图3、4)。

图 3 各药物组对PANC-1细胞周期的影响Fig. 3 Effects of different groups on PANC-1 cells cycles

图 4 各药物组PANC-1细胞周期图Fig. 4 Diagram of different groups PANC-1 cells cycle
2.4 免疫组化法检测各组药物对细胞内NF-κB表达水平的影响
免疫组化检测结果显示,在胰腺癌PANC-1细胞中,NF-κB主要表达于细胞质,染成棕褐色,而细胞核内也可见棕褐色颗粒,阳性表达率为40.0%;经25.0 μmol/L PDTC作用48 h后,细胞核及细胞质内棕褐色变浅,阳性表达率下降为10.0%;经3.0 μmol/L索拉菲尼作用48 h后,细胞核及细胞质内棕褐色明显加深,阳性表达率上升为62.5%;若经两药联合作用48 h后,细胞核及细胞质内棕褐色再次变浅,阳性表达率为17.5%,提示NF-κB在细胞质及细胞核的表达较3.0 μmol/L索拉菲尼明显下降。空白对照组及药物处理组间的两两比较,差异均有统计学意义(P<0.05)。以上结果进一步证实索拉菲尼能激活胰腺癌PANC-1细胞中NF-κB表达,而PDTC恰好能抑制此作用(表3,图5)。

表 3 药物组作用48 h后的胰腺癌PANC-1细胞NF-κB的表达Tab. 3 Expression of NF- κB on PANC-1 cells of pancreatic cancer after different drugs action 48 h
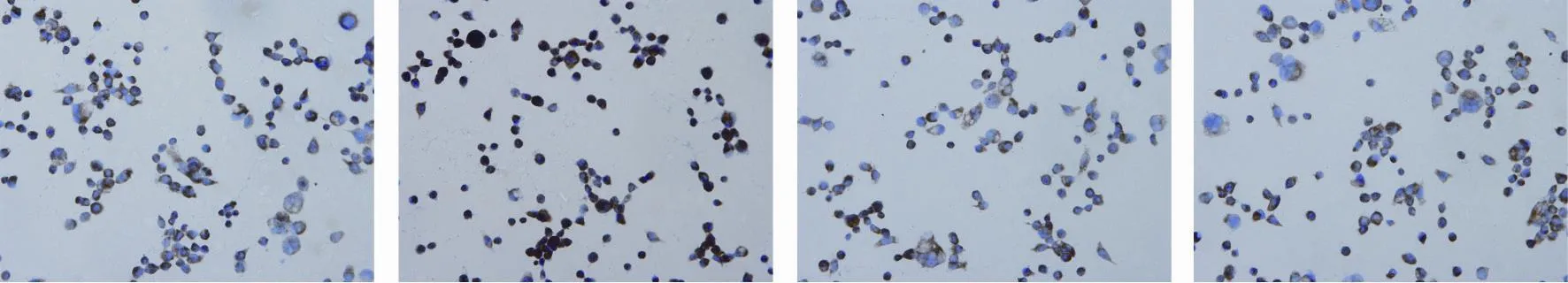
图 5 各药物组作用48 h后NF-κB表达情况Fig. 5 Expression of NF- κ B after different drugs action 48 h
3 讨 论
胰腺癌是临床较常见的恶性肿瘤之一,其总体预后较差[1-2]。因此,如何更有效地治疗胰腺癌成为困扰众多学者的问题。近年来,使用多分子靶向药物治疗恶性肿瘤逐渐成为研究的热点。然而,单一的分子靶向药物在临床治疗中经常效果不佳,主要原因是对肿瘤细胞生长增殖的“信号通路”轴缺乏足够的抑制以及可以代偿性激活某些通路如NF-κB,进一步促进肿瘤细胞增殖[6-7],从而缺乏对肿瘤的强有效抑制。因此,寻找一些药物联合分子靶向药物以协同抑制肿瘤细胞生长增殖,将成为一个更有效的策略。
本研究中的分子靶向药物索拉菲尼属于多酶抑制剂,一方面可以抑制受体酪氨酸激酶KIT和FLT-3以及Raf/MEK/ERK途径中丝氨酸/苏氨酸激酶,明显抑制肿瘤细胞增殖;另一方面,通过上游抑制受体酪氨酸激酶VEGFR和PDGFR及下游抑制Raf/MEK/ERK途径中丝氨酸/苏氨酸激酶,明显抑制肿瘤血管生成[3]。我们的研究结果也证实了这一点,1.5~12.0 μmol/L浓度的索拉菲尼可以对胰腺癌PANC-1细胞的增殖具有抑制作用,并呈现的剂量和时间双效应;这也同索拉菲尼在治疗其他肿瘤中具有一定疗效相一致[3,8]。PDTC在其他肿瘤中可以发挥抑制肿瘤细胞生长的作用[9],本研究中得以证实10~100 μmol/L浓度的PDTC对胰腺癌PANC-1细胞的增殖具有抑制作用。但无论是索拉菲尼还是PDTC,其单药的细胞的IC50均较高,说明单药抑制肿瘤细胞增殖并不理想,这在诸多研究中得到证实,主要原因是代偿性激活某些通路如NF-κB[6-7],所以本研究采用索拉菲尼联合PDTC进行后续实验。而两药联合作用48 h后对胰腺癌PANC-1细胞生长抑制作用,优于索拉菲尼、PDTC单药组和空白对照组,进一步证实联合用药更加有效。此外,本研究结果提示,NF-κB在胰腺癌PANC-1细胞内有表达,阳性表达率为40.0%,经3.0 μmol/L索拉菲尼、25.0 μmol/L PDTC及两者联合作用48 h后,其阳性表达率分别为62.5%、10.0%、17.5%,这说明索拉菲尼能激活人胰腺癌PANC-1细胞中NF-κB蛋白表达的作用,而PDTC恰好能抑制此作用。
综上所述,索拉菲尼及PDTC均能在体外抑制胰腺癌PANC-1细胞株的增殖,但需要较高的有效浓度。索拉菲尼在对胰腺癌细胞株作用过程中会激活NF-κB通路,这可能使胰腺癌细胞的凋亡减少,从而造成胰腺癌细胞对索拉菲尼的敏感性降低。而PDTC能够减少NF-κB活化,抑制NF-κB的抗凋亡作用,从而增加胰腺癌细胞对索拉菲尼的敏感性。
此外,本研究发现,相同浓度下索拉菲尼和PDTC联用能提高索拉菲尼的抑制作用,这表明在胰腺癌治疗中,低剂量PDTC抑制NF-κB活性,然后联合低浓度的索拉菲尼,不仅能取得良好的抗癌效果,而且也增强了索拉菲尼的杀伤作用,提高化疗效果和减轻化疗药物造成的不良反应。这对胰腺癌的临床治疗有一定的理论意义。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] FERLAY J, PARKIN D M, STELIAROVA-FOUCHER E. Estimates of cancer incidence and mortality in Europe in 2008[J]. Eur J Cancer, 2010, 46(4): 765-781.
[3] WILHELM S M, CARTER C, TANG L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64(19): 7099-7109.
[4] DOWNWARD J. Targeting RAS signalling pathways in cancer therapy[J]. Nat Rev Cancer, 2003, 3(1): 11-22.
[5] KANE R C, FARRELL A T, SABER H, et al. Sorafenib for the treatment of advanced renal cell carcinoma[J]. Clin Cancer Res, 2006, 12(24): 7271-7278.
[6] HAUSENLOY D J, MOCANU M M, YELLON D M. Crosstalk between the survival kinases during early reperfusion: its contribution to ischemic preconditioning[J]. Cardiovasc Res, 2004, 63(2): 305-312.
[7] NAEGELE S, MORLEY S J. Molecular cross-talk between MEK1/2 and mTOR signaling during recovery of 293 cells from hypertonic stress[J]. J Biol Chem, 2004, 279(44): 46023-46034.
[8] NOGUCHI R, YOSHIJI H, IKENAKA Y, et al. Synergistic inhibitory effect of gemcitabine and angiotensin type-1 receptor blocker, losartan, on murine pancreatic tumor growth via anti-angiogenic activities[J]. Oncol Rep, 2009, 22(2): 355-360.
[9] MATSUO Y, SAWAI H, OCHI N, et al. Proteasome inhibitor MG132 inhibits angiogenesis in pancreatic cancer by blocking NF-kappaB activity[J]. Dig Dis Sci, 2010, 55(4): 1167-1176.
Interactions sorafenib of and pyrrolidine dithiocarbamate in pancreatic cancer cells
LIU Guo-zhong1, SHI Zheng1, GUO Hui-xi2(1.Department of Hepatopancreatobiliary and Laparoscopic Minimally Invasive Surgery, the First Affiliated Hospital of Fujian Medical University, Fuzhou Fujian 350004, China; 2. Department of Gastroenterology, the First Affiliated Hospital of Fujian Medical University, Fuzhou Fujian 350004, China)
LIU Guo-zhong E-mail: lgzpt2002@163.com
Background and purpose: Sorafenib, a multiple targeted agent, can inhibit proliferation and induce apoptosis of diverse tumor cell in vitro. It has extensive biological activities, but the pancreatic cancer effect of monotherapy is poor. This may be related to nuclear factor-kappa B (NF-κB) pathway activation in cancer. Therefore, it is necessary to combine with Pyrrolidinedithiocarbamate (PDTC, a NF-κB activation inhibitor) to enhance curative effect. To investigate the influences of cell proliferation, cell cycle and expression of NF-κB via their acting on human pancreatic cancer PANC-1, and explore their possible mechanism. Methods: The experiment groups were divided into sorafenib group with different concentrations (1.5, 3.0, 6.0, 12.0 µmol/L), PDTC group with different concentrations (10.0, 25.0, 50.0, 100.0 µmol/L) and combination group with low concentration (3.0 µmol/L sorafenib +25.0 µmol/L PDTC). The proliferative activity of PANC-1 of each group was measured by MTT assay at different time points of 24,36, 48 and 72 h, and the half inhibitory concentration (IC50) was calculated, respectively. Cell cycle in each group was detected by flow cytometry instrument after 48 h. The changes of NF-κB expression level in each group were observed by immunocytochemistry after 24 h. Results: Sorafenib and PDTC can significantly inhibit the proliferation of PANC-1, but IC50value of the single medicine was higher, combination group with low concentration can significantly increase the cell growth inhibition rate (P<0.05). Three groups can induce the cell stagnation at G0/G1phase (P<0.05) and cells at S phase were decreased. The effect of combination group with low concentration was better than the single drug group (P<0.05). The NF-κB expression level in sorafenib group was significantly enhanced, while the level in combination group was significantly decreased (P<0.05). Conclusion: Sorafenib and PDTC can significantly inhibit the growth of human pancreatic cancer PANC-1 cells in vitro, but the effect of one drug is unsatisfactory. PDTC combined with sorafenib significantly improve the inhibition rate of the proliferation of human pancreatic cancer PANC-1, and induce the cell stagnation at G0/G1phase. This may relate to inhibit the activation of NF-κB by PDTC and enhance the sensitivity of PANC-1 cells to sorafenib.
Sorafenib; Pyrrolidinedithiocarbamate; Cell proliferation; Cell cycle; NF-κB
10.3969/j.issn.1007-3969.2013.06.005
R735.9
:A
:1007-3639(2013)06-0425-07
2013-03-13
2013-05-27)
《上海医学影像》杂志正式更名为《肿瘤影像学》
福建省卫生厅青年科研课题基金(No:2011-1-21)。
刘国忠 E-mail:lgzpt2002@163.com
2013年3月20日,《上海医学影像》杂志接到上海市新闻出版局文件(沪新出报[2013]31号),正式批准《上海医学影像》杂志更名为《肿瘤影像学》。新编国内统一连续出版物号为CN31-2087/R。办刊宗旨为:贯彻理论与实践、普及与提高相结合的方针,反映肿瘤影像学临床应用和科研工作成果,增进国内外肿瘤影像学学术交流,提高我国肿瘤影像学诊断技术和治疗水平。更名后的《肿瘤影像学》杂志将在2013年6月28日正式出刊,并将按上海市新闻出版局及总署的要求,不断地扩大肿瘤影像学科领域的学术交流水平和提高本领域的学术影响力,将《肿瘤影像学》杂志办得更好、更强!希望大家继续支持我们,并踊跃投稿!
