miR-216a通过靶向调控蛋白激酶Cα抑制胶质瘤细胞增殖和侵袭
2013-06-09
湘南病理研究所,湘南学院免疫学院级重点学科,湖南 郴州 423000
miR-216a通过靶向调控蛋白激酶Cα抑制胶质瘤细胞增殖和侵袭
赵文健 杨亮 唐伟军
湘南病理研究所,湘南学院免疫学院级重点学科,湖南 郴州 423000
背景与目的:MicroRNAs是一类19~25 bp内源非编码的小分子RNA,其通过靶向抑制基因的转录和翻译水平。本研究旨在明确miR-216a是否通过靶向调控蛋白激酶Cα(PRKCA)表达而抑制胶质瘤细胞增殖和侵袭能力,从而进一步揭示miR-216a的抑瘤分子机制。方法:首先构建PRKCA 3’UTR-荧光素酶报告载体,通过双荧光素酶报告检测观察miR-216a对PRKCA 3’UTR-荧光素酶活性的影响;将miR-216a mimics转染胶质瘤细胞U251,采用Western blot检测PRKCA蛋白表达水平;将PRKCA siRNA转染U251细胞,通过MTS细胞增殖活性检测和transwell侵袭实验观察PRKCA下调对U251细胞增殖和侵袭的影响。结果:双荧光素酶报告检测显示,miR-216a能特异性地与PRKCA mRNA的3’UTR结合,抑制其荧光素酶活性,下调41%。过表达miR-216a的U251细胞PRKCA蛋白表达水平降低。siRNA干扰PRKCA表达能抑制U251细胞的增殖和侵袭,它能部分模拟miR-216a的抑瘤功能。结论:miR-216a通过靶向PRKCA mRNA 3’UTR而抑制胶质瘤细胞增殖和侵袭。
胶质瘤;miR-216a;蛋白激酶Cα;细胞增殖;侵袭
近年来,miRNA成为分子生物学研究热点,人类miRNA通过调控其靶基因的表达及相关信号通路,具有类似于瘤基因或抑瘤基因的功能,在肿瘤的发生、发展和转归过程中发挥重要作用。研究表明,miR-216a在乳腺癌、肝癌、前列腺癌等多种肿瘤中表达下调[1-6]。miR-216a可通过靶向CD44和CDC42抑制乳腺癌的生长与侵袭[1]。但miR-216a在胶质瘤中的表达报道较少。蛋白激酶Cα(PRKCA)与肿瘤基因的不稳定性和肿瘤细胞的增殖、抗凋亡、侵袭、药物抵抗有关[7-8],在肿瘤发生、发展中起着重要作用。本研究通过采用生物信息学靶基因预测、荧光素酶报告活性检测、Western blot等分子生物学技术,证实了miR-216a可通过靶向调控PRKCA抑制胶质瘤细胞增殖和侵袭,进一步揭示了miR-216a的抑瘤分子机制。
1 材料和方法
1.1 主要材料
T4DNA连接酶、SpeⅠ和HindⅢ限制性内切酶均为大连宝生物公司产品。miR-216a mimics为Ambion公司产品。PRKCA siRNA由Invitorgen公司合成,序列为:5’-GGGATCGAACAACAAGGAA-3’。双荧光素酶活性检测试剂盒购自Promega公司。PRKCA单克隆抗体和GAPDH抗体购自Epigentek公司。DMEM培养基为Hyclone公司产品。胎牛血清购自杭州四季青公司。MTS细胞增殖/毒性检测试剂盒购自美国Promega公司。铺有基质胶的Transwell侵袭小室购自BD Biosciences公司。
1.2 野生型PRKCA 3’UTR-荧光素酶报告载体的构建
通过Targetscan、Pictar、miRase软件预测出miR-216a可能与PRKCA mRNA的3’UTR片段1 319~1 325 bp结合。根据PRKCA 3’UTR序列设计末端带SpeⅠ和HindⅢ酶切位点的特异性引物。引物序列为:F:5’-AGAACTAGTGAGTGTTGGGTGAATCTG-3’;R:5’-GTCAAGCTTCTATCACGTAAACTAGCC-3’(带下划线的为酶切位点)。
以健康志愿者血细胞DNA为模板(郴州市第一人民医院体检中心),PCR扩增PRKCA 3’UTR部分片段(635~1 515 bp)。将PCR产物与pMIRREPORT luciferase报告载体分别用Spe Ⅰ和Hind Ⅲ双酶切后纯化,连接,转化,鉴定。构建野生型PRKCA 3’UTR-荧光素酶载体,命名为PRKCA-Wt。突变型PRKCA 3’UTR-荧光素酶报告载体构建由Invitrogen公司合成,命名为pPRKCA-Mut。
1.3 荧光素酶活性检测
将荧光素酶报告载体与miR-216a mimics或scramble 共转染U251细胞(人胶质瘤细胞系,购自于上海生化与细胞研究所)。以转染pRL-TK作为标准内质控。转染36 h后,收获细胞。按Promega公司双荧光素酶活性检测试剂盒说明书在单光子检测仪检测细胞荧光素酶活性。计算相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.4 Western blot检测
将miR-216a mimics 或scramble转染U251细胞,48 h后提取细胞总蛋白,BCA法测定蛋白浓度。取等量样本,进行SDS-PAGE凝胶电泳分离,然后将蛋白转移至PVDF膜上,1% BSA封闭后,加入PRKCA抗体或GAPDH抗体,4 ℃过夜。TBST洗膜10 min,加入二抗室温温育1 h,TBST洗膜10 min,加入ECL发光剂、X片曝光、显影、定影。
1.5 MTS法检测细胞增殖活性[9]
取转染后的U251细胞,消化后接种细胞于96孔板中,每组设6个平行复孔,放37 ℃、CO2体积分数为5%培养箱中培养。在未接种细胞的孔中加入DMEM培养基中作为调零孔。接种后24、48、72 h各检测1次。检测时每孔加20 μL MTS检测试剂,37 ℃温育2 h,用酶标仪测定570 nm波长吸光度值(A570)。实验重复3次。
1.6 Transwell细胞侵袭实验
先将铺有基质胶的Transwell板预热至37 ℃。消化PRKCA siRNA 或miR-216a mimics转染的U251细胞,用无血清培养基洗涤2次,再用无血清培养基重悬细胞,细胞计数,调整细胞数为1×105/mL。在Transwell下室加入800 μL含15% FCS的培养基。在Transwell上室加入250 μL细胞悬液,37 ℃培养48 h。取出Transwell,擦掉靠上室侧膜的细胞,PBS洗后将Transwell用4%甲醛溶液中固定10 min,结晶紫染色,显微镜下观察、照相,随机选取5个高倍视野(×100)进行细胞计数,并计算平均值。实验重复3次[10]。
1.7 统计学处理
所有数据采用SPSS 13.0统计学软件进行处理。结果均以表示。两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-216a对PRKCA mRNA的3’UTR的荧光酶活性的影响
为明确miR-216a能否结合PRKCA 3’UTR,将miR-216a mimics或scramble与pPRKCA-Wt、PRKCA-Mut共转染到U251细胞中。以转染pRLTK作为内参照。双荧光酶活性检测结果显示,miR-216a mimics明显抑制野生型PRKCA-Wt报告载体的荧光素酶活性,下调41%(P<0.05);而miR-216a mimics对突变型PRKCA-Mut载体的荧光素酶活性无明显抑制作用(图1)。这些结果表明miR-216a能特异性与PRKCA mRNA的3’UTR结合。
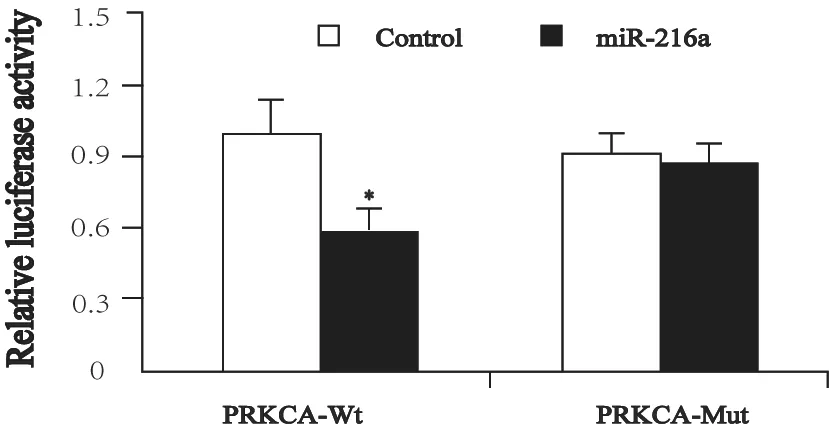
图 1 miR-216a抑制PRKCA mRNA的3’UTR的荧光酶活性Fig. 1 miR-216a inhibits the luciferase activity of PRKCA mRNA
2.2 miR-216a对PRKCA蛋白表达的影响
将miR-216a mimics转染胶质瘤U251细胞48 h后,以转染scramble为阴性对照,转染PRKCA siRNA为阳性对照。通过Western blot检测PRKCA蛋白表达水平。Western blot检测结果显示,转染miR-216a组PRKCA蛋白表达较scramble组明显降低(图2)。该结果提示,在胶质瘤中miR-216a能下调PRKCA蛋白的表达。
2.3 PRKCA siRNA或miR-216a对胶质瘤细胞增殖和侵袭的影响
将miR-216a mimics转染胶质瘤U251细胞,以转染scramble为阴性对照,通过MTS法检测细胞增殖活性。结果发现,过表达miR-216a的U251细胞从48 h起增殖速度明显减慢,与scramble对照细胞相比,差异有统计学意义(P<0.05,图3),同时Transwell细胞侵袭实验后取出Transwell固定,结晶紫染色,显微摄影,计数任意5个显微视野的穿过基底膜的细胞数进行统计分析,过表达miR-216a的U251细胞较对照细胞侵袭能力明显降低(P<0.05,图4)。同理将PRKCA siRNA转染到U251中48 h后,结果提示干扰PRKCA能显著抑制胶质瘤U251细胞的增殖,与scramble对照细胞相比,差异有统计学意义(P<0.05,图3)。Transwell细胞侵袭结果显示,干扰PRKCA的U251细胞较对照细胞侵袭能力明显降低(P<0.05,图4)。这些结果表明,干扰PRKCA能抑制胶质瘤细胞增殖和侵袭,它能部分模拟miR-216a的抑瘤功能。此外,miR-216a抑制U251细胞增殖和侵袭的强度要大于PRKCA siRNA,可能与除了PRKCA这个靶点外,miR-216a还能通过调控其他的靶基因抑制胶质瘤细胞增殖和侵袭有关。
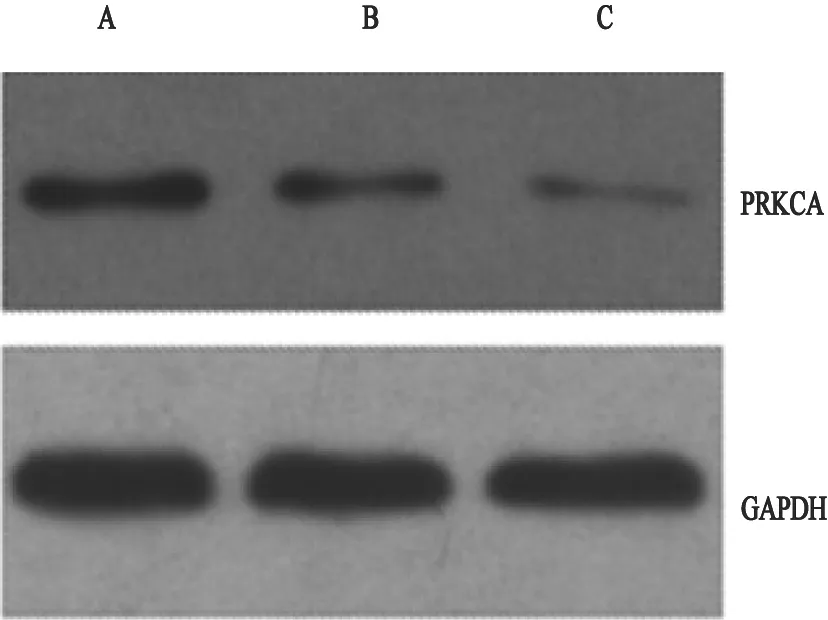
图 2 Western blot检测miR-216a对PRKCA蛋白表达的改变Fig. 2 miR-216a inhibits the expression of PRKCA protein detected by Western blot assay

图 3 PRKCA siRNA或miR-216a抑制U251细胞增殖Fig. 3 PRKCA siRNA or miR-216a inhibits the proliferation of U251 cells
3 讨 论

图 4 Transwell细胞侵袭实验检测过表达miR-216a或干扰PRKCA表达对U251细胞侵袭的影响Fig. 4 Overexpression of miR-216a or PRKCA siRNA inhibits the invasion of U251 cells by Transwell assay (×100)
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,WHO分类系统将其分为Ⅰ、Ⅱ、Ⅲ和Ⅳ级,治愈率低,生存期短,其中胶质母细胞瘤的5年生存率<5%,平均生存期仅14个月[11]。因此,亟待发现新的治疗靶点和早期诊断标志。目前研究表明,脑胶质瘤的发生不仅受基因变异的影响,也存在表观遗传学改变。microRNA是目前生命科学研究的热点,在脑胶质瘤的发生发展、转移等方面发挥着重要作用[12-13]。PKC是存在于细胞浆内由钙活化的磷脂依赖性丝/苏氨酸蛋白激酶家族,广泛参与调节生命过程中的许多生物学事件,如转录调节,免疫介导,学习与记忆,受体脱敏,细胞生长、分化、增殖、癌变及凋亡过程[14-15]。至今已从不同种属的器官中分离、纯化出12种不同的PKC亚型。本研究证实了PRKCA是miR-216a调控的直接靶基因。并且也通过siRNA干扰实验证实了下调PRKCA表达确实能抑制胶质瘤细胞的增殖和侵袭,它能部分模拟miR-216a的抑瘤功能。结合以往PKC在肿瘤中的研究成果,说明miR-216a可通过靶向调控PRKCA表达抑制胶质瘤细胞增殖和侵袭,这进一步揭示了miR-216a的抑瘤分子机制。
综上所述,miRNA作为瘤基因或抑瘤基因功能的发现,为肿瘤病因及发病机制的研究提供了新思路,也为肿瘤预防、诊断、预后判断提供了新策略[16]。继续深入miR-216a在胶质瘤中的研究,阐明miR-216a参与胶质瘤发生、发展的分子机制,可为胶质瘤的防治提供理论依据和实验基础。
[1] JEYAPALAN Z, DENG Z, SHATSEVA T, et al. Expression of CD44 3’untranslated region regulates endogenous microRNA functions in tumorigenesis and angiogenesis [J]. Nucleic Acids Res, 2011, 39(8): 3026-3041.
[2] 侯宝华, 简志祥, 崔鹏, 等. miR-216a在胰腺癌组织中的表达及临床意义[J]. 南方医科大学学报, 2012, 32(11): 1628-1631.
[3] LINK A, BECKER V, GOEL A, et al. Feasibility of fecal microRNAs as novel biomarkers for pancreatic cancer [J]. PLoS One, 2012, 7(8): e42933.
[4] CHEN P J, YEH S H, LIU W H, et al. Androgen pathway stimulates microRNA-216a transcription to suppress the tumor suppressor in lung cancer-1 gene in early hepatocarcinogenesis [J]. Hepatology, 2012, 56(2): 632-643.
[5] ALI S, BANERJEE S, LOGNA F, et al. Inactivation of Ink4a/ Arf leads to deregulated expression of miRNAs in K-Ras transgenic mouse model of pancreatic cancer [J]. J Cell Physiol, 2012, 227(10): 3373-3380.
[6] YU J, LI A, HONG S M, et al. MicroRNA alterations of pancreatic intraepithelial neoplasias [J]. Clin Cancer Res, 2012, 18(4): 981-992.
[7] KANG J H, TOITA R, KIM C W, et al. Protein kinase C (PKC) isozyme-specific substrates and their design [J]. Biotechnol Adv, 2012, 30(6): 1662-1672.
[8] HANAUSKE A R, SUNDELL K, LAHN M. The role of protein kinase C-alpha (PKC-α) in cancer and its modulation by the novel PKC-α-specific inhibitor aprinocarsen [J]. Curr Pharm Des, 2004, 10: 1923-1936.
[9] TANG H, LIU X, WANG Z, et al. Interaction of hsa-miR-381 and glioma suppressor LRRC4 is involved in glioma growth[J]. Brain Res, 2011, 1390: 21-32.
[10] TANG H, BIAN Y, TU C, et al. The miR-183/96/182 cluster centralizes to regulate oxidative apoptosis and sensitizes cells to chemotherapy in gliomas [J]. Current Cancer Drug Targets, 2013, 13(2): 221-231.
[11] KURASHIGE J, KAMOHARA H, WATANABE M, et al. MicroRNA-200b regulates cell proliferation, invasion, and migration by directly targeting ZEB2 in gastric carcinoma[J]. Ann Surg Oncol, 2012, 3: 656-664.
[12] STUPP R, MASON W P, VAN DEN BENT M J, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma [J]. N Engl J Med, 2005, 352(10): 987-996.
[13] CORSTEN M F, MIRANDA R, KASMIEH R, et al. MicroRNA-21 knockdown disrupts glioma growth in vivo and displays synergistic cytotoxicity with neural precursor celldelivered s-trail in human gliomas [J]. Cancer Res, 2007, 67(19): 8994-9000.
[14] LI Y, GUESSOUS F, ZHANG Y, et al. MicroRNA-34a inhibits glioblastoma growth by targeting multiple oncogenes[J]. Cancer Res, 2009, 69(19): 7569-7576.
[15] RUAN B F, ZHU H L. The chemistry and biology of the bryostatins: potential PKC inhibitors in clinical development[J]. Curr Med Chem, 2012, 19: 2652-2664.
[16] 刘伏香, 谭志琴, 龙丹, 等. miR-155在子宫内膜癌组织中的表达及临床意义[J]. 中国癌症杂志, 2011, 21(9): 684-687.
《抗癌》杂志2013年征订启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会。《抗癌》杂志是供癌症患者及其家属阅读的公益性科普期刊,树立了为科研服务的思想意识,坚持以读者为导向,架起读者和医院之间的桥梁。杂志刊号:CN31-1664/R ISSN 1008-3065。欢迎广大读者订阅。
杂志为季刊,每期48页。本刊季末出版,每期5元,全年共20元整。征订方式请通过邮局汇款。
通讯地址:上海市东安路270号6号楼3楼《抗癌》杂志社收。
邮 编:200032
电 话:021-64043766
传 真:021-64043766
电子邮件:anti-cancer@163.com
miR-216a suppresses cell proliferation and invasion by targeting PRKCA in glioma
ZHAO Wen-jian, YANG Liang, TANG Wei-jun (Xiangnan Institute of Pathology, Xiangnan Key Discipline of Immunology, Hunan Chenzhou, 423000)
TANG Wei-jun E-mail: zwjyl_1613@163.com
Background and purpose: MicroRNAs are 19–25-nucleotide noncoding RNA molecules that regulate gene expression at the level of transcription and translation. The study aimed to confirm whether miR-216a suppresses cell proliferation and invasion by targeting PRKCA, thus to reveal molecular mechanism that miR-216a functions as a tumor suppressor in glioma. Methods: PRKCA 3’ untranslated region (UTR)-luciferase vector was constructed and dual-luciferase reporter gene assay was employed to examine the effect of miR-216a on luciferase activity. U251 cells were transfected with miR-216a mimics, and next Western blotting was performed to detect the expression of PRKCA protein. The effects of PRKCA downregulation on cell proliferation and invasion were observed after PRKCA siRNA was transfected into U251 cells. U251 cell proliferation assays were performed when cotransfected with miR-216a mimics. Results: The result demonstrated miR-216a could bind to the 3’UTR of PRKCA and inhibited the luciferase activity by 41%. PRKCA protein expressions were significantly down-regulated when miR-216a was overexpressed in U251. siRNA-mediated downregulation of PRKCA could suppress the potentials of cell proliferation and invasion. Conclusion: miR-216a suppresses cell proliferation and invasion by targeting PRKCA in glioma.
Glioma; miR-216a; PRKCA; Cell proliferation; Cell invasion
10.3969/j.issn.1007-3969.2013.06.004
R739.41
:A
:1007-3639(2013)06-0420-05
2013-01-24
2013-04-25)
湘南学院重点建设学科基金资助(No: xnu125kd019)。
唐伟军 E-mail:zwjyl_1613@163.com
