Ezrin蛋白在宫颈癌中表达的临床意义及其与PCNA、MMP-2、MMP-9、HPV E6蛋白的关系
2013-06-09奚美丽李俊鹿欣
奚美丽李俊鹿欣
1复旦大学附属妇产科医院妇科,上海 200011;
2上海市女性生殖内分泌相关疾病重点实验室,上海 200011
Ezrin蛋白在宫颈癌中表达的临床意义及其与PCNA、MMP-2、MMP-9、HPV E6蛋白的关系
奚美丽1,2李俊1,2鹿欣1,2
1复旦大学附属妇产科医院妇科,上海 200011;
2上海市女性生殖内分泌相关疾病重点实验室,上海 200011
背景与目的:大量研究表明,Ezrin蛋白在很多肿瘤组织中都有异常表达,参与细胞的多种生物学行为,如细胞黏附、迁移、生存等,在肿瘤的发生、发展过程中扮演重要的角色。本研究旨在分析Ezrin蛋白在正常宫颈组织和宫颈癌组织中的表达差异及与临床病理因素、PCNA、MMP-2、MMP-9、HPV E6蛋白之间的相互关系。方法:收集2002年1月—2006年12月在复旦大学附属妇产科医院妇科诊断为宫颈癌的30例患者的组织标本,并进行回顾性研究。同时收集正常宫颈组织来自子宫肌瘤且经病理证实无任何宫颈病变的10例组织标本作为对照。应用免疫组织化学方法检测宫颈癌组织和正常宫颈组织中Ezrin、PCNA、MMP-2、MMP-9、HPV E6蛋白表达,并分析Ezrin表达与PCNA、MMP-2、MMP-9、HPV E6蛋白表达的关系。结果:Ezrin蛋白在宫颈癌组织中表达呈中强阳性,且主要弥散分布在细胞质和细胞膜处,而正常宫颈组织Ezrin蛋白表达呈弱阳性,且主要分布在细胞膜处,差异有统计学意义(P<0.05)。Ezrin蛋白在宫颈组织中的表达与MMP-2、MMP-9和HPV E6蛋白在宫颈组织中的表达呈正相关,与PCNA表达无关。Ezrin蛋白表达与年龄、肿瘤大小、病理类型、组织分化程度、临床分期等关系差异无统计学意义(P>0.05)。结论:Ezrin在宫颈癌组织中高表达,可能参与宫颈癌侵袭转移。
埃兹蛋白;宫颈癌;转移;浸润
宫颈癌是女性生殖系统最常见的恶性肿瘤,严重威胁妇女的生命。世界上每年大约有52.9万的宫颈癌新发病例,其中85%发生在发展中国家[1]。我国每年有新发病例约13.2万,占世界宫颈癌新发病例的1/3。近年来,随着开展细胞学-阴道镜-组织学三阶梯筛查,宫颈癌的发病率显著下降,死亡率也随之降低。但近20年来宫颈癌发病率呈增高趋势,患者年轻化明显,而且直接浸润和淋巴结转移仍是造成预后不良及患者死亡的主要原因之一。然而宫颈癌的侵袭转移机制有待进一步阐明。
Ezrin蛋白是ERM(Ezrin/Radixin/Moesin)蛋白家族的重要一员, 连接细胞骨架与细胞膜, 从结构和功能上调控细胞膜区域的整合和稳定性。Ezrin蛋白维持微绒毛的形成及细胞形态、参与细胞运动及黏附过程、参与细胞骨架的重塑及细胞信号转导过程。Ezrin为近年在肿瘤侵袭和转移研究中的相关蛋白,大量研究表明,该蛋白在很多肿瘤组织中都有异常表达,并与促肿瘤转移有关。Ezrin蛋白在宫颈癌中异常表达,可能参与宫颈癌的发生、发展和侵袭转移的过程,目前国内外对Ezrin蛋白在宫颈癌中的作用研究较少,尤其是其与PCNA、MMP-2、MMP-9、HPV E6蛋白表达关系鲜见报道。为了阐明Ezrin蛋白在宫颈癌中的作用,本研究对2002年1月—2006年12月我院诊断为宫颈癌的30例患者进行回顾性研究。
1 材料和方法
1.1 一般资料
经复旦大学附属妇产科医院伦理委员会批准及患者本人知情同意:选取从2002年1月—2006年12月经手术及病理确诊为宫颈癌的患者的临床病理资料,共30例(宫颈癌组);同时收集因子宫肌瘤行全子宫切除术且术后病理证实无宫颈病变的组织标本,共10例(对照组)。将上述组织标本连续切片。宫颈癌组年龄28~76岁,平均(47.5±8.8)岁。对照组年龄42~58岁,平均(47.1±9.3)岁。宫颈癌患者临床表现:15例阴道不规则流血,12例接触性出血,2例阴道排液增多,1例体检发现宫颈病变;临床分期:I期9例,Ⅱ期20例,Ⅲ期1例。病理类型:21例为鳞状细胞癌,7例为腺癌,2例为腺鳞癌。治疗方式:17例手术治疗,10例手术联合辅助化疗,2例手术联合放疗,1例手术联合放化疗。
1.2 主要试剂
兔抗人Ezrin单克隆抗体(工作浓度1∶250)、兔抗人PCNA多克隆抗体(工作浓度l∶800)、山羊抗人MMP-2、MMP-9多克隆抗体(工作浓度l∶50)、兔抗人HPV E6抗体(工作浓度l∶50),均购自上海优宁维生物技术有限公司。
1.3 方法
术中取新鲜癌组织和正常宫颈组织,置4%甲醛溶液中固定,石蜡包埋,4 μm连续切片,常规脱蜡、水化,之后的操作按SP试剂盒说明书进行,DAB显色,一抗工作浓度如上述,空白对照:PBS液代替一抗;阳性对照:已知阳性表达的乳腺癌组织切片。
1.4 结果判定
免疫组化阳性染色为出现明显的黄色或棕黄色颗粒。Ezrin、MMP-2、MMP-9蛋白的阳性细胞为细胞质或细胞膜内出现黄色或棕黄色颗粒。PCNA、HPV E6蛋白的阳性细胞为细胞核内出现黄色或棕黄色颗粒。采用半定量积分法判断结果。高倍镜观察:染色强度黄色计1分,棕黄色计2分,棕褐色计3分;阳性细胞数≤10%计0分,11%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;阳性细胞数和染色强度得分相乘,0分即阴性(-),l~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.5 统计学处理
所有数据均使用软件包SPSS 17.0进行处理。统计学分析采用χ2检验、Spearman相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Ezrin蛋白在不同宫颈组织中的表达
光镜下可见Ezrin免疫阳性反应产物沿细胞膜内侧线性分布,呈棕黄色颗粒状,在细胞质内也有着色。对照组中3例呈阴性表达,7例呈弱阳性表达。宫颈癌组中2例呈阴性表达,8例呈弱阳性表达,15例呈中阳性表达,5例呈强阳性表达。Ezrin蛋白在宫颈癌中的强阳性表达率明显高于正常宫颈组织(图1,表1)。
2.2 Ezrin蛋白表达与宫颈癌临床病理因素之间的关系
宫颈癌中Ezrin蛋白表达与年龄、病理分期、病理类型和组织学分级无关,差异无统计学意义(P>0.05,表2)。
2.3 MMP-2、MMP-9、PCNA蛋白在正常宫颈组织和宫颈癌组织中的表达及与Ezrin蛋白的关系
光镜观察可见,宫颈癌组织中MMP-2,MMP-9主要表达在细胞质中,PCNA表达在细胞核中,三者在正常宫颈组织中表达较弱(图2)。
Ezrin蛋白与MMP-2、MMP-9均呈正相关,分别为(r=0.317,P=0.025;r=0.494,P=0.01),但Ezrin蛋白与PCNA表达不相关(r=0.237,P=0.073)。
2.4 HPV E6蛋白在正常宫颈组织和宫颈癌组织中的表达及与Ezrin蛋白的关系
光镜观察可见,HPV E6蛋白主要表达在细胞核中。正常宫颈组织中不表达HPV E6蛋白。Ezrin蛋白与HPV E6蛋白呈正相关(r=0.539;P=0.000,图3)。
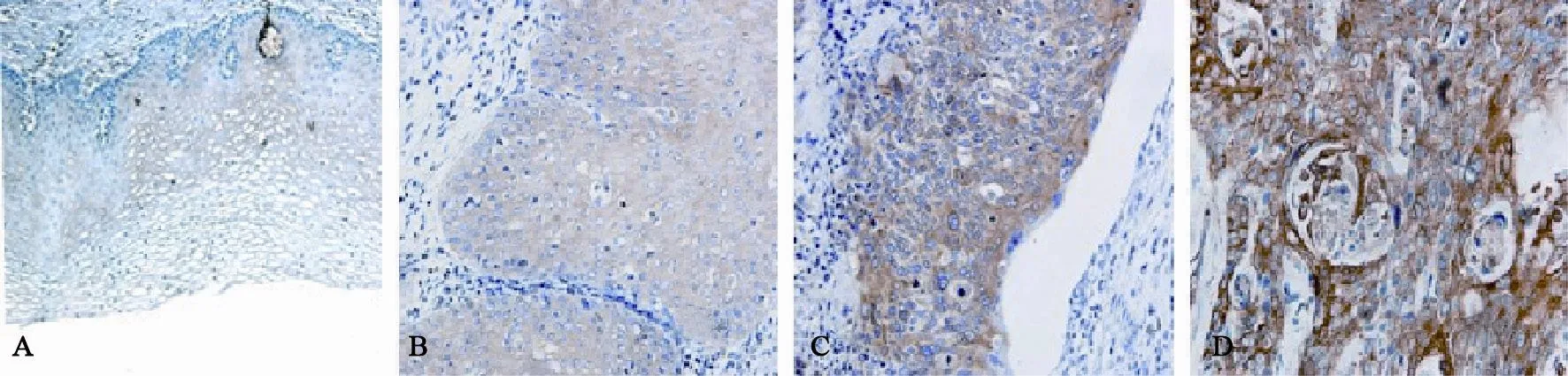
图 1 Ezrin蛋白在正常宫颈组织和宫颈癌组织中的表达Fig. 1 Ezrin immunoreactivity in benign cervical tissues and cervical cancer tissues
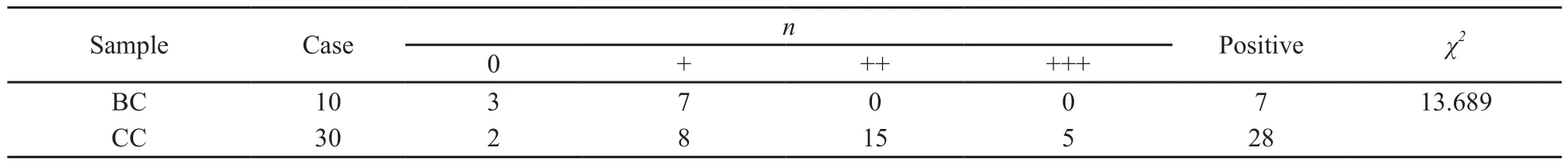
表 1 Ezrin蛋白在正常宫颈组织和宫颈癌组织中的表达Tab. 1 Ezrin immunoreactivity in benign cervical tissues and cervical cancer tissues
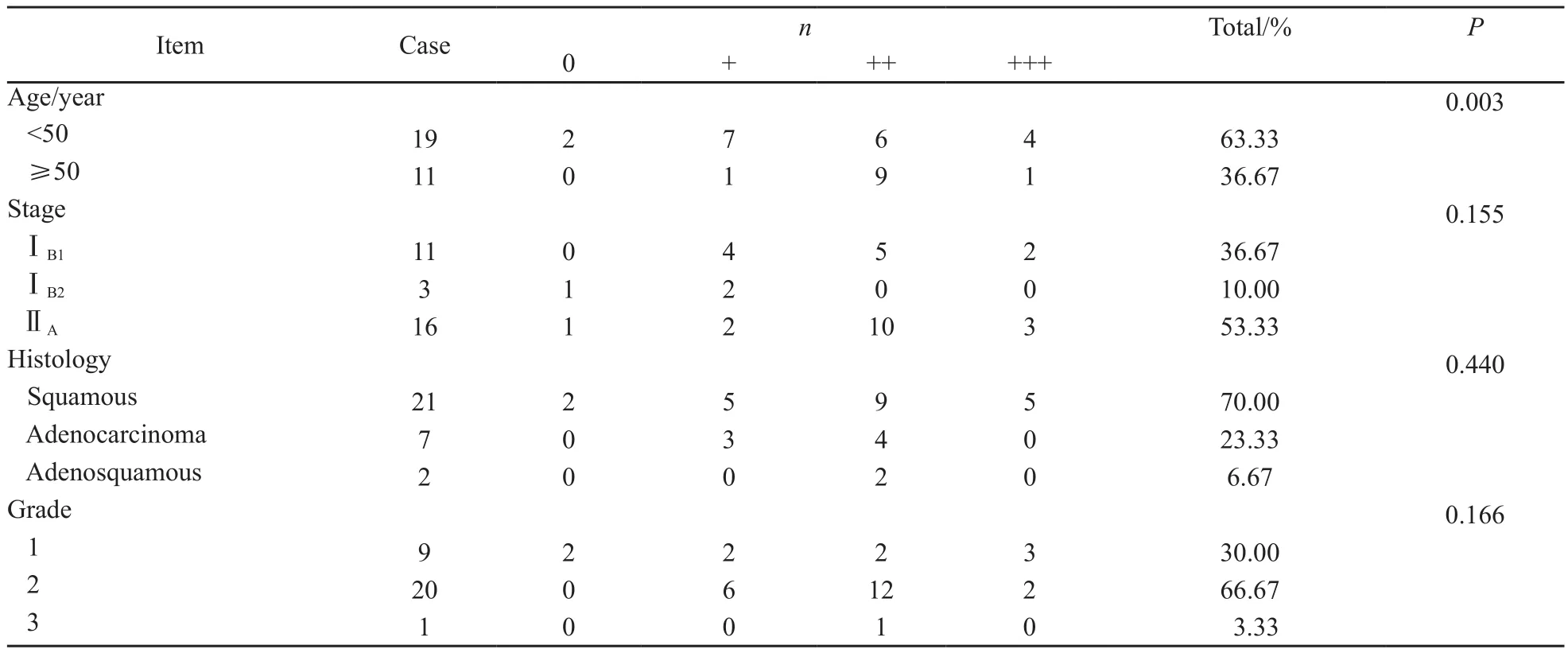
表 2 Ezrin蛋白的表达和宫颈癌临床病理因素之间的关系Tab. 2 The association of Ezrin expression with the clinical characteristics

图 2 MMP-2、MMP-9、PCNA蛋白在正常宫颈组织和宫颈癌组织中的表达Fig. 2 Association of Ezrin expression with MMP-2,MMP-9, HPV, PCNA expression
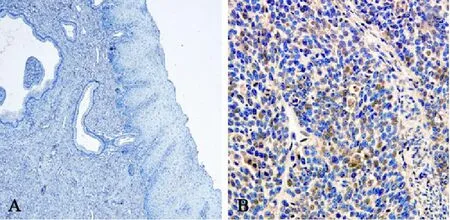
图 3 HPV E6蛋白在正常宫颈组织和宫颈癌组织中的表达Fig. 3 HPV E6 immunoreactivity in benign cervical tissues and cervical cancer tissues
3 讨 论
Ezrin是一种在肿瘤细胞侵袭转移中的作用尚未完全阐明的细胞骨架与细胞膜之间的连接蛋白,在肿瘤细胞中的表达异常,提示其在肿瘤的浸润、转移机制中发挥重要作用。本研究用免疫组织化学方法检测正常宫颈及宫颈癌组织中Ezrin蛋白的表达。结果发现在宫颈癌组织中Ezrin蛋白的表达水平高于对照组(P<0.05)。正常宫颈组织中Ezrin蛋白呈阴性或弱阳性表达,而在宫颈癌组织中Ezrin蛋白呈高表达,细胞质阳性率为76.7%。
另外,本研究观察到Ezrin蛋白在肿瘤及非肿瘤组织中的定位有差异,在宫颈癌中弥漫分布,定位于细胞膜和细胞质,在正常宫颈组织中则表达于细胞膜上。Wald等[2]研究发现,Ezrin主要在细胞微绒毛尤其是极性细胞的顶端表达,这一亚细胞分布特点构成了细胞各项生理功能的结构基础,推测Ezrin 的分布异常将导致细胞结构、生理功能发生改变进而参与肿瘤的发生。这一现象在其他肿瘤中也有发现,Ezrin在子宫内膜不典型增生组织中定位于胞质, 而在子宫内膜腺癌中定位于细胞膜和细胞质,在转移灶中则表达于细胞膜[3]。因此对于Ezrin蛋白定位的差异是否与肿瘤的发生和转移有关,需要对各种不同组织来源肿瘤做进一步的研究和分析。
Ezrin在多种肿瘤中存在高表达,但在宫颈癌组织中研究较少。朱彦等[4]采用免疫组化法检测50例宫颈癌组织及50例癌旁正常上皮中Ezrin蛋白的表达,发现Ezrin蛋白高表达与宫颈癌的分化、浸润和淋巴结转移有关。江忠清[5]等也采用免疫组织化学法检测28例正常宫颈上皮、36例宫颈上皮内瘤变和68例宫颈癌中Ezrin蛋白的表达,发现存在高危因素:FIGO 分期Ⅱ期、伴有盆腔淋巴结转移、深肌层浸润、脉管浸润,较Ⅰ期、无盆腔淋巴结转移、浅肌层浸润、无脉管浸润的表达增高。本研究结果显示,虽然宫颈癌组织中Ezrin的阳性表达率较正常宫颈组织高,但与宫颈癌癌患者年龄、肿瘤大小、病理类型、组织分化程度、临床分期等相关性不显著。虽然各学者对于Ezrin蛋白在宫颈癌浸润、转移过程中的作用得出不同结论,但是都认为Ezrin在宫颈癌中的表达强于正常组织。临床各参数间关系有待大样本论证。
Ezrin在多种肿瘤中存在差异表达已经得到广泛认可,近年来,有关Ezrin参与肿瘤转移机制的研究增多,如上游调控机制、参与信号通路、相关转移相关分子等。上游调控机制方面:Yu等[6]研究Six(骨骼肌发展所需转录因子同源区的蛋白)是一种能够结合Ezrin基因启动子并调控其转录的转录因子。另外有研究发现,miR-183在乳腺癌中可以下调Ezrin的表达,编码Ezrin的VIL2基因是miR-183的靶基因[7-8]。Yu等[9]研究发现高转移性横纹肌肉瘤的细胞中Ezrin三甲基H3-K4、乙酰-H3-K9升高,但Ezrin基因启动子的DNA甲基化降低。有意思的是,组蛋白去乙酰化酶(HDAC)抑制剂或DNA甲基化药物治疗可以增加Ezrin表达,刺激低转移性RMS细胞转移潜能增强;参与信号通路反面:HGF刺激后Ezrin在下游通路中的作用已经被证实,突变Ezrin活化位点,HGF信号通路被抑制,证明Ezrin在HGF刺激后的信号传递中起作用[10]。在乳腺癌研究中,17β-雌二醇与雌激素受体结合,与非受体酪氨酸激酶相互作用,进一步激活小G蛋白RhoA蛋白/Rho相关激酶(ROCK)通路,提高乳腺癌细胞的侵袭能力,干扰Ezrin基因表达,乳腺癌细胞的侵袭力下降[11];相关转移分子方面:Ezrin可以与细胞基质透明质酸的受体CD44分子的细胞质部分作用,CD44在多种肿瘤转移中发挥作用,介导肿瘤迁移、侵袭,是细胞信号转导的重要环节。Ezrin与HGF、CD44相互作用形成复合物发挥促进肿瘤侵袭转移的作用,改变CD44的胞质尾结合区或干扰Ezrin的表达可阻断HGF诱导的信号转移[12]。
MMP-2、MMP-9是肿瘤迁移相关因子,本研究发现Ezrin表达与MMP-2、MMP-9呈正相关(r=0.317,0.494;P=0.025,0.01)。而MMP-2、MMP-9参与肿瘤的侵袭,间接说明Ezrin可能通过影响侵袭转移来参与宫颈癌的发展过程。Martin等[12]报道,宫颈癌Ezrin和IL-6表达呈正相关,而IL-6刺激MMP-9的表达,引起细胞外基质中Ⅳ型胶原降解,创造肿瘤浸润转移微环境,并通过CD44分子介导细胞与细胞、细胞与细胞外基质之间的黏附,引起肿瘤转移[12]。
本研究发现Ezrin表达与PCNA不相关(r=0.237,P=0.073),而PCNA是参与肿瘤的增殖过程已被广泛认知,这间接说明Ezrin 可能不影响宫颈癌增殖过程。目前尚无Ezrin与PCNA表达的相关研究,但Krishnan等[13]在尤文氏肉瘤研究中,发现Ezrin参与AKT-mTOR的信号通路,突变Ezrin567位点,可以抑制Ezrin蛋白介导的信号传递,减慢尤文氏肉瘤细胞在体外的增殖,体内实验也证明了这点。Ezrin是否参与肿瘤增殖有待进一步证实。
另外,本研究发现Ezrin表达与HPV E6表达呈正相关。HPV持续感染参与宫颈癌的发生发展过程,研究证实HPV E6与宫颈鳞癌关系最为密切,HPV通过其病毒原癌蛋白E6和E7整合宿主基因,并干扰细胞周期的P53和pRb途径,导致上皮内瘤样病变[14]。江忠清等[5]研究发现随着宫颈病变程度加深,从正常宫颈上皮到宫颈上皮内瘤变,再到宫颈癌,Ezrin表达增强,宫颈上皮内瘤变到宫颈癌进展过程中主要是HPV作用,Ezirn可能影响参与HPV促宫颈上皮的瘤变及癌变过程。Ezrin蛋白在宫颈癌的高表达是否与HPV感染有关,需要进一步研究。
综上所述,Ezrin蛋白在宫颈癌组织中高表达,且与宫颈癌浸润转移过程相关,但其具体生物学功能及在肿瘤发生发展中的作用需要更深入的机制研究。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] WALD F A, ORIOLO A S, MASHUKOVA A, et al. Atypical protein kinase C (iota) activates ezrin in the apical domain of intestinal epithelial cells[J]. J Cell Sci, 2008, 121(Pt 5): 644-654.
[3] OHTANI K, SAKAMOTO H, RUTHERFORD T, et al. Ezrin, a membrane-cytoskeletal linking protein, is highly expressed in atypical endometrial hyperplasia and uterine endometrioid adenocarcinoma[J]. Cancer Lett, 2002, 179(1): 79-86.
[4] 朱彦, 李从铸. Ezrin蛋白在宫颈癌中的表达及临床意义[J]. 肿瘤学杂志, 2009, 15(3): 175-178.
[5] 江忠清, 连成瑛, 林岷, 等. 宫颈鳞癌组织埃兹蛋白表达与局部浸润转移及预后的关系[J]. 中华妇幼临床医学杂志, 2007, 3(06): 308-312.
[6] YU Y, DAVICIONI E, TRICHE T J, et al. The homeoprotein six1 transcriptionally activates multiple protumorigenic genes but requires ezrin to promote metastasis[J]. Cancer Res, 2006, 66(4): 1982-1989.
[7] LOWERY A J, MILLER N, DWYER R M, et al. Dysregulated miR-183 inhibits migration in breast cancer cells[J]. BMC Cancer, 2010, 10: 502.
[8] WANG G, MAO W, ZHENG S. MicroRNA-183 regulates Ezrin expression in lung cancer cells[J]. FEBS Lett, 2008, 582(25-26): 3663-3668.
[9] YU Y, ZENG P, XIONG J, et al. Epigenetic drugs can stimulate metastasis through enhanced expression of the prometastatic Ezrin gene[J]. PLoS One, 2010, 5: e127109.
[10] ORIAN-ROUSSEAU V, MORRISON H, MATZKE A, et al. Hepatocyte growth factor-induced Ras activation requires ERM proteins linked to both CD44v6 and F-actin[J]. Mol Biol Cell, 2007, 18(1): 76-83.
[11] PRAG S, PARSONS M, KEPPLER M D, et al. Activated ezrin promotes cell migration through recruitment of the GEF Db1 to lipid rafts and preferential downstream activation of Cdc42[J]. Mol Biol Cell, 2007, 18(8): 2935-2948.
[12] MARTIN T A, HARRISON G, MANSEL R E, et al. The role of the CD44/ezrin complex in cancer metastasis[J].Crit Rev Oncol Hematol, 2003, 46(2): 165-186.
[13] KRISHNAN K, BRUCE B, HEWITT S, et al. Ezrin mediates growth and survival in Ewing’s sarcoma through the AKT/ mTOR, but not the MAPK, signaling pathway[J]. Clin Exp Metastasis, 2006, 23(3-4): 227-236.
[14] KHAN M J, CASTLE P E, LORINCZ A T, et al. The elevated 10 year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice [J]. J Natl Cancer Inst, 2005, 97(14): 1072-1079.
Differential expression of Ezrin in cervical cancer tissues and the relationship between Ezrin and PCNA, MMP-2, MMP-9, HPV
XI Mei-li1,2, LI Jun1,2, LU Xin1,2(1. Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200011, China; 2. Shanghai Key Laboratory of Female Reproductive Endocrine Related Diseases, Shanghai 200011, China)
LU Xin E-mail: xinlu98@yahoo.com
Background and purpose: Previous studies have revealed potential roles for Ezrin in a variety of cancers. Ezrin participates in several functions including cell adhesion, motility and cell survival, and there is increasing evidence that it regulates tumour progression. This study aimed to determine the differential expression of Ezrin between cervical cancer tissues and normal controls and to explore the association of Ezrin expression with clinical pathological characteristics and with the expression of PCNA, MMP-2, MMP-9 and HPV E6 protein. Methods: Retrospective study was performed among 30 cervical cancer tissue samples which were diagnosed in our hospital from Jan. 2002 to Dec. 2006. Ten normal cervixes from uterine myomas were employed as normal controls. Semiquantitative immunohistochemisty analysis was performed to detect the association of Ezrin expression with clinical pathological characteristics, and with expression of PCNA, MMP-2 and MMP-9, HPV E6 protein in cervical cancer tissue and normal controls. Analyze the association of Ezrin expression with the clinical characteristics. Results: The expression of Ezrin was strong and the distribution was diffuse mainly in the cytoplasm and membrane in cervicalcancer tissues, while the normal cervical tissues was weak and mainly in the membrane. However, there was no significant association between the expression of Ezrin and the clinical characteristics including tumor stage, histology and grade. Ezrin expression was positively correlated with the expression of MMP-2, MMP-9 and HPV E6 protein in cervical cancer tissues, except PCNA. Conclusion: Ezrin was over-expressed in cervical cancer tissues and may be involved in the progress of invasion and metastasis in cervical cancer.
Ezrin; Cervical carcinoma; Migration; Invasiveness
10.3969/j.issn.1007-3969.2013.11.009
R737.33
:A
:1007-3639(2013)11-0904-06
2013-09-17
2013-11-20)
鹿欣 E-mail:xinlu98@yahoo.com
