GRP78和pERK在胃癌及非胃癌组织中的表达及临床意义
2013-06-09彭春雷杨书云季进锋徐薇薇季从飞王建红谭清和杨磊
彭春雷杨书云季进锋徐薇薇季从飞王建红谭清和杨磊
1. 南通大学附属肿瘤医院肿瘤内科,江苏 南通226361;
2. 南通大学附属肿瘤医院病理科,江苏 南通226361
GRP78和pERK在胃癌及非胃癌组织中的表达及临床意义
彭春雷1杨书云2季进锋1徐薇薇1季从飞1王建红1谭清和1杨磊1
1. 南通大学附属肿瘤医院肿瘤内科,江苏 南通226361;
2. 南通大学附属肿瘤医院病理科,江苏 南通226361
背景与目的:在胃癌的发生、发展过程中,内质网应激、细胞的修复及凋亡是重要的病理生理过程,而GRP78与pERK在其中发挥了重要的作用。研究葡萄糖调节蛋白78(glucose-regulated proteins 78,GRP78)和磷酸化细胞外信号调节激酶(pERK)在胃腺癌、慢性萎缩性胃炎及浅表性胃炎组织中的表达,研究它们与胃癌发生、发展的关系。方法:RT-PCR法检测各25例胃腺癌、慢性萎缩性胃炎和浅表性胃炎新鲜组织中GRP78、pERK基因表达;免疫组化法分别检测各60例胃腺癌、慢性萎缩性胃炎和浅表性胃炎组织中GRP78、pERK蛋白表达,并分析其蛋白表达与临床病理参数间的相关性。结果:RTPCR半定量结果显示,胃癌组织中GRP78及pERK mRNA的相对表达水平(1.26±0.18、2.35±0.36)均明显高于慢性萎缩性胃炎组织(0.89±0.25、1.18±0.25)及浅表性胃炎组织(0.29±0.09、0.68±0.10),差异有统计学意义(P<0.01)。免疫组织化学结果显示,GRP78及pERK蛋白在胃癌组织中的表达率(78.3%、88.3%)亦均高于慢性萎缩性胃炎(46.6%、43.3%)及浅表性胃炎组织(6.7%、5.0%),差异有统计学意义(P<0.01)。胃癌组织中GRP78及pERK蛋白表达与胃癌分化程度、分期、淋巴结转移等有明显相关性。GRP78及pERK基因及蛋白表达水平在胃癌中均呈正相关(基因:r=0.307,P=0.000;蛋白:r=0.368,P=0.000)。单因素分析结果显示:组织学分级、浸润深度、TNM分期、淋巴结转移、GRP78高表达及pERK高表达与胃癌预后有关(P均<0.05)。浸润全层、低分化、TNM分期晚、有淋巴结转移、GRP78高表达及pERK高表达患者生存时间短。多因素生存分析结果结果显示:GRP78高表达与GRP78低表达相比生存时间差异有统计学意义(P<0.001)。GRP78高表达的胃癌患者生存时间短,提示GRP78是负性的预后因子。结论:GRP78和pERK在胃癌中高表达,GRP78和pERK在正常细胞向恶性细胞转化的过程中可能扮演了重要角色,检测pERK和GRP78的表达可能有助于对胃腺癌的预防、早期诊断及预后判断,同时为胃癌治疗寻找新的靶点。
葡萄糖调节蛋白78;磷酸化细胞外信号调节激酶;胃癌
GRP78是内质网应激诱导表达的关键蛋白,GRP78在内质网中扮演着双重作用。一方面作为固有的分子伴侣促进错误与未折叠蛋白恢复正常构象,减少未折叠蛋白的蓄积;另外一方面经过内质网跨膜受体信号转导,GRP78大量表达,和细胞外信号调节激酶(extracellular signal-regulated protein kinase,ERK)分离,使之磷酸活化,一旦激活,促使胃癌等肿瘤中UPR上游或下游的基因上调,刺激肿瘤慢性生长[1-2]。本研究采用RT-PCR法检测GRP78和pERK基因表达;免疫组织化学法检测两者蛋白表达,并探讨其表达与胃癌各临床病理参数间的关系。
1 资料和方法
1.1 临床资料
收集2007年1月—2008年2月间在南通市肿瘤医院就诊的胃腺癌、慢性萎缩性胃炎及浅表性胃炎各60例,其中胃癌组织标本来自我院行胃癌手术切除的患者,慢性萎缩性胃炎及浅表性胃炎的组织标本来自我院内镜室门诊行胃镜检查的患者。胃癌病例手术前未行放、化疗和其他抗肿瘤治疗,60例胃癌患者中男性42例,女性18例。平均年龄(61.32±6.15)岁。经病理检查确诊为胃腺癌, 未对癌旁组织做2者的表达状况的检测。其中分化程度:高分化8例,中分化41例,低分化11例;浸润深度:侵及黏膜下层8例,肌层32例,浆膜层20例;TNM分期:Ⅰ期7例,Ⅱ期29例,Ⅲ期24例,Ⅳ期0例;淋巴结转移39例,无淋巴结转移21例。全部标本的病理切片均经两位病理学专家验证。各组病例均收集到25例新鲜组织,用于RT-PCR检测。
1.2 试剂
TRIzol试剂购自GIBOC公司,免疫组化染色超敏试剂盒(SP法)和DAB显色试剂盒均购自上海凯博生物有限公司,鼠抗人GRP78和pERK单克隆抗体均购自上海瑞齐生物科技有限公司。
1.3 试验方法
1.3.1 RT-PCR检测GRP78及pERK mRNA的表达
以TRIzol试剂(GIBOC公司)提取25例胃腺癌、慢性萎缩性胃炎及浅表性胃炎新鲜组织总RNA。GRP78、pERK及内参β-actin上、下游引物分别为:GRP78上游:5’-TGGGTC GACTCGAATTCCAAAG-3’,下游:5’-GTCAGGCGATTCTGGTCATTGG-3’,产物大小为513 bp;pERK上游:5’-CTCACAGGCAAAGGAAGGAG-3’,下游:5’-AACAACTCCAAAGCCACCAC-3’,产物大小179 bp;β-actin上游:5’-GTTTGAGA CCTTCAACACCCC-3’,下游引物序列:5’-GTGGCCATCTCTCTTGCTCGAAGTC-3’,产物大小320 bp。PCR扩增条件均为:94 ℃变性1 min,56 ℃退火40 s,72 ℃延伸30 s,30个循环后,72 ℃再延伸10 min。RT-PCR产物进行琼脂糖凝胶电泳,照像保存。Kodark1D电泳成像系统进行扫描分析,计算GRP78、pERK mRNA的相对表达水平。GRP78及pERK mRNA 相对表达水平=GRP78(pERK)条带灰度值/β-actin条带灰度值。
1.3.2 免疫组织化学染色
免疫组化染色超敏试剂盒(SP法)和DAB显色试剂盒均购自上海凯博生物有限公司。将石蜡包埋的组织制成4 μm的连续切片,行免疫组化染色,将切片脱蜡至水化,高温高压修复;将鼠抗人GRP78和pERK单克隆抗体(上海瑞齐生物科技有限公司)稀释至1∶100,取已知阳性组织作阳性对照,PBS替代一抗作阴性对照。浆细胞能表达高水平的GRP78,其阳性染色被用来作为GRP78组的内部阳性参照[3]。DAB显色,用苏木精复染、脱水、透明,封片。
3.2 IFN-γ与获得性免疫 HBV的清除,主要通过特异CD8+T细胞介导的细胞毒性T淋巴细胞(CTL)和CD4+辅助细胞联合发挥作用,非溶细胞病变抗病毒是CTL工作的主要机制。非溶细胞性机制是通过细胞接触和释放细胞因子,主要为IFN-γ。IFN-γ可以抑制HBV病毒核衣壳的形成,影响病毒HBV RNA的稳定性并且还能降解它,主要通过控制肝细胞内P45、P39、P26这3个HBV DNA 结合蛋白的含量和活性,进而影响 HBV DNA 的转录和翻译。
1.3.3 免疫组织化学结果判断标准
GRP78见于细胞质中,出现棕黄色颗粒为阳性。pERK蛋白阳性表达位于细胞核,呈黄色或棕黄色颗粒;根据细胞中GRP78和pERK蛋白的着色范围评分:阴性为0,1%~10%为1,11%~50%为2,51%~80%为3,81%~100%为4。染色的强度分:阴性为0,弱为1,中为2,强为3。上两者的乘积为最后得分:0为(-),1~4为(+),5~8为(+ +),9~12为(+ + +);<5分归为低表达组,即阴性组,≥5分归为高表达组即阳性组。
1.4 统计学处理
所有数据应用Stata 8.0统计软件处理, 各组间GRP78和pERK基因表达半定量结果间比较采用方差分析;各组间免疫组化检测GRP78和pERK蛋白表达阳性率间的比较及GRP78和pERK蛋白表达阳性率在各临床病理参数间的比较均采用χ2检验。GRP78与pERK相关分析采用Pearson相关分析。以多因素非条件logistic回归模型计算调整HR及其95%CI。生存分析用Kaplan-Meier法,log-rank单因素分析和Cox多因素分析模型探讨GRP78表达与无疾病生存时间的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 GRP78及pERK基因及蛋白在各组胃组织中的表达
半定量RT-PCR结果显示,胃癌组织中GRP78及pERK mRNA的相对表达水平(1.26±0.18、2.35±0.36)均明显高于慢性萎缩性胃炎组织(0.89±0.25、1.18±0.25)及浅表性胃炎组织(0.29±0.09、0.68±0.10),差异有统计学意义(P<0.01),且两者mRNA表达量在慢性萎缩性胃炎组织与浅表性胃炎组织间差异也有统计学意义(P<0.01,表1)。
免疫组织化学结果显示,GRP78蛋白阳性信号定位于细胞质中,呈棕黄色颗粒(图1);pERK蛋白阳性信号定位于细胞核,呈黄色或棕黄色颗粒(图2)。胃癌、慢性萎缩性胃炎及浅表性胃炎组织中GRP78(78.3%、46.6%、6.7%)及pERK蛋白(88.3%、43.3%、5.0%)的表达率比较,差异均有统计学意义(P<0.01,表1)。

表 1 GRP78、pERK基因及蛋白在不同胃组织中的表达Tab. 1 The gene and protein expression of GRP78 and pERK in different gastric tissues

图 1 不同组织中GRP78的表达情况Fig. 1 The expression of GRP78 in different tissues
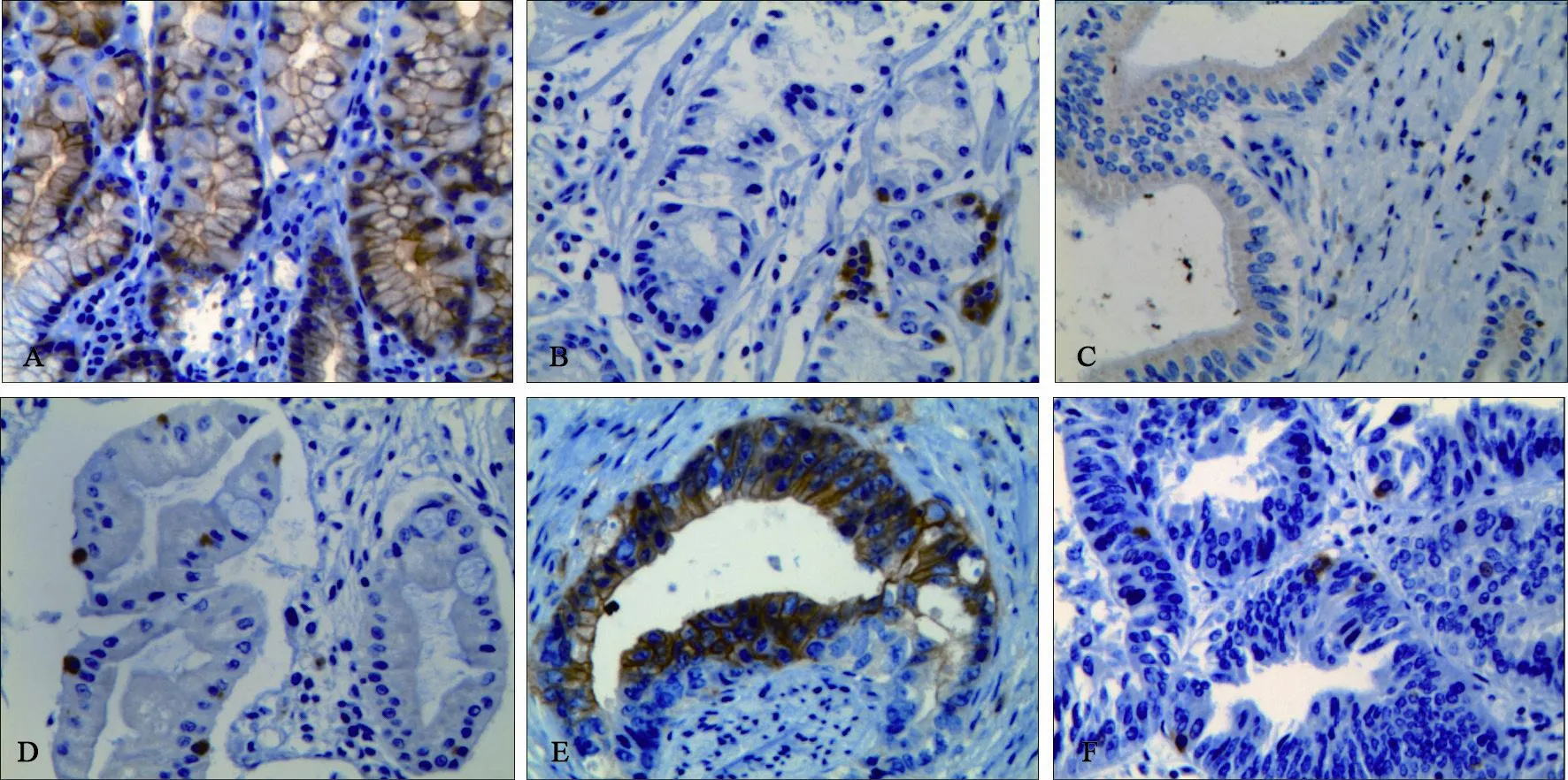
图 2 不同组织中pERK的表达情况Fig.1 The expression of pERK in different tissues
胃腺癌组织细胞中GRP78表达与年龄、性别、肿瘤浸润深度无关,与分化程度、分期和淋巴结转移有明显相关。胃腺癌组织细胞中pERK表达与年龄、性别无关,与肿瘤浸润深度、分化程度、分期和淋巴结转移明显相关(表2)。

表 2 胃癌组织中GRP78及pERK蛋白的表达与临床病理参数的关系Tab. 2 Relationship between protein expression of GRP78, pERK and clinical parameters of gastric cancer
胃癌中GRP78及pERK基因及蛋白表达水平的相关性分析。Pearson相关分析胃癌组织中GRP78及pERK基因表达水平间呈正相关(基因:r=0.307,P=0.000;蛋白:r=0.368,P=0.000)。
2.3 各临床参数与胃癌预后关系
2.3.1 单因素分析结果
组织学分级、浸润深度、TNM分期、淋巴结转移、GRP78高表达及pERK高表达与胃癌预后有关(P<0.05)。浸润全层、低分化、TNM分期晚、有淋巴结转移、GRP78高表达及pERK高表达患者生存时间短。未发现年龄、性别与胃癌预后有关(P>0.05,表3)
2.3.2 多因素分析结果
对单因素分析筛选出的显著性变量,纳入Cox模型进行多因素生存分析。在排除组织学分级、浸润深度、TNM分期、淋巴结转移、pERK高表达与胃癌预后的影响后,结果显示:GRP78高表达与GRP78低表达相比生存时间差异有统计学意义(P<0.001)。GRP78高表达的胃癌患者生存时间短。
2.4 GRP78与生存期的关系
GRP78阳性组与GRP78阴性组的生存时间的情况(图3),提示GRP78阳性是负性的预后因子。
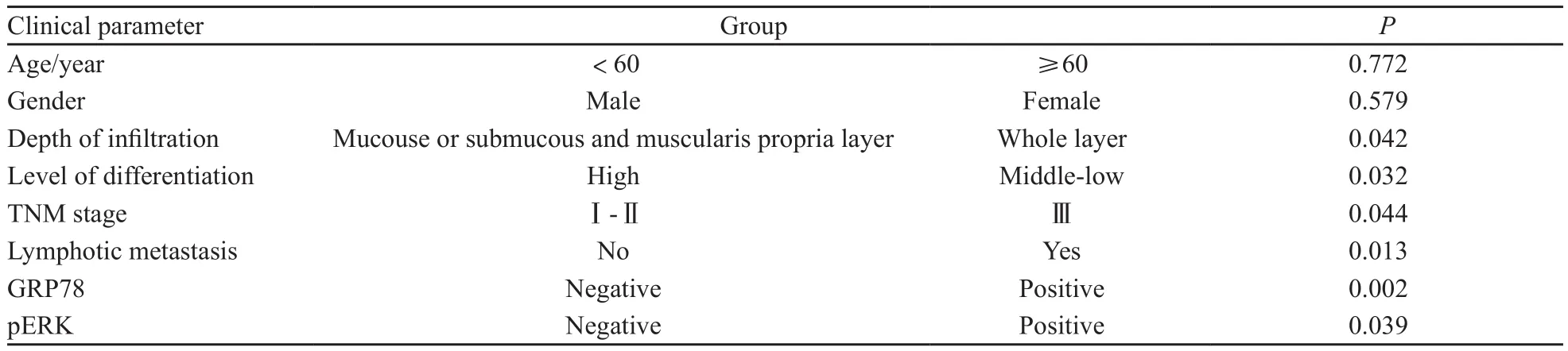
表 3 各临床参数与胃癌预后关系的单因素分析结果Tab. 3 Univariate analysis between disease-free survival of post-operative gastric adenocarcinoma patients and baseline clinical features
3 讨 论
GRP78是迄今研究较多的糖调节蛋白的家族成员,与热休克蛋白70(HSP70)有60%的同源性。该蛋白存在于内质网内,是内质网应激诱导表达的关键蛋白[3]。GRP78表达升高的意义在于:①能促进错误与未折叠蛋白恢复正常构像,使蛋白质能够在细胞应激状态下继续正确合成;②通过内质网膜上的肌醇三磷酸通道释放钙离子到胞质中,维持内质网、线粒体和胞质内Ca2+平衡并维持内质网内Ca2+依赖性蛋白修饰反应、对抗氧化应激,从而有助于减轻内质网应激、防止细胞发生凋亡[4];③促进凋亡的未折叠蛋白反应通路[5]。目前认为,胃黏膜在有害因素作用下产生损伤,黏膜细胞分裂、增生以修复损伤,如损伤修复,胃黏膜恢复正常,如损伤不能修复,可启动细胞凋亡,受损细胞的凋亡对于清除具有遗传缺陷的细胞具有重要意义,在胃癌发生、发展过程中,内质网应激、细胞的修复及凋亡是重要的病理生理过程,因此研究GRP78在此过程中的作用具有重要意义。本研究用免疫组化及RT-PCR的方法检测了GRP78在3组中表达情况。我们发现在在浅表性胃炎组织中GRP78阳性率仅为6.7%, 而在慢性萎缩性胃炎组织中GRP78阳性率为46.6%。而在胃腺癌组织中GRP78阳性率为78.3%。3组间GRP78蛋白的表达差异有统计学意义,胃癌组织GRP78 mRNA的相对表达水平(1.26±0.18)明显高于浅表性胃炎组织(0.29±0.09),差异有统计学意义(P<0.01); 慢性萎缩性胃炎组织的相对表达水平(0.89±0.25)明显高于浅表性胃炎组织,差异有统计学意义(P<0.05),进一步提示GRP78可能参与胃黏膜正常细胞向恶性细胞转化的过程,其具体机制需要进一步的研究。
越来越多的研究证明人类肿瘤与GRP78的高表达相关。近年来GRP78在乳腺癌[6-7]、非小细胞肺癌[8]、结肠癌[9]、肝癌[10]、前列腺癌[11]、成神经细胞瘤[12]中的高表达都有文献报道。本研究发现GRP78高表达与人类胃腺癌的分化程度、淋巴结转移、病理分期相关,而与患者年龄、性别及浸润深度无关。GRP78表达随分化程度的降低而增高,有淋巴转移的GRP78表达显著高于无淋巴转移的患者;病理分期越晚GRP78表达阳性率越高。GRP78高表达的患者其中位复发时间明显短于GRP78低表达的患者,提示GRP78的表达增加了肿瘤复发风险,与肿瘤患者的生存时间呈负相关。
ERK是MAPK家族的重要成员,ERK活化后,即pERK,进入细胞核作用于Elk-1、c-myc、c-fos、c-jun、ATF、NF-κB和AP-1等转录因子来调节相关基因的转录,进而参与细胞生长、发育、分裂及细胞间的功能同步等多种生理过程,并在细胞恶性转化等病理过程中起重要作用[13-15]。目前研究显示,pERK在乳腺癌、肝癌、头颈部鳞癌以及前列腺癌等多种肿瘤组织与细胞系中异常表达或活性增强[16-17],表明pERK调控异常与肿瘤发生、发展密切相关。本组病例显示,胃癌组织中pERK阳性率83.3%,高于慢性萎缩性胃炎组织43.3%。而在浅表性胃炎组织中pERK阳性率为5%。3组间pERK蛋白的表达差异有统计学意义。胃癌组织pERK mRNA的相对表达水平(2.35±0.36)也明显高于浅表性胃炎组织(0.68±0.10),差异有统计学意义(P<0.01);慢性萎缩性胃炎组织的相对表达水平(1.18±0.25)明显高于浅表性胃炎组织,差异有统计学意义(P<0.05)。进一步证实pERK在3种胃组织中的表达差异,其中GC组织中有淋巴结转移组阳性率高于无淋巴结转移组(P<0.01)。表明pERK在GC中高表达,且与分化程度、分期和淋巴结转移有明显相关性,pERK在胃癌侵袭、转移进展中起着促进作用,预示着pERK可能是胃癌患者预后不良的指标。
正常情况下,ERK与内质网腔中的GRP78牢牢结合[16]。应激情况下,UPR可使GRP78大量表达,GRP78和ERK分离,ERK被激活,通过磷酸化真核细胞起始因子2(eukaryotic initiation factor 2,elF2)抑制蛋白质合成。PERK/elF2a信号通路在降低内质网对新合成蛋白折叠需求压力的同时,还通过精细的调节机制,特异性的提高某些基因的转录水平,参与细胞的整合应激反应并诱导GRP78合成[17]。本研究中通过Pearson相关分析,提示胃癌组织中GRP78及pERK基因及蛋白表达水平间呈正相关。
综上所述,研究表明GRP78、pERK在胃癌中高表达,与胃癌的分化、进展、转移有密切的关系,可作为有价值的分子标志物。两者具有相关性,检测两者可以为胃癌的早期预防和早期诊断服务。
[1] MA Y, HENDERSHOT L M. The role of the unfolded protein response in tumour development: friend or foe?[J]. Nat Rev Cancer, 2004, 4: 966-977.
[2] 刘宏侠, 孙玉满, 汪宏斌, 等. pERK和MMP-9在非小细胞肺癌中的表达及临床意义[J]. 中国肿瘤临床, 2008, 35: 819-823.
[3] LEE E, NICHOLS P, SPICER D, et al. GRP78 as a novel predictor of responsiveness to chemotherapy in breast cancer[J]. Cancer Res, 2006, 66: 7849-7853.
[4] THUERAUF D J, MARCINKO M, BELMONT P J, et al. Effects of the isoform-specific characteristics of ATF6 alpha and ATF6 beta on endoplasmic reticulum stress response gene expression and cell viability[J]. Biol Chem, 2007, 282: 22865-22878.
[5] RON D, WALTER P. Signal integration in the endoplasmic reticulum unfolded protein response[J]. Nat Rev Mol Cell Biol, 2007, 8: 519-529.
[6] LEE E, NICHOLS P, GROSHEN S, et al. GRP78 as potential predictor for breast cancer response to adjuvant taxane therapy[J]. Int J Cancer, 2011, 128:726-731.
[7] SCRIVEN P, COULSON S, HAINES R, et al. Activation and clinical significance of the unfolded protein response in breast cancer[J]. Br J Cancer, 2009, 17: 1692-1698.
[8] CHEN J, EMARA N, SOLOMIDES C, et al. Resistance to platinum-based chemotherapy in lung cancer cell lines[J]. Cancer Chemother Pharmacol, 2010, 66: 1103-1111.
[9] XING X, LAI M, WANG Y, et al. Over expression of glucoseregulated protein 78 in colon cancer[J]. Clin Chim Acta, 2006, 364: 308-315.
[10] LI M S, PARK S G, YOO J H, et al. Expression of heat shock proteins (HSP27, HSP60, HSP70, HSP90, GRP78, GRP94) inhepatitis B virus-related hepatocellular carcinomas and dysplastic nodules[J]. World J Gastroenterol, 2005, 11: 2072-2079.
[11] DANESHMAND S, QUEK M L, LIN E, et al. Glucoseregulated protein GRP78 is up-regulated in prostate cancer and correlates with recurrence and survival[J]. Hum Pathol, 2007, 38: 1547-1552.
[12] HSH W M, HSIEH F J, JENG Y M, et al. GRP78 expression correlates with histologic differentiation and favorable prognosis in neuroblastic tumors[J]. Int J Cancer, 2005, 113: 920-927.
[13] QI M, ELION E A. MAP kinase pathways[J]. Cell Sci, 2005, 118: 3569-3572.
[14] 尤嘉琮, 汪宏斌, 杨宗伟, 等. 高转移倾向乳腺癌细胞中p-ERK促进增殖和迁移作用的信号转导途径[J]. 中国生物化学与分子生物学报, 2006, 22: 1007-1013.
[15] UZGARE A R, KAPLAN P J, GREENBERG N M. Differential expression and/or activation of P38MAPK, erk1/2, and jnk during the initiation and progression of prostate cancer. Prostate, 2003, 55: 128-139.
[16] MORETTI L, CHA Y I, NIERMANN K J, et al. Switch between apoptosis and autophagy: Radiation-induced endoplasmic reticulum stress[J]. Cell Cycle, 2007, 6: 7793-7798.
[17] 吕振嵘, 刘秀华. 蛋白激酶R样内质网激酶信号通路在内质网应激中作用的研究进展[J]. 生理科学进展, 2011, 42: 152-157.
The expression and clinical significance of GRP78 and pERK in gastric adenocarcinoma, chronic atrophic gastritis and superficial gastritis
PENG Chun-lei1, YANG Shu-yun2, JI Jin-feng1, XU Wei-wei1, JI Cong-fei1, WANG Jian-hong1, TAN Qing-he1, YANG Lei1(1. Department of Medical Oncology, Nantong University Affiliated Tumor Hospital, Nantong Jiangsu 226361, China; 2. Department of Pathology, Nantong University Affiliated Tumor Hospital, Nantong Jiangsu 226361, China)
YANG Lei E-mail: leiyang.53@163.com
Background and purpose: In the process of gastric cancer development, cytothesis and apoptosis, and endoplasmic reticulum stress (ERS) are very important pathological processes. Glucose regulated protein 78 (GRP78) and phosphorylated form of extracellular signal-regulated protein kinase (pERK) play important roles in it. This study aimed to investigate the expression of GRP78 and pERK in gastric adenocarcinoma, chronic atrophic gastritis and superficial gastritis, and the role of GRP78 and pERK in the development of gastric adenocarcinoma. Methods: Gastric adenocarcinoma, chronic atrophic gastritis and superficial gastritis tissues in 60 cases respectivelywere employed in the study. We chose 25 fresh tissue samples from each group, and the level of GRP78 and pERK mRNA in different tissues were detected by RT-PCR assay. The expressions of GRP78 and pERK in different paraffin samples were detected using immunohistochemistry assay. In addition, the relationships between GRP78 and pERK expression and age, gender, differentiation, invasion, disease stage, and lymphoid node metastasis were analyzed. Results: The expression level of GRP78 and pERK mRNA in gastric adenocarcinoma(1.26±0.18, 2.35±0.36) were significantly higher than chronic atrophic gastritis (0.89±0.25, 1.18±0.25) and superficial gastritis (0.29±0.09, 0.68±0.10, P<0.01). The positive ratio of GRP78 expression in gastric adenocarcinoma, chronic atrophic gastritis and superficial gastritis were 78.3%, 46.6%, 6.7%. The positive ratios of pERK expression were 88.3%, 43.3%, 5.0%, respectively. The GRP78 and pERK expression in different tissues were significantly different (P<0.01). GRP78 and pERK expression were positively correlated with differentiation, disease stage and lymph node metastasis. There was a positive correlation between the gene and protein expression of GRP78 and pERK with a Pearson correlation value of 0.307 and 0.368, respectively. Both univariate and multivariate analysis revealed that GRP78 was related to the prognosis of gastric adenocarcinoma. Conclusion: GRP78 and pERK may play an important role in the transition of normal gastric cells to malignant cells. The expression of these two genes enhances tumor progression. Overexpression of GRP78 and pERK is significantly correlated with poor prognosis in patients with gastric adenocarcinoma. The determination of the expression of GRP78 and pERK might be helpful for the prevention, early diagnosis of gastric carcinoma. Particularly, GRP78 is valuable for the judgement of prognosis, and might be a new target for the treatment of gastric adenocarcinoma.
GRP78; pERK; Gastric adenocarcinoma
10.3969/j.issn.1007-3969.2013.11.006
R735.2
:A
:1007-3639(2013)11-0885-07
2013-09-10
2013-11-05)
南通市科技局指令性课题(No:S2010024)。
杨磊 E-mail:leiyang.53@163.com
