过度训练对大鼠骨骼肌糖代谢的影响
2013-06-07刘无逸
刘无逸, 钱 鹤, 王 磊, 李 海
(1.上海体育学院运动科学学院,上海200438;2.阿迪达斯体育(中国)有限公司,北京100022;3.四川内江师范学院体育学院,四川内江641000)
过度训练对大鼠骨骼肌糖代谢的影响
刘无逸1, 钱 鹤2, 王 磊1, 李 海3
(1.上海体育学院运动科学学院,上海200438;2.阿迪达斯体育(中国)有限公司,北京100022;3.四川内江师范学院体育学院,四川内江641000)
目的:观察大鼠在过度训练状态下骨骼肌糖代谢的变化,探讨过度训练对糖代谢的影响。方法:将SD大鼠随机分为对照组(7只,Con)、运动组(8只,Mtr)和过度训练组(9只,Otr),进行9周跑台训练,其中Otr组后3周为力竭性运动。运动后分别测定骨骼肌糖原含量,LDH、PK、SDH、SOD酶的活性及MDA浓度,电镜观察肌组织的变化。结果:Otr组肌糖原含量较Mtr组降低,各种酶活性受到不同程度的抑制,MDA浓度升高,线粒体水肿,呈空泡状。结论:大鼠连续力竭性运动所致过度训练存在骨骼肌糖代谢功能紊乱,其可能与力竭性运动引起的自由基损害有关。
大鼠;过度训练;肌糖原;自由基;线粒体
Author’s address1.School of Kinesiology,Shanghai University of Sport,Shanghai 200438,China;2.Adidas Sports(China)Co.,Ltd.Beijing 100022,China;3.School of Physical Education,Neijiang Normal University,Neijiang 641000,Sichuan Province,China
随着运动员训练水平的提高,竞技水平表现出极值化,运动员之间的竞争变得更为激烈,导致训练强度更大,训练时间更长,技术难度更高,运动员更容易出现过度训练;因此,预防过度训练成为运动医学工作者的重要任务。
过度训练产生的机制较为复杂,到目前为止学界尚无统一的认识。在多种假说中,肌糖原耗损学说[1]是其中之一,C.M.McGowan等[2]也认为,过度训练时机能下降与代谢紊乱无关,国内学者也尝试通过补糖预防过度训练的发生[3];但也有资料显示过度训练的发生有肌糖原以外的因素参与[1]。为进一步了解糖代谢在过度训练产生机制中的作用,我们通过观察大鼠在过度训练状态下骨骼肌糖代谢的变化,探讨过度训练对糖代谢的影响。
1 研究对象与方法
1.1 研究对象及分组 3月龄雄性Sprague-Dawley大鼠24只,由第二军医大学提供,体重为(373.9± 29.91)g,随机分为3组:安静对照组(Con组)7只、中等强度训练组(Mtr组)8只、过度训练组(Otr组)9只。以国家标准啮齿类动物饲料(由上海海军医学研究所动物中心提供)饲养,自由进食、饮水,室温为20~25℃,相对湿度为45%~55%,每天光照12 h,一周适应性训练。为避免组间和组内大鼠因活动而造成的差异,大鼠均饲养于标准饲养笼(长×宽 ×高为40 cm×27 cm×22 cm)内,每4~5只一笼分笼饲养。
1.2 训练方案
1.2.1 大鼠训练方案 本实验参照T.G.Bedford等[4]的大鼠训练运动负荷标准,采用BCPF-98型生物医学动物跑台(由杭州立泰科技有限公司提供)进行训练,跑台坡度为5%,训练时间为8周,每周训练6 d,休息1 d,每周称体重一次。具体训练方案见表1。
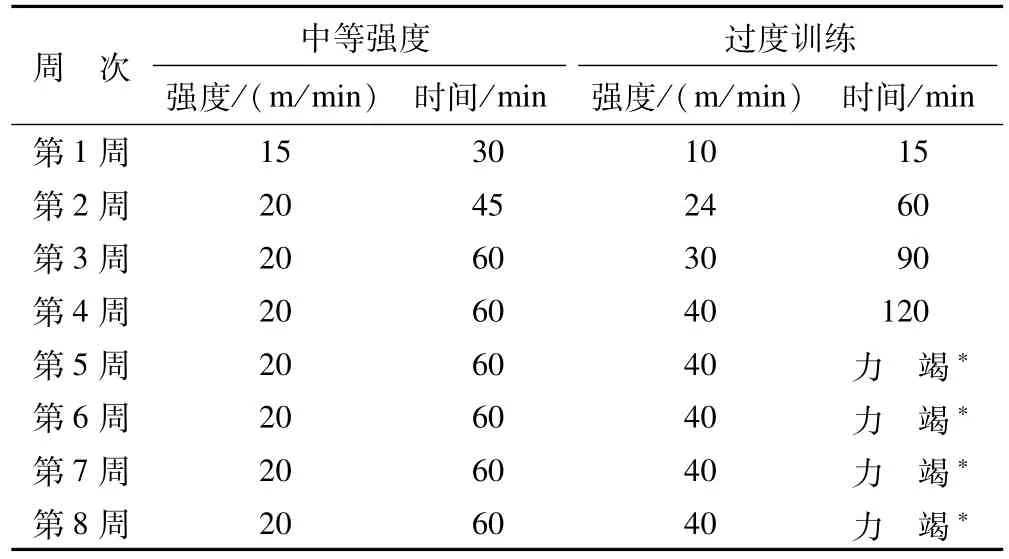
表1 大鼠训练方案Table 1 Training Protocol for Rats
1.2.2 过度训练模型建立的依据 在实验过程中当实验大鼠出现下列2项时,定为过度训练状态[5-6]。
一是体重下降幅度大于一般训练时体重的1/30。神态倦怠,眼神变得暗淡无光,毛发脱落成稀疏状,进食量明显减少。
二是运动能力明显下降,跑速及时间减为原最大值的1/3~1/6。
1.3 取材 在大鼠8周训练结束后36 h,3组大鼠被腹腔麻醉后处死并迅速取出比目鱼肌、跖肌和腓肠肌红肌部分进行预处理,其中一部分标本置于固定液中用于石蜡切片制作,一部分标本入液氮速冻后移入-80℃冰箱,用于生化分析。另取部分腓肠肌红肌置于4℃的戊二醛专用电镜固定液中用于电子显微镜观察。
1.4 测试指标及方法 肌糖原、SOD酶活性、MDA、丙酮酸激酶(PK)活性、琥珀酸脱氢酶(SDH)活性、乳酸脱氢酶(LDH)活性、ATP酶(ATPase)活性均使用南京建成生物研究所的商用试剂盒测定。
糖原染色:采用高碘酸—希夫染色。配制高碘酸氧化剂和Schiff试剂4℃保存备用。
染色步骤:1)切片脱蜡至水;2)0.5%高碘酸氧化5~8 m in;3)流水冲洗2min,再用蒸馏水洗;4)入无色品红液,于暗处加盖作用10~20 min;5)0.5%偏重亚硫酸钠液滴洗2次,每次约1 m in;6)流水冲洗5 m in;7)亮绿水溶液复染数秒;8)稍水洗后常规脱水、透明、中性树胶封固。
电镜:取经戊二醛固定的标本,用0.1 mol/L PBS缓冲液洗涤2次,1%锇酸后固定30~60 min,常规电镜样品制备程序脱水、渗透、包埋、超薄切片、铀铅染色。
1.5 统计方法 采用SPSS 12.0统计软件处理所有数据,均用平均数±标准差表示。组间比较分别采用单因素方差分析,P<0.05为差异有显著性,P<0.01为差异有高度显著性。
2 实验结果
2.1 大鼠一般情况 安静组大鼠和中等强度训练组大鼠均活泼好动,皮毛紧密光滑,干净润泽,目光有神,体重稳步增长。过度训练组大鼠目光倦怠无光,皮毛枯槁,体型瘦弱,体重严重下降,第7周开始多数大鼠不能完成规定训练量,惊惧,反应迟钝。宰杀时发现肠道发黄,胀气严重,皮下脂肪稀薄。过度训练组与安静对照组和中等强度训练组的大鼠每周体重增长具有显著性差异(P<0.05)。过度训练组大鼠体重从第3周开始明显下降,而中等强度训练组大鼠体重相对于安静组无显著性变化。

表2 实验前后各组大鼠体重变化 gTable 2 Changes in Rats Body Weight during Breeding in Various Groups
表2表明,实验前过度训练组与安静对照组和中等强度训练组的大鼠体重无显著性差异(P>0.05)。实验后过度训练组大鼠体重相对于安静对照组和中等强度训练组大鼠,体重显著性下降(P<0.05)。
2.2 大鼠肌糖原含量
2.2.1 运动对大鼠肌糖原含量的影响 表3显示,Mtr组比目鱼肌肌糖原含量高于Con组,且差异具有显著性(P<0.01),Otr组比目鱼肌肌糖原含量相比于Con组则稍有增高趋势,但差异不具有显著性(P>0.05),但与Mtr组比较显著降低(P<0.01)。

表3 大鼠肌糖原含量 mg/gTable 3 The Muscle Glycogen Content of Rats
Mtr组跖肌肌糖原含量相比于Con组有增高趋势,但差异不具有显著性(P>0.05);Otr组跖肌肌糖原含量相比于Con组则有下降趋势,但差异同样不具有显著性(P>0.05),而较Mtr组显著降低(P<0.05)。
2.2.2 肌糖原染色 对3组大鼠跖肌和比目鱼肌进行糖原染色显示,糖原在肌纤维的一侧着色较深,3组间的着色程度在镜下不易区分(图1)。

图1 大鼠肌糖原染色注:上图为跖肌,下图为比目鱼肌,40×10。Figure 1. Muscle Glycogen Dyeing of Rats
2.3 骨骼肌代谢酶活性的变化
2.3.1 运动对大鼠骨骼肌中LDH活性的影响 表4显示,跖肌中Mtr组LDH活性稍低于Con组,且差异不具有显著性(P>0.05);Otr组LDH活性明显低于Con组和Mtr组,差异均具有显著性(P<0.01)。比目鱼肌中Mtr组LDH活性稍高于Con组,且差异不具有显著性(P>0.05),而Otr组LDH活性明显低于Con组,差异具有显著性(P<0.01),但与Mtr组之间无明显差异(P>0.05)。
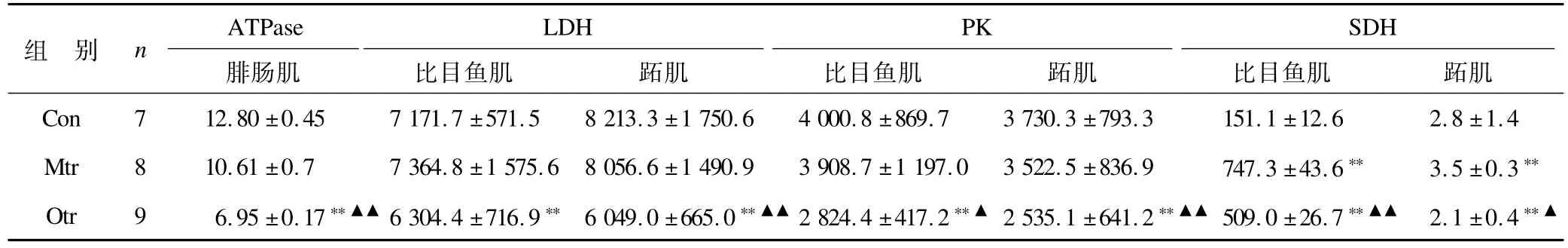
表4 大鼠骨骼肌代谢酶活性测定结果 U/mgprotTable 4 Determination of Skeletal Muscle Metabolic Enzymes Activity of Rats
2.3.2 运动对大鼠骨骼肌中PK活性的影响 表4显示,跖肌中Mtr组PK活性稍低于Con组,且差异不具有显著性(P>0.05),而Otr组PK活性明显低于Con组和Mtr组,差异均具有显著性(P<0.01)。比目鱼肌中Mtr组PK活性稍低于Con组,且差异不具有显著性(P>0.05),而Otr组PK活性明显低于Con组和Mtr组,差异分别为非常显著(P<0.01)和显著(P<0.05)。2.3.3 运动对大鼠骨骼肌中SDH活性的影响 表4显示,跖肌中Mtr组SDH活性明显高于Con组,且差异具有显著性(P<0.01);Otr组SDH活性明显低于Con组和Mtr组,差异为非常显著(P<0.01)和显著(P<0.05)。比目鱼肌中Mtr组SDH活性明显高于Con组,且差异具有显著性(P<0.01);Otr组SDH活性显著高于Con组(P<0.01),但显著低于Mtr组(P<0.01)。
2.3.4 运动对大鼠骨骼肌中ATPase活性的影响 表4显示,腓肠肌中Mtr组ATPase活性与Con组比较无显著性差异(P>0.05);Otr组ATPase活性显著低于Con组和Mtr组,差异为非常显著(P<0.01)。
2.4 腓肠肌线粒体变化 图2显示:Con组线粒体外膜完整,肌原纤维排列整齐、肌丝完整(×7 000);Mtr组线粒体结构完整,肌原纤维排列整齐、数量增加,有生理性补偿行为(×7 000);Otr组线粒体肿胀,水性变及空泡化,内膜、嵴破坏溶解改变(×7 000)。
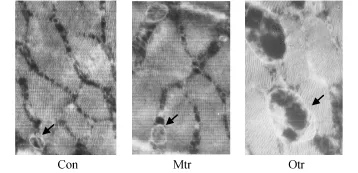
图2 大鼠腓肠肌电子显微镜观察结果Figure 2. Gastrocnemius of Rats under Electron Microscopy
2.5 腓肠肌MDA浓度及SOD活性变化 表5显示:腓肠肌中Mtr组MDA浓度较Con组显著降低(P<0.05);Otr组MDA显著高于Mtr组(P<0.05),较Con组有升高趋势,但未达到统计意义(P>0.05)。
腓肠肌中Mtr组SOD活性与Con组比较显著增加(P<0.05);Otr组SOD活性显著低于Mtr组(P<0.05),较Con组有升高趋势,但未达到统计意义(P>0.05)。

表5 大鼠腓肠肌MDA浓度及酶活性测定结果Table 5 Determination of Gastrocnemius MDAContent and Enzymes Activity of Rats
3 讨论
6周递增负荷训练加3周力竭性运动,引起实验大鼠体重下降,神态倦怠,毛发脱落成稀疏状,运动能力明显下降,显示过度训练动物模型成功建立[5-6]。
在耐力训练中,运动前服糖被认为可提高运动耐力,运动后服糖被认为有利于超量恢复,两者均与肌糖原含量有关;因此,肌糖原含量与机体的运动能力有着密切的关联。运动中肌糖原大量消耗被认为是引起运动性疲劳的因素之一,也有学者认为连续大强度运动可致肌糖原持续下降,是引起过度训练的可能因素之一[7]。在实验中发现,6周渐进性训练后连续3周大强度的力竭性训练所致的过度训练大鼠,肌糖原水平与正常训练大鼠比较明显降低;但与正常对照组比较并无显著性差异,显示持续力竭性运动引起的过度训练与肌糖原含量的联系可能并不密切。文献[8]也显示在肌糖原含量正常的情况下也可能发生过度训练,因此,过度训练产生的机制应有更深层次的原因。我们在前期的研究[9]中,提出运动中骨骼肌细胞内能量利用障碍在过度训练的产生机制中起着重要的作用。为此,我们观察了参与细胞糖代谢的部分酶的活性,以便了解过度训练状态下对糖代谢的影响。
正常的运动训练可使骨骼肌中代谢的酶活性提高[10],在过度训练状态下,相关的代谢酶活性可能受到抑制。在糖代谢中,LDH是在无氧条件下催化丙酮酸转变为乳酸的酶,我们观察到在过度训练的大鼠骨骼肌中该酶活性受到抑制,这可能与过度训练条件下最大乳酸能力下降有关[11-12],这一变化也可能降低了机体无氧运动的能力。PK位于胞浆中,为糖的无氧酵解和有氧氧化共同代谢途径中的激酶,SDH位于线粒体内,是糖氧化过程中最活跃的酶[10],两者在过度训练时均受到抑制,提示在过度训练条件下,骨骼肌糖的有氧代谢途径也受到阻碍。ATPase是线粒体在参与能量代谢中的最终调节环节,催化ATP的合成,实验显示该酶活性降低,表明过度训练时骨骼肌的能量代谢在不同环节上均受到抑制。我们认为,在过度训练状态下,骨骼肌存在代谢障碍的问题,至少在糖代谢方面如此。E.de Graaf-Roelfsema等[13]对赛马的实验观察中发现,过度训练时葡萄糖代谢率和葡萄糖代谢率与血浆胰岛素浓度的比值明显降低,也从另一个侧面支持过度训练状态下存在糖代谢障碍的问题。
自20世纪80年代初发现运动可引起自由基对组织的损害作用[14],随后大量的研究发现自由基的产生与剧烈运动即刻或运动后的许多细胞、组织、器官水平代谢的紊乱有直接关系[15-16]。在过度训练中,引起机体运动源性自由基的生成增加,它们不仅损伤生物膜的功能,也可对细胞内的信号转导通路产生影响,由此影响组织能量代谢[17]。在我们的研究中也发现,过度训练大鼠骨骼肌中MDA含量显著升高,而SOD活性受到抑制,这可能是引起过度训练时糖代谢受阻的直接原因。自由基主要由线粒体产生,除了攻击细胞膜外,本身可对线粒体造成损伤。在对过度训练大鼠的腓肠肌进行电镜观察时我们发现,线粒体明显肿胀,有水性变及空泡化,内膜、嵴破坏溶解改变。在这种情况下,如果继续发展,肌肉将发生自溶和萎缩性改变,同时肌肉对刺激的反应下降,极易疲劳。这种病理性变化势必影响能量的产生,引起代谢紊乱,因此,自由基在过度训练时细胞的功能下降发挥着重要的作用。
4 结论
大鼠连续力竭性运动所致过度训练存在骨骼肌糖代谢功能紊乱,可能与连续力竭性运动引起的自由基损害有关。
[1] Snyder A C.Overtraining and Glycogen Depletion Hypothesis[J].Med Sci Sports Exerc,1998,30(7):1146-1150
[2] McGowan C M,Golland L C,Evans D L,et al.Effects of Prolonged Training,Overtraining and Detraining on Skeletal Muscle Metabolites and Enzymes[J].Equine Vet J Suppl,2002(34):257-263
[3] 常波,衣雪洁,于莹.过度训练和补糖对大鼠骨骼GLUT4和PKb活性的影响[J].武汉体育学院学报,2010,44(1):68-72
[4] Bedford T G,Tipton C M,Wilson N C,et al.Maximum Oxygen Consumption of Rats and Its Changes with Various Experimental Procedures[J].J Appl Physiol,1979,47(6):1278-1283
[5] 叶剑飞,余闽,岑浩望.过度训练的病理生理及康复I.大鼠过度训练模型的建立[J].中国运动医学杂志,1992,11(1):15-21
[6] 郑陆,隋波,潘力平,等.过度训练状态动物模型的建立[J].中国运动医学杂志,2000,19(2):179-181
[7] Newsholme E A,M Parry-Billings,N McAndrew,et al.A Biochemical Mechanism to Explain Some Characteristics of Overtraining[M].In:Advances in Nutrition and Top Sport,F.Brouns(Ed.).Basel:Karger,1991(32):79-93
[8] Snyder A C,Kuipers H,Cheng B,et al.Overtraining Following Intensified Training with Normal Muscle Glycogen[J].Med.Sci.Sports Exerc,1995,27:1063-1070
[9] 刘无逸,陆爱云.过度训练对大鼠骨骼肌糖原含量、AMPK活性及肌膜GLUT4的影响[J].中国运动医学杂志,2006,25(6):668-673
[10] McPhee JS,Williams A G,Perez-Schindler J,et al. Variability in the Magnitude of Response of Metabolic Enzymes Reveals J Patterns of Co-Ordinated Expression Follow ing Endurance Training in Women[J].Exp Physiol,2011,96(7):699-707
[11] Jeukendrup A E,Hesselink M K.Overtraining—What do Lactate Curves Tell us[J].Br J Sports Med,1994,28(4):239-240
[12] Bosquet L,Léger L,Legros P.Blood Lactate Response to Overtraining in Male Endurance Athletes[J].Eur J Appl Physiol,2001,84(1-2):107-114
[13] de Graaf-Roelfsema E,Keizer H A,van Breda E,et al. Effects of Intensified Training and Subsequent Reduced Training on Glucose Metabolism Rate and Peripheral Insulin Sensitivity in Standard Breds[J].Am JVet Res,2012,73(9):1386-1393
[14] Davies K JA,Quintaniha T A,Brooks G A,et al.Free Radical and Tissue Damage Produced by Exercise[J].Res Biochem Biophys Commun,1982,107:1198-1205
[15] Jenkins R R.Free Radical Chemistry:Relationship to Exercise[J].Sport Med,1988,5(3):156-170
[16] Jenkins R R.Exercise,Oxidative Stress and Antioxidant:A Review[J].Int J Sports Nutr,1993,3(4):356-375
[17] 李琳燕.过度训练对大鼠骨骼肌自由基代谢和MAPK信号通路p38蛋白表达的影响[J].沈阳体育学院学报,2011,30(1):62-71
Effects of Overtraining on Glucose Metabolism in Rat Skeletal Muscle
∥LIU Wuyi1,QIAN He2,WANG Lei1,LI Hai3
Objectives:It is to observe the changes in glucose metabolism of skeletal muscle in rat after overtraining and explore the effects of overtraining on glucose metabolism.Methods:SD rats were randomly divided into group Con(7,sedentary control),group Mtr(8,moderate intensity training)and group Otr(9,over training).Both training groups were doing 9-week treadmill training.Skeletal muscle glycogen levels,LDH,PK,SHD,SOD activity and MDA concentrations were determined and morphological changes of muscular tissue were observed by electron microscopy after the 9-week training.Results:Muscle glycogen levels in group Otr were lower compared with that in group Mtr.A variety of enzymatic activity was subjected to varying degrees of inhibition.MDA concentrations increased,and morphology of mitochondria was swelling to be vacuoles. Conclusions:The dysfunction of glucose metabolism in rat skeletal muscle after overtraining is probably owing to the free radical impairment from the exhaustive exercise.
rat;overtraining;glycogen;free radical;mitochondria
G804
A
1000 -5498(2013)03 -0060 -04
2012 -12 -17;
2013 -02 -12
上海市人类运动能力开发与保障重点实验室(上海体育学院)资助项目(11DZ2261100)
刘无逸(1955 -),男,浙江宁波人,上海体育学院副教授,博士;Tel:(021)51253248,E- mail:lwy3248 @yahoo.com.cn
