鸡传染性贫血病LAMP检测方法的建立
2013-06-05吴焕荣赵全兴杨欣欣杨慧玲山东众成饲料科技有限公司山东省禽用饲料工程技术研究中心山东肥城271600
吴焕荣 赵全兴 杨欣欣 杨慧玲 国 琳(山东众成饲料科技有限公司 山东省禽用饲料工程技术研究中心 山东 肥城 271600)
潘志刚 (山东省烟台市莱山区动物卫生监督所)
鸡传染性贫血病LAMP检测方法的建立
吴焕荣*赵全兴 杨欣欣 杨慧玲 国 琳(山东众成饲料科技有限公司 山东省禽用饲料工程技术研究中心 山东 肥城 271600)
潘志刚 (山东省烟台市莱山区动物卫生监督所)
本文借助环介导等温扩增技术,建立了鸡传染性贫血病的快速检测方法。通过提取DNA模板,设计特异性LAMP引物,成功扩增出梯形条带。结果表明,LAMP能检测出最低DNA量约为0.245pg/μl,而PCR能检测出最低DNA量约为2.45pg/μl;且具有特异性,对其他相关鸡病病原检测结果均为阴性。用建立的LAMP方法对临床样品进行检测,同时与PCR方法比较,结果表明LAMP检测的阳性率要比PCR高。LAMP检测方法无需昂贵设备,适用于鸡场的临床快速诊断。
鸡传染性贫血病毒 环介导等温扩增技术 PCR 检测
鸡传染性贫血病(Chicken Infectious Anemia,CIA)是由鸡传染性贫血病毒(Chicken infectious anemia virus, CIAV)引起雏鸡的以再生障碍性贫血和全身性淋巴组织萎缩为特征的一种免疫抑制性疾病,经常合并、继发和加重病毒、细菌和真菌性感染,危害很大[1,2]。国内外的病原分离和血清学调查结果表明,鸡传染性贫血病可能呈世界性分布,由鸡传染性贫血病毒诱发的疾病已成为一个严重的经济问题,特别是对肉鸡的生产[3,4]。
目前针对该病的诊断方法有ELISA、DNA探针、常规PCR、实时PCR等,这些诊断方法对实验条件要求比较高,而且对操作者要求具有很好的专业背景,环介导等温扩增技术(Loop-Mediated Isothermal Amplification,LAMP)是由日本Notomi等在2000年开发的一种新颖的恒温核酸扩增方法[5],其特点是针对靶基因的6个区域设计四种特异引物和一种具有链置换活性的DNA聚合酶,在恒温条件下高效扩增核酸,具有高特异性、快速灵敏、高效、操作简便等特点。LAMP方法是一种新型的DNA环介导等温扩增反应,不需要特殊的仪器设备,只需要用普通的水浴锅就可以完成整个诊断过程,而PCR反应程序比较复杂,反应时间较LAMP反应时间长,而且LAMP检测的灵敏度远高于PCR,本文研究利用LAMP技术诊断这种疾病。
1 试验材料
1.1 材料 CIAV标准毒CuX-1株(M55918)由公司实验室保存,ALV毒株由山东农业大学赠予。pTCIAV阳性克隆、ALV阳性克隆均由公司实验室保存。
1.2 主要试剂和仪器 Bst DNA聚合酶,大片段(New England Biolabs);普通DNA产物纯化试剂盒;Pst I 限制性内切酶,SYBR Green染色液;Tris-HCl,EDTA;NaCl;SDS;Betaine(5mol/L)购自Sigma公司;AMV反转录酶购自Sigma公司;pGEM-T easy VectorKit购自Invitrogen公司;PCR反应试剂、限制性内切酶、T4 DNA连接酶购自Takara公司;质粒提取试剂盒和DNA片段回收试剂盒、感受态细胞E.coli.Top10菌株购自北京天根科技有限公司;PCR仪、水浴锅等。
2 试验方法
2.1 模板的制备 CIAV DNA的提取:取CIAV病料液100μl加入20μl的裂解液(10mmol/L,Tris-HCl;1mmol/L,EDTA;15mmol/L,NaCl;0.5%,SDS),震荡混匀后,煮沸10min,最后12000r/min4℃离心10min,取上清作为模板,进行LAMP。
2.2 引物设计与合成 根据GenBank公布的鸡传染性贫血病毒基因序列(Cux-1:M55918)中的保守区运用Primer Explorer Version 3设计两套特异性的LAMP引物,包括两条外引物F3、B3和两条内引物FIP、BIP,另外为了加速反应速度,缩短反应时间设计了LF、LB环引物,其中为了确定扩增产物的特异性,使用限制内切酶Pst I进行酶切,识别F2和F1c之间的位点,产生的片段与推测的大小(184bp和221bp)相符。引物由上海英骏生物技术有限公司合成。
2.3 LAMP扩增反应条件 CIAV LAMP反应体系25μl,包括:dNTPs 1.6mmol/l、FIP/BIP 1.6umol/l、F3/B3 1.6umol/l、LF/LB 0.4umol/l、Betaine(5mol/L),5.0μl、MgCl2(25mmol/l),2.5μl、Bst DNA聚合酶大片段2μl、10×ThermoPolbuffer 2.5μl、DNA模板2μl,加双蒸水补足至25μl;混匀后63℃温浴30min,85℃灭活5min;产物于1.5%的琼脂糖凝胶电泳分析。
2.4 CIAV LAMP产物酶切鉴定 LAMP产物按照天根公司普通DNA产物纯化试剂盒说明书进行纯化。20μl的酶切体系包括:纯化的DNA 5μl;10×buffer 2μl;Pst I 2μl;双蒸水11μl。37℃恒温12h,琼脂糖凝胶电泳检测,观察结果。
2.5 LAMP反应的特异性实验 取5种病原包括鸡传染性法氏囊病毒(IBDV)、禽网状内皮细胞增生病毒(REV)、鸡新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)、禽白血病病毒(ALV)的DNA或cDNA为模板进行LAMP扩增。
2.6 LAMP反应灵敏度的检验 取CIAV全基因组克隆阳性克隆pTCIAV,摇菌12-16h后,提取质粒,测定OD260nm处的吸光值,换算为核酸含量,然后10倍系列稀释,各稀释度为模板分别进行PCR和LAMP扩增。
2.7 LAMP与PCR检测方法的对比及临床样品检测 设计合成用于CIAV的PCR检测的一系列引物,按照已建立的CIAV的PCR检测步骤对10倍稀释的阳性标准品进行检测,并与LAMP的结果进行对比。用上述两种方法对所采集的40份临床样品进行检测,对检测结果进行比较。
3 试验结果
3.1 LAMP检测方法的建立 以本研究设计的两套特异性引物分别对鸡传染性贫血病毒(Cux-1∶M55918)基因组DNA进行LAMP扩增。电泳检测结果如图1、2,结果显示以CIAV DNA为模板的LAMP扩增产生阶梯状条带,以及CIAV LAMP扩增产物的酶切结果。
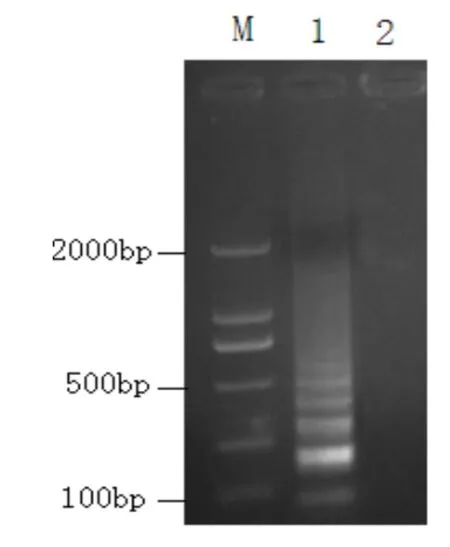
图1 鸡传染性贫血病病毒LAMP产物的电泳检测

图2 鸡传染性贫血病病毒LAMP扩增产物Pst I酶切鉴定
3.2 反应结束后,向产物中加入1μl SYBR GreenI染料,自然光下CIAV 阳性管呈绿色,而阴性管仍为染料原色橙色;紫外灯下CIAV阳性管呈现明显的荧光,而阴性管则无特异性荧光(图3)。
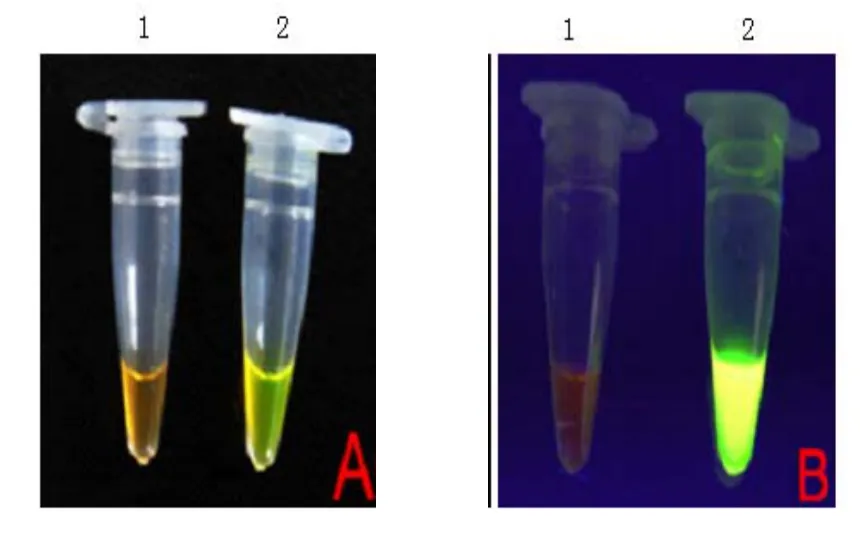
图3 鸡传染性贫血病病毒LAMP产物染色反应
3.3 LAMP检测CIAV的特异性试验 用建立的LAMP方法分别以IBDV、REV、NDV、IBV和ALV的DNA或cDNA为模板进行LAMP特异性检测,按照优化后的LAMP体系进行63℃等温扩增,取反应后的产物5μl用1.5%的琼脂糖凝胶电泳检测,结果仅以CIAV的DNA为模板可扩增出LAMP特征性梯形条带,而对照病原均为阴性(见图4),表明LAMP检测方法对CIAV的检测有良好的特异性。
3.4 LAMP检测CIAV的敏感性试验 将提取的DNA(浓度为0.245μg/ml)10倍稀释至10-4,分别进行PCR和LAMP检测(图5、6)。结果表明,LAMP能检测出最低DNA量约为0.245pg/μl,而PCR能检测出最低DNA量约为2.45pg/μl。 3.5 LAMP临床样品检测 利用PCR和LAMP分别对送检的40份样品进行检测,结果显示,PCR方法检出8份阳性,LAMP方法检出12份阳性,阳性检出率分别为20%和30%,表明LAMP方法较PCR方法更为敏感。

图4 LAMP方法检测CIAV的特异性试验
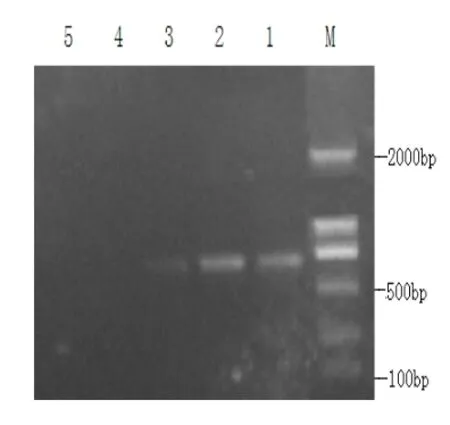
图5 PCR方法检测CIAV的敏感性试验

图6 LAMP方法检测CIAV的敏感性试验
4 讨论
(1)当前,在我国集约化程度高的大型鸡场中的鸡群中普遍存在着不同免疫抑制性病毒感染,而且不同形式的免疫抑制性疾病已对我国养鸡业特别是肉鸡生产带来很大威胁。家禽免疫抑制性病原体有很多种,除了马立克氏病毒(MDV)、传染性法氏囊病毒(IBDV)、鸡传染性贫血病毒(CIAV)外,J亚群白血病病毒(ALV-J)、网状内皮细胞增生病毒(REV)和呼肠孤病毒(Reovirus)感染机体皆可引起胸腺、法氏囊及其他淋巴细胞严重缺失[6,7],降低机体的免疫功能。其中CIAV病毒既能通过种蛋垂直传播,又可在鸡群内水平传播,对养鸡业的危害严重,为及时诊断该病,急需发展快速、灵敏、准确而且操作简便的检测技术来满足基层和现场检测的需要[8]。(2)LAMP方法在病原的诊断方面呈现出良好的应用前景,是一种新的核酸诊断技术。目前,已经开展了应用LAMP技术对多种病原微生物的检测[9,10],包括西尼罗河热病毒、日本脑炎病毒、裂谷热病毒、口蹄疫病毒等。(3)本研究建立了一种针对CIAV的LAMP快速检测方法。首先根据目的基因序列设计引物,合适的引物对于LAMP反应的成功至关重要,特异性的区域保证了反应的特异性,引物的正确结构保证了茎环结构DNA的形成和延伸。使用CIAV的DNA为模板,测试引物的扩增效率和对反应体系进行优化,Mg2+、dNTPs、Betaine和反应时间、温度都对LAMP的结果有影响。该方法敏感性高,可检测到0.2pg/μl;特异性强,对IBDV、REV、NDV、IBV和ALV等的检测结果均为阴性。应用建立的LAMP方法,对送检的临床样品进行检测,阳性检出率为30%,较普通PCR高,表明LAMP方法敏感性高。(4)本研究中LAMP方法与常规PCR检测方法相比有显著的优点,首先LAMP成本低廉,利用BstDNA聚合酶在63℃实现等温扩增,不需要昂贵的PCR仪;其次是反应迅速,可以在1h内完成反应,而一般的PCR至少需要2~3h;然后是通过反应后向产物中加入荧光指示剂,肉眼在自然光或紫外光下可直接观测结果,避免了电泳过程中的污染。(5)LAMP技术具有快速、简便、灵敏、特异,无需贵重检测设备而易普及等优点。本方法适于在基层推广、应用,在生产中发挥其应有的快速检测作用。如果进行进一步的优化和完善,该技术将会在CIAV的诊断及预防控制方面发挥巨大作用,从而为兽医临床诊断与治疗提供参考。
[1] 殷震, 刘景华. 动物病毒学. 第2版. [M]. 北京∶ 科学出社, 1997.
[2] Y.M.Saif. 高福, 苏敬良译. 禽病学. 第11版. [M]. 北京∶ 中国农业出版社, 2005.
[3] 李启明, 马学军, 周蕊等. 环介导逆转录等温扩增技术(RT-LAMP)在丙型肝炎病毒基因检测中的应用[J]. 病毒学报, 2006, 22(5)∶ 334-338.
[4] 何金林, 徐云龙, 莫国华等. LAMP技术在疾病预防控制检验中的研究进展[J]. 中国卫生检验杂志, 2010,20(12)∶ 3561-3563.
[5] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleids Acids Research, 2000, 28(12)∶ 63.
[6] 蒋玲艳, 李平, 李莉萍等. 鸡传染性贫血病毒与其他禽免疫抑制性疫病病毒混合感染[J]. 中国兽医学报, 2006, 26(6)∶ 591-594.
[7] 陆洪菊, 赵敏, 翟剑平等. 鸡传染性贫血病在我国的流行、诊断及防制[J]. 上海畜牧兽医通讯, 2005(5)∶ 54-55.
[8] 夏永恒, 杨兵, 张杰等. 2种鸡免疫抑制性疾病LAMP检测方法的建立[J]. 中国动物检疫, 2009, 26(5)∶ 29-32.
[9] Hara Kudo Y, Yoshino M, Kojima T, etal. Loop-mediated isothermal amplification for the rapid detection of Salmonella[J]. FEMS Microbiol Lett, 2005,253(1)∶ 155-161.
[10] Soliman H, EI-Matbouli M. 2006. Reverse transcription loopmediated isothermal amplification(RT-LAMP) for rapid detection of viral hemorrhagic septicaemia virus(VHS)[J]. Veterinary Microbiology, 2006, 114∶ 205-213.
S858.31
A
1007-1733(2013)10-0018-03
2013–05–29)
山东省科技发展计划(2011GNC11113);泰安市科技发展计划专项计划(20113061)
*通讯作者
