富马酸福莫特罗口腔崩解片的制备及质量评价
2013-05-25陈怡王增寿温州医学院附属第二医院药学部浙江温州325027
陈怡,王增寿 (温州医学院附属第二医院药学部,浙江 温州 325027)
富马酸福莫特罗为一新型长效选择性β2-受体激动剂(LABA),对支气管哮喘、慢性闭塞性肺疾病有效性高。目前,其剂型有片剂,干糖浆剂,干粉吸入剂。口腔崩解片作为一种新型固体速释制剂,服用时不必饮水,在少量唾液的作用下即可快速崩解,使用方便[1]。将富马酸福莫特罗制成口腔崩解片,特别适合于老年人、儿童、吞咽困难的患者及卧床体位难变动患者(如外科术后患者)用药,提高了患者的顺应性,还可提高生物利用度。本试验用正交设计优化处方,采用直接压片法制备富马酸福莫特罗口腔崩解片,并对其质量进行了初步考察。
1 材料
Agilent1100高效液相色谱系统(Agilent公司,USA);ZRS-8G智能溶出试验仪(天津天大天发科技有限公司);ZDY-8单冲压片机(上海远东制药机械总厂);富马酸福莫特罗原料药(大连美仑生物技术有限公司);富马酸福莫特罗对照品(中国食品药品检定研究院,批号100633-200401);甘露醇(Man,法国 Roquette);交联聚乙烯吡咯烷酮(PVPP,美国ISP公司);微晶纤维素(MCC,美国FMC公司)。
2 方法与结果
2.1 处方设计 参考市售富马酸福莫特罗片的规格(每片含富马酸福莫特罗40μg)。
在参照文献[2]及在预试验的基础上,确定处方由主药富马酸福莫特罗,辅料微晶纤维素、甘露醇、交联聚乙烯吡咯烷酮、甜菊素及硬脂酸镁等组成。影响口腔崩解片质量的主要因素为交联聚乙烯吡咯烷酮 (A)、甘露醇的用量(B)、微晶纤维素的用量(C),因此,采用正交设计法按L9(34)正交表设计正交试验,以口感和崩解时间为考察指标,其中沙粒感、后苦、黏膜刺激、清凉适口等进行口感评价,口感评分标准为:好(3分)、较好(2.5分)、一般(2分)、较差(1.5分)、差(1分);体外崩解时间评分标准为:<30s(3分)、31~50s(2分)、>50s(1分)。后由正交试验结果分析知影响崩解时间的主次因素以确定处方中各因素的最佳配比。优化后的正交试验因素水平见表1(用量以1 000片计),结果见表2、表3。

表1 正交试验因素水平Tab 1 Factors and levels in orthogonal test
由表2,3结果可见,因素A即PVPP对结果的影响有显著差异,3种因素的主次顺序为PVPP>MCC>甘露醇,最后确定的最佳工艺参数为:A2B2C3,即每1 000片中各成分的用量分别为:交联聚乙烯吡咯烷酮10g,甘露醇50g,微晶纤维素40g。
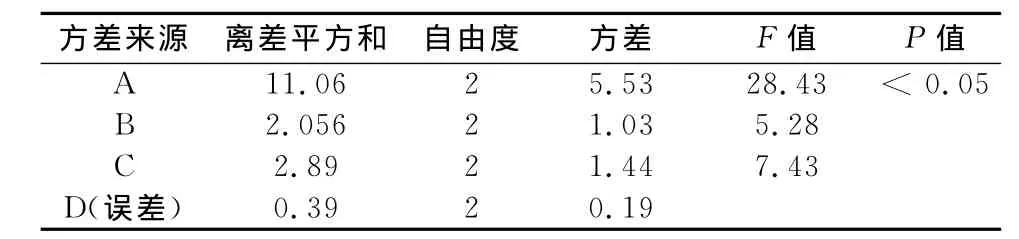
表3 方差分析Tab 3 Analysis of variance
2.2 富马酸福莫特罗口腔崩解片的制备 优化后的处方为:原料0.04g,微晶纤维素40g,甘露醇50g,交联聚乙烯吡咯烷酮10g,甜菊素1.5g,硬脂酸镁0.5g。将原辅料分别粉碎,过100目筛,按等量递加法混匀,直接压片。所得片剂为白色片,色泽均匀,表面光洁,硬度为(3±0.5)kg,每片含富马酸福莫特罗40μg。
2.3 口感检查 取自制口腔崩解片,以6名志愿者服用口腔崩解片后的主观感受来评价片剂的口感,结果表明,口腔崩解片口感良好,无沙砾感,味微甜,对口腔黏膜无刺激性。
2.4 崩解时间的测定 根据国家药品审评中心对口腔崩解片崩解时限检查要求的规定[3],并参照文献[4],自制相应的实验装置。将药片置于自制的镶有2号筛(筛孔内径约为710μm)不锈钢吊篮中,后将此装置放入装有2mL(37±0.5)℃纯化水的5mL平底烧杯中,用秒表记录时间,至药片完全崩解时停,立刻快速将吊篮提离水面,筛网上应无明显大颗粒留存;若有泡沫状黏性物质黏附于筛网表面,视为已崩解。秒表所记的时间即为体外崩解时间。测定6片,片剂的崩解时间为(21.5±1.1)s。同时让6名健康志愿者,将药物放入口腔中,用秒表记录口腔崩解片在口腔中完全崩解的时间,即为体内崩解时间,为(24.3±1.6)s。结果表明,本片剂崩解性能良好。
2.5 含量均匀度测定 参考BP 2009年版的色谱条件,建立HPLC测定富马酸福莫特罗口腔崩解片含量均匀度的方法。
2.5.1 色谱条件 色谱柱:ZORBAX SB-C18(150mm×4.6mm,5.0μg,Agilent,USA);保护柱:SBC18保护柱(12.5mm×4.6mm,5.0μg,Agilent,USA);流动相:乙腈-30mmol·L-1NaH2PO4·H2O(用85%磷酸调pH 3.1)-三乙胺(16∶84∶0.15);流速:1.0mL·min-1;柱温:35℃;检测波长:214nm;进样量:20μL。色谱图见图1(A)和图1(B)。
2.5.2 溶液的制备 对照品溶液:取富马酸福莫特罗对照品适量,精密称定,用流动相超声溶解并定量稀释制成每1mL中含2μg的溶液,用0.45μm的微孔滤膜过滤,取续滤液作为对照品溶液,备用。供试品溶液:取富马酸福莫特罗口腔崩解片20片,精密称定,研细,精密称取适量(约相当于富马酸福莫特罗20μg),置于10mL量瓶中,加流动相超声溶解,稀释至刻度,摇匀,用0.45μm的微孔滤膜过滤,取续滤液作为供试品溶液。
2.5.3 专属性试验 按处方配制不含主药富马酸福莫特罗的空白口腔崩解片,按“2.5.2”项下方法配制空白样品溶液,进样测定。色谱图显示供试品溶液的主峰与对照溶液主峰的保留时间一致,在主成分出峰的位置没有出现其他的质峰,说明此方法辅料对测定无干扰,见图1(C)。
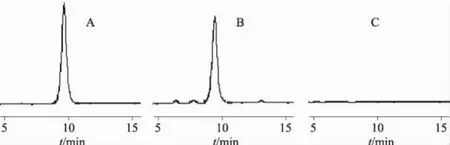
图1 HPLC色谱图A.对照品;B.样品;C.空白样品Fig 1 HPLC chromatogramsA.reference substance;B.sample;C.blank
2.5.4 线性关系 精密称取富马酸福莫特罗对照品适量,以流动相为溶剂,按“2.5.2”项下方法制成质量浓度分别为0.5,1,1.5,2.0,2.5,3.0μg·mL-1的富马酸福莫特罗对照品溶液,各精密量取20μL,注入液相色谱仪,分别记录富马酸福莫特罗色谱峰面积(A)。将峰面积(A)与各自质量浓度(C)做线性回归,经统计,富马酸福莫特罗质量浓度与峰面积线性标准曲线方程为:A=4.275×104C-1.015×103,r=0.999 5(n=6)。结果表明,富马酸福莫特罗进样浓度在0.5~3μg·mL-1范围内线性良好。
2.5.5 精密度试验 取已配制好的对照品溶液,按“2.5.1”项下条件测定,连续进样6次,以峰面积计算,RSD为0.75%,显示精密度良好。
2.5.6 稳定性试验 取供试品溶液,分别在0,2,4,6,8h进样测定,峰面积的RSD为0.91%,说明供试品溶液在8h内稳定性良好。
2.5.7 重复性试验 取富马酸福莫特罗口腔崩解片粉末适量,按“2.5.2”项下方法制备6份供试品溶液,进样测定,结果显示,含量的RSD为1.53%,表明本方法重复性良好。
2.5.8 加样回收率试验 精密称取已测知含量的富马酸福莫特罗口腔崩解片粉末(约相当于富马酸福莫特罗10μg),共12份,每4份为1组,置于10mL量瓶中,分别精密加入富马酸福莫特罗对照品溶液,按供试品溶液浓度的80%,100%,120%分别用流动相配制低、中、高3种浓度溶液各4份,按上述供试品溶液的制备方法同法操作,测得低、中、高3浓度的平均回收率分别为98.8%,100.2%,100.1%;RSD分别为0.99%,0.68%和0.72%(n=4)。
2.5.9 含量均匀度测定结果 取样品10片,每次将1片置于50mL量瓶中,加入流动相超声溶解,稀释至刻度,摇匀,用0.45μm滤膜过滤作为供试品溶液。另精密称取适量对照品,精密称定,同法配制约0.8μg·mL-1的溶液作为对照品溶液。进样20μL,以外标法计算每片含量及平均含量,按中国药典2010年版附录ⅩE含量均匀度检查法计算,A+1.80s≤15.0。3批含量均匀度的测定结果分别为7.35,6.95,8.19,均小于15.0。结果表明,此口腔崩解片含量均匀度符合中国药典规定。
2.6 分散均匀性检查 正交试验中我们发现,各处方崩解后均呈细粉分散或溶解在溶液中,且溶液及细粉均可在1min内通过2号筛。因此,处方和制备工艺对口腔崩解片分散均匀性的试验结果无显著影响。
3 讨论
本试验采用粉末直接压片法制备富马酸福莫特罗口腔崩解片,选择合适的崩解剂是控制质量的关键。本试验选用的优良崩解剂PVPP在片中分散均匀,通过芯吸和毛细管作用等增加整个片剂的吸水性,遇水能使其迅速进入片剂内部,促使网络结构膨胀而产生崩解作用。MCC是亲水性的辅料,具有海绵状多孔管状结构,可以促进水分进入片剂内部,并具有优越的可压性,因此用作口腔崩解片的稀释剂和助崩解剂。制剂中主药量与辅料量相差悬殊,在采用递加稀释法混粉的基础上多次过筛,以保证含量均匀。
结果表明,制备的富马酸福莫特罗口腔崩解片外观、口感良好,体内外崩解时限,含量均匀度等均符合要求。
[1]Sastry SV,Nyshadham JR,Fix JA.Recent technological advances in oral drug delivery-a review[J].Pharm Sci Technol Today,2000,3(23):138-145.
[2]王翠欣,滑千里,刘福利,等.硫酸沙丁胺醇口腔崩解片的制备及质量评价[J].中国当代医药,2010,17(8),113-115.
[3]国家食品药品监督管理局.口腔崩解片的剂型特点和质量控制会议纪要:CDE审评四部[EB/OL].[2011-05-28].http:www.cde.org.cn/dzkw.do?method=largepage&id=1383.
[4]姚方耀,刘欢,刘衡,等.口腔崩解片体外崩解评价方法探讨[J].中国药学杂志,2007,42(4):276-279.
