无患子丛生芽诱导及植株再生研究
2013-05-24林杰冯永涛陈民良刘希华邢建宏
林杰,冯永涛,陈民良,刘希华,邢建宏
(三明学院资源与化工学院,福建三明365004)
无患子丛生芽诱导及植株再生研究
林杰,冯永涛,陈民良,刘希华,邢建宏
(三明学院资源与化工学院,福建三明365004)
以无患子叶片为外植体,通过正交试验,研究无患子叶片愈伤组织诱导、愈伤组织诱导丛生芽、芽苗生根以及植株再生的最佳培养基组成,并对试验数据进行极差分析和方差分析。结果表明:诱导出叶片愈伤组织的最佳培养基是MS+0.5 mg·L-1TDZ+0.4 mg·L-12,4-D+6.0 mg·L-1AgNO3,诱导率为86.4℅。诱导丛生芽的最佳培养基是MS+0.5 mg·L-1NAA+1.0 mg·L-1TDZ,分化率为42.5℅。诱导生根的最佳培养基是1/3 MS+0.5 mg·L-16-BA+0.5 mg·L-12,4-D,生根率为45℅。
无患子;愈伤组织;丛生芽;植株再生
无患子(sapindus mukorossi Gaerth.)也叫肥皂树或洗手果,为无患子科无患子属落叶乔木,在我国华南等地多有栽培[1]。无患子为一种多功能植物,其种皮提取物是重要的化工原料,可制成纯天然洗涤产品[2],还可作为优良的农药乳化剂[3]。无患子的种仁含油率高达40.7%,是生产生物柴油的理想原料[4]。此外,无患子树形优美,是优良的园林绿化树种[5]。无患子具有巨大的潜在经济价值,市场需求量大,但低效的种苗繁育技术是制约其产业化开发的瓶颈。
无患子长期以来以种子实生繁殖为主,造成后代变异较大,筛选出的优良个体的性状很难保持。同时,扦插、嫁接等无性繁殖技术繁殖系数较低,很难满足生产需求,因此,摸索无患子组培快繁技术有重要意义。关于无患子的组织培养研究已有一些报道。张凤龙[6]等利用茎段作为外植体,进行了无患子组织培养的初步研究,获得了完整的茎芽苗;陈光蓉[7]等利用多因子正交试验研究了无患子愈伤组织诱导的条件,筛选出了无患子叶片愈伤组织诱导的培养基;周倩[8]等研究了无患子愈伤组织诱导与芽苗增殖的培养基配方。上述研究仅开展了摸索无患子以芽繁芽、叶片愈伤组织诱导的条件,尚未进行由叶片愈伤组织诱导分化丛生芽,进而完成植株再生的研究。本研究旨在筛选出以无患子叶片为外植体,通过诱导叶片愈伤组织,利用愈伤组织分化丛生芽,进而再生成完整植株的技术,为其快速无性繁殖以及以叶片为受体的外源基因转化和种质保藏提供技术参考。
1 材料与方法
1.1 外植体采集与消毒
以笔者所在的课题组在三明地区筛选出的无患子优树为材料,在连续3 d晴天后摘取幼嫩叶片若干,装入烧杯中,加入一定量的洗衣粉和纯水,搅拌浸泡30 min,之后用纯水洗净,再加入多菌灵溶液浸泡30 min,然后洗净叶片并用流动的水冲洗3 h左右,再用75%的酒精消毒30 s,0.1%的升汞消毒9 min,最后用无菌水冲洗5次。
1.2 无患子愈伤组织诱导
以MS为基本培养基,附加不同质量分数的TDZ、2,4-D和AgNO3,培养基pH为5.8,琼脂9.0 g·L-1,蔗糖30 g·L-1。培养基经121℃高压灭菌20 min后使用。采用L9(34)正交试验设计进行叶片愈伤组织诱导试验,试验设计见表1。每瓶接种1个外植体,大小为0.5 cm2。每个处理30瓶,重复3次。接种后的外植体置于光强1800 lx,光照12h·d-1,温度(27±1)℃的环境中培养,4周后统计诱导率。
1.3 无患子丛生芽诱导
采用L9(34)正交试验设计,对NAA、TDZ和KT 3个因素进行优化,设计见表2,每瓶1个愈伤组织块,每个处理30瓶,重复3次,8周后统计诱导率。
1.4 无患子丛生芽生根
L9(34)正交设计优化无患子丛生芽生根的最佳培养基组成,其因素与水平见表3。每瓶接种1个芽苗,每个处理30瓶,重复3次。4周后统计生根情况。
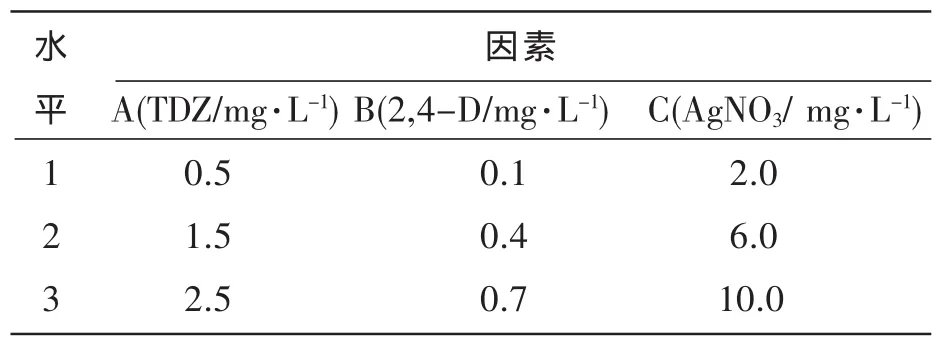
表1 愈伤组织诱导的因素与水平
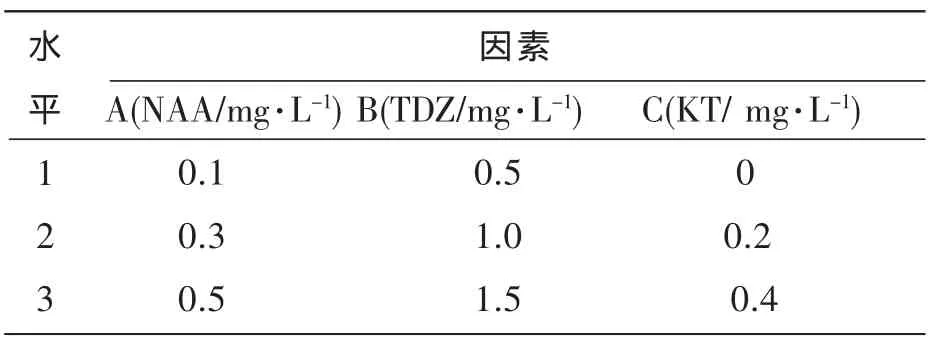
表2 丛生芽诱导的因素与水平
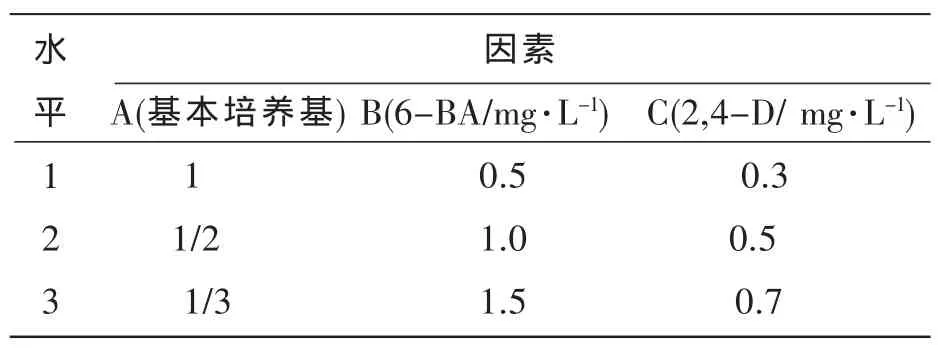
表3 诱导生根的因素与水平
2 结果与分析
2.1 无患子愈伤组织诱导
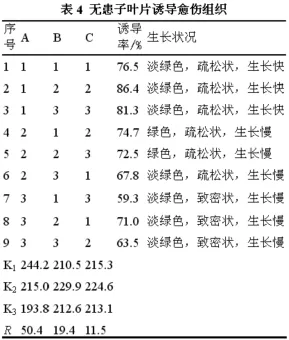
无患子叶片接种7 d之后,伤口处出现愈伤组织(如图1-A所示),28d之后,淡绿色颗粒状愈伤组织把整个叶片覆盖住(如图1-B所示)。诱导情况见表4。由表4可知,所有组合均能不同程度地诱导出愈伤组织,但不同培养基的诱导率和愈伤组织生长速度有差异,其中在1、2、3、6、7、8、9号培养基上,愈伤组织淡绿色,7、8、9号培养基上,愈伤组织致密状;在4、5、6、7、8、9号培养基上,愈伤组织生长慢,在1、2、3号培养基上,愈伤组织生长快。2号培养基愈伤组织诱导率最高,为86.4℅,7号培养基愈伤组织诱导率最低,为59.3℅。
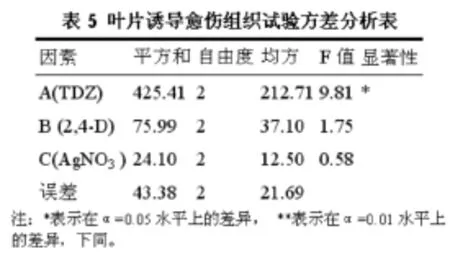
试验结果的极差分析显示,A因素(TDZ浓度)对愈伤组织的诱导率影响最显著,C因素(AgNO3浓度)对愈伤组织的诱导效果影响较小,B因素(2,4-D浓度)的影响居中,3个因素的最佳组合为A1B2C2。可见,诱导无患子叶片愈伤组织的最佳培养基组成为:MS+0.5mg·L-1TDZ+0.4mg·L-12,4-D +6 mg·L-1AgNO3。
对正交试验结果的方差分析见表5,结果表明TDZ浓度对愈伤组织的诱导影响明显,而其它两个因素的作用不显著。
2.2无患子丛生芽诱导
将已经诱导出来的愈伤组织切成若干块接种于含有不同浓度NAA、TDZ和KT的培养基上,30 d后,愈伤组织分化出芽,芽粗壮,茎节长,而且分枝形成丛生状(如图1-C所示),没有分化的愈伤组织逐渐褐变,最后死亡。丛生芽诱导情况见表6。
由表6可知,8号培养基上丛生芽的诱导率最高,为42.5℅,4号培养基上丛生芽的诱导率最低,为10℅。极差分析表明,3个因素的对丛生芽的诱导效果的影响大小依次为B→A→C,最优组合为A3B2C1。愈伤组织诱导丛生芽的方差分析列于表7。
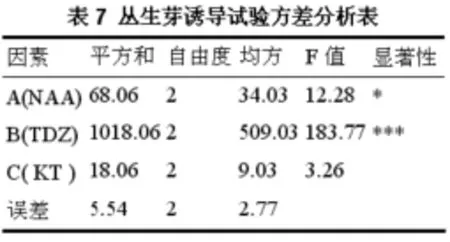
从表7中可以看出,TDZ对丛生芽的诱导有极显著影响,NAA对丛生芽诱导的影响达显著水平,KT的影响不显著。同时,试验结果还显示,分化率高的组合分化出芽的愈伤组织数目和平均每块愈伤组织分化出芽的数目也多。综上所述,MS+0.5 mg·L-1NAA+1.0 mg·L-1TDZ是无患子愈伤组织诱导丛生芽的理想培养基。
2.3 无患子丛生芽生根
将分化完全的丛生芽单个分离转接于生根培养基中,3周后,芽体基部开始分化出白色的不定根(如图1-D所示),30d之后,不定根分化达到高峰。无患子芽苗生根情况见表8。
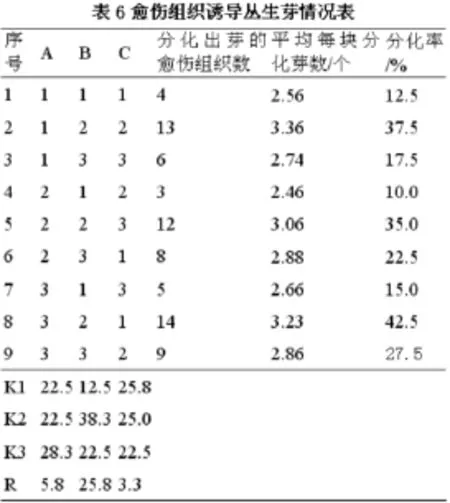
由表8可知,9个试验处理中生根率、生根条数、根长度和最早生根时间也各不相同,其中7号处理生根率最高,为45%,6号处理生根率最低,为27.5%。生根率高的组合其生根条数较多,相同天数根长度较长,生根时间较短。极差分析结果表明,3个因素对生根率的影响大小各不相同,6-BA浓度对生根率的影响较大,而MS浓度和2,4-D浓度对生根率影响不大。
对生根诱导正交试验的方差分析结果(表9)显示,6-BA对芽苗生根影响最显著,基本培养基和2,4-D这两个因素影响不显著,上述试验结果表明,最优的生根培养基组成为A3B1C2,综上所述,诱导丛生芽生根的最佳培养基是1/3 MS+0.5 mg·L-16-BA+0.5 mg·L-12,4-D。生根后的芽苗继续培养2个月后获得完整的组培苗(如图1-E所示)。
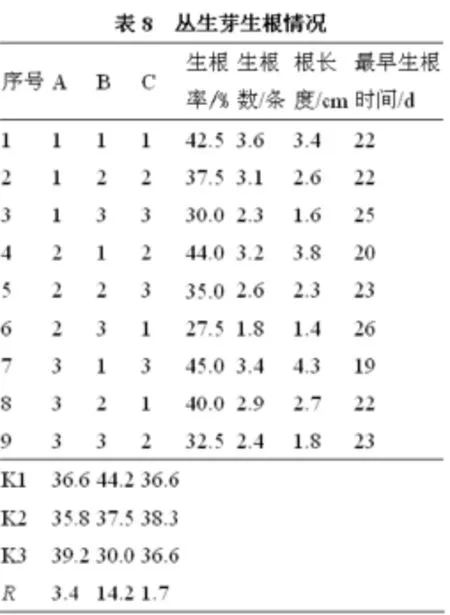
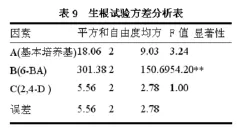

图1 无患子植株再生过程
3 讨论
外植体的选择对于植物的离体快繁尤为重要,无患子的快繁可采用茎段微扦插、种胚萌发和叶片诱导体胚或丛生芽等。试验采用无患子叶片诱导丛生芽实现植株再生,能够有效地利用原材料。在无患子组织培养试验中,TDZ浓度增加不利于培养物的生长发育,这与刘淼等[9]得出低浓度的TDZ更适合牛皮杜鹃组培苗叶片愈伤组织的诱导和分化的结果一致。试验发现6.0 mg·L-1AgNO3对于愈伤组织的诱导有一定的促进的作用,过高或者过低都会对其产生抑制作用。
在无患子的组织培养中,丛生芽诱导与增殖是一个十分关键的步骤,在提高芽增殖倍数的基础上方能实现快繁。MS是木本植物组织培养的常用基础培养基,无机盐浓度相对偏高,就会对植株生长起到副作用。MS中大量元素含量的减少不利于无患子叶片的丛生芽诱导培养,这与前人在雷公藤愈伤组织诱导丛生芽中的结果相一致[10]。对愈伤组织的生长而言,只需要低浓度NAA,但对愈伤组织的诱导作用却因物种而异。KT对无患子丛生芽的诱导无显著影响,这与周倩等[13]在诱导无患子愈伤组织试验中得到的结论不一致,这可能是因为所选的外植体不同引起的。
生根是无患子快繁过程中较难操作的一个环节,其中在根数上很难突破,从试验中可以看出,大部分生根试验仅出1~2条根。从试验结果可知,1/3MS与0.5 mg·L-16-BA和0.5 mg·L-1的2.4-D配比最适于丛生芽生根培养,MS中所含的大量元素过高、6-BA和NAA浓度的增加均不利于根的分化与生长,这与同科的龙眼茎段培养中的结果相一致[11]。
本研究摸索出了利用无患子叶片经愈伤组织途径进行植株再生的培养基配方,也为今后利用其它器官进行无患子植株再生提供了参考。但本研究仅从培养基配方对丛生芽分化、增殖与生根的条件进行了优化,愈伤组织及继代增殖效率还不够高,离工厂化繁育尚有距离,如何优化其它培养条件以获得更高的分化、增殖与生根效率还需要进一步研究。
[1]中国科学院中国植物志编委会.中国植物志:47卷[M].北京:科学出版社,1989.
[2]黄彦勋.神奇天然肥皂—无患子[J].现代中医药,2006(2):54-56.
[3]孙洁如,陈孔常,周鸣方,等.无患子表面活性物及其复配体系的性质研究[J].日用化学工业,2002,32(4):16-18.
[4]贾黎明,孙操稳.生物柴油树种无患子研究进展[J].中国农业大学学报,2012,17(6):191-196.
[5]徐启定.无患子的生态功效和利用价值[J].安徽林业,2010,15(3):64-68.
[6]张凤龙.无患子组织培养研究[J].山地农业生物学报,2005,24(2):119-123.
[7]陈光蓉,殷家明,张凤龙.无患子愈伤组织诱导的多因子正交试验研究[J].生物技术,2007,17(1):78-81.
[8]周倩,刘飞,吴雪莲,等.无患子组培过程中愈伤组织诱导和芽苗增殖的培养基配方研究[J].西南农业学报,2012, 25(4):1382-1387.
[9]刘淼,曹后男,许雪,等.TDZ对牛皮杜鹃叶片分化及继代增殖的影响[J].西北农业学报,2012,21(12):158-162.
[10]毛玲榕,刘希华,邢建宏.雷公藤愈伤组织诱导与悬浮培养不定芽诱导[J].三明学院学报,2010,27(6):577-580.
[11]王家福,何壁珠.龙眼茎尖的培养[J].福建农业大学学报,2000,29(1):23-26.
Study on Induction of Multiple Shoot and Plantlet Regeneration of Sapindus mukorossi Gaerth
LIN Jie,FENG Yong-tao,CHEN Min-liang,LIU Xi-hua,XING Jian-hong
(School of Resources and Chemical Engineering,Sanming University,Sanming 365004,Chian)
The best mediums of the callus induction,multiple shoot induction,rooting and plant regeneration were studied by orthogonal design with using the leaves of Sapindus mukorossi Gaerth.as materials in this paper,and the experimental data were analyzed by range analysis and variance analysis.The results showed that the best culture medium for inducing callus from the leaves of Sapindus mukorossi Gaerth.is MS supplemented with 0.5 mg·L-1TDZ+0.4 mg·L-12,4-D+6 mg·L-1AgNO3,with an induction rate of 86.4%.The best culture medium for inducing multiple shoot is MS supplemented with 0.5 mg·L-1NAA+1.0 mg·L-1TDZ,and induction rate of 42.5%.The best culture medium for inducing rooting is 1/3 MS+0.5 mg·L-16-BA+0.5 mg·L-12,4-D,and induction rate is 45%.
Sapindus mukorossi Gaerth;orthogonal design callus;multiple shoot;plantlet regeneration
Q943.1
A
1673-4343(2013)04-0083-05
2013-06-21
国家大学生创新创业训练计划项目(201211311012);福建省质量工程建设项目(ZL1001/JT(sj))
林杰,男,江苏徐州人,大学生;通讯作者:邢建宏,男,陕西宝鸡人,讲师。研究方向:林业与生物技术研究。
