4种重金属对参环毛蚓金属硫蛋白诱导特性的研究Δ
2013-05-22李维李薇吴文如王绪新广州中医药大学广州50006宜都市中医医院药剂科湖北宜昌443300
李维,李薇,吴文如#,王绪新(.广州中医药大学,广州 50006;.宜都市中医医院药剂科,湖北 宜昌 443300)
参环毛蚓Pheretima aspergillum(E.Perrier)来源于钜蚓科环毛蚓属,是2010年版《中国药典》(一部)所收载的广地龙药材的原动物。广地龙虽被公认为品质最佳的地龙药材,但常因重金属超标而严重影响其临床用药安全[1]。为了解决这一质量难题,笔者团队曾对诱导养殖条件下参环毛蚓体内的重金属含量进行过实验研究,结果表明,蚓体与土壤中Pb和Cd存在浓度依赖关系[2]。这与国内外学者已确认的某些蚓体具有重金属富集作用的结果一致[3]。有研究表明,金属硫蛋白(MTs)能与Ag、Cu、Hg、Pb、Cd、Zn等重金属稳定结合[4],是蚯蚓吸收、蓄积、运转、排泄重金属的最主要解毒方式[3]。参环毛蚓是否存在相同的诱导特性和解毒机制则一直有待验证。为此,笔者采用银饱和分析法测量了蚓体内MTs的含量,该法能够灵敏地反映出生物体内MTs水平的变化[5]。其原理就是通过饱和Ag竞争性替换体内与MTs结合的某金属,从而计算出该金属诱导的MTs的含量。借此探讨不同重金属对参环毛蚓诱导产生的MTs的相关特性。
1 材料
1.1 仪器
RC5 CPWS型高速冷冻离心机(美国Bio-Rad公司);876-2型真空干燥箱(上海锦屏仪表有限公司);AEG-220型电子分析天平(日本岛津公司);THZ-D型台式恒温振荡器(太仓市实验设备厂);JENA novAA400型石墨炉火焰原子吸收光谱仪(德国Analytik Jena公司)。
1.2 试剂
牛血红蛋白(广州威佳生物科技公司);甘氨酸(广州奇华盛生物技术有限公司,纯度>99.5%);Pb(NO3)2、CdCl2、ZnSO4、CuSO4、CaCO3、Tris、盐酸(1.19 g/ml)、硝酸(1.42 g/ml)、氢氟酸(1.15 g/ml)、高氯酸(1.67 g/ml)、2.5%硝酸,均购于广州新生试剂公司,所有试剂除硝酸为优级纯外,其余均为分析纯;水为去离子超纯水。
1.3 土壤(养殖基质)
工业石英砂(30~40目、80~100目)购于广州绎丰研磨材料商行;苔藓土(pH为6~7)采自广州芳村花鸟市场。参考经济合作与发展组织(OECD)有关蚯蚓急毒研究中人工土壤的配制方法配制人工土壤[6]:工业石英砂69%(含30~40目20%,80~100目80%),苔藓土10%,CaCO31%,每组处理总质量1500 g。
1.4 动物
蚯蚓购自广东博罗广地龙规范化养殖基地,部分在广东省野外采集,经广州中医药大学李薇教授鉴定为广地龙原动物参环毛蚓P.aspergillum(E.Perrier)。选择性成熟、环带明显的样品,于人工养殖箱(50 cm×50 cm×50 cm)适应性饲养1周,备用。
2 方法
2.1 诱导条件与溶液的制备
分别将 CdCl2、CuSO4、Pb(NO3)2、ZnSO4晶体溶于去离子水,参照《中华人民共和国国家标准土壤环境质量标准》(GB 15618-1995)中各级土壤中重金属浓度配制金属离子浓度,每个养殖箱中加入溶液量为125 ml。人工土壤中的金属诱导浓度见表1。

表1 人工土壤中的金属诱导浓度Tab 1 Inducing concentration of metals in artificial soil
制备0.5mol/L的甘氨酸溶液,以5mol/L的NaOH调pH值至8.5。制备1000mg/L的Ag标准贮备液:称取AgNO30.1575 g,溶于适量水中,加3 ml浓硝酸溶液全部溶解后定容至100 ml棕色量瓶中,4℃遮光贮藏。再制备9.27 mmol/L的AgNO3溶液,使每1 ml溶液含1000 μgAg+,于棕色瓶中避光贮藏。试验时,用上述甘氨酸缓冲液稀释Ag+至20 μg/ml,贮藏于棕色瓶中,立即使用;将牛血红蛋白溶于上述甘氨酸溶液中,配成2%(V/V)溶液。
2.2 试验步骤
2.2.1 参环毛蚓MTs提取液的制备 参环毛蚓先在未加金属诱导液的人工土壤中适应性饲养1周,再加入不同浓度金属诱导液。30 d后,将养殖于其中的参环毛蚓取出,冼净后放在湿滤纸上,吐泥(24 h使之排出体内污物),乙醇麻醉后解剖,分离外部肌肉和内脏,分别加入等体积Tris-盐酸(0.01mol/L,pH8.6),匀浆,4℃过夜抽提,10000 r/min离心30 min,取上清80℃加热5min,12000r/min离心20min,取上清加-20℃预冷的乙醇至乙醇质量分数为85%,-20℃过夜沉淀,10000 r/min离心30 min,取沉淀溶于0.02 mo1/L的Tris-盐酸中,10000 r/min离心10 min,取上清用0.02 mo1/L的Tris-盐酸定容至2 ml,得到外部肌肉和内脏的MTs提取液样品。-20℃贮藏,备用。
2.2.2 银饱和分析法处理样品供试液 取0.2 ml蚯蚓MTs提取液于1.5 ml离心管中,加入0.6 ml甘氨酸缓冲液,混合均匀,室温放置5min;加入20μg/ml的Ag+溶液0.5ml,室温放置5 min;加入100 μl血红蛋白溶液,混合均匀;80℃水浴 5 min,然后置于冰水浴中5 min。室温下1200 r/min离心5 min,再加入100 μl血红蛋白溶液混合均匀;重复上一步骤,最终体积为1.5 ml;将上清转移至另一1.5ml离心管中,15000r/min离心5 min,取上清,备用。
2.2.3 原子吸收法测定用样品的消化 取样品供试液1 ml于聚四氟乙烯烧杯中,加3 ml硝酸和2 ml水,在电热板上加热至90~95℃。加热至供试液近干时,取下,放冷,再加入3 ml硝酸,加盖于95℃加热回流,必要时继续加硝酸,至消解完全(消解液透亮,回流颜色不再发生变化),继续加热至近干,然后用热2.5%硝酸溶液洗涤烧杯壁,溶解沉淀和残渣并转移至10 ml棕色量瓶中,最后用2.5%硝酸溶液定容。
2.3 标准曲线的制备
2.3.1 仪器工作条件 按照JENA novAA400原子吸收光谱仪的使用说明书,调节仪器至最佳工作状态。按仪器操作规程测定待测液的质量浓度和吸光度。原子吸收光谱仪工作条件见表2。

表2 原子吸收光谱仪工作条件Tab 2 Working conditions of atomic absorption spectrometer
2.3.2 Ag标准溶液的原子吸收工作曲线 将Ag标准贮备液逐级稀释成0.10、0.20、0.40、0.60、0.80、1.00 mg/L的系列标准溶液,测量吸光度。以质量浓度(x)为横坐标,吸光度(y)为纵坐标,进行线性回归,得回归方程为y=0.001310+0.198979 x(r=0.9994),特征质量浓度为0.02191 mg/L。结果表明,Ag的质量浓度在0~1.10 mg/L范围内与其吸光度呈良好线性关系。Ag标准溶液的原子吸收工作曲线见图1。
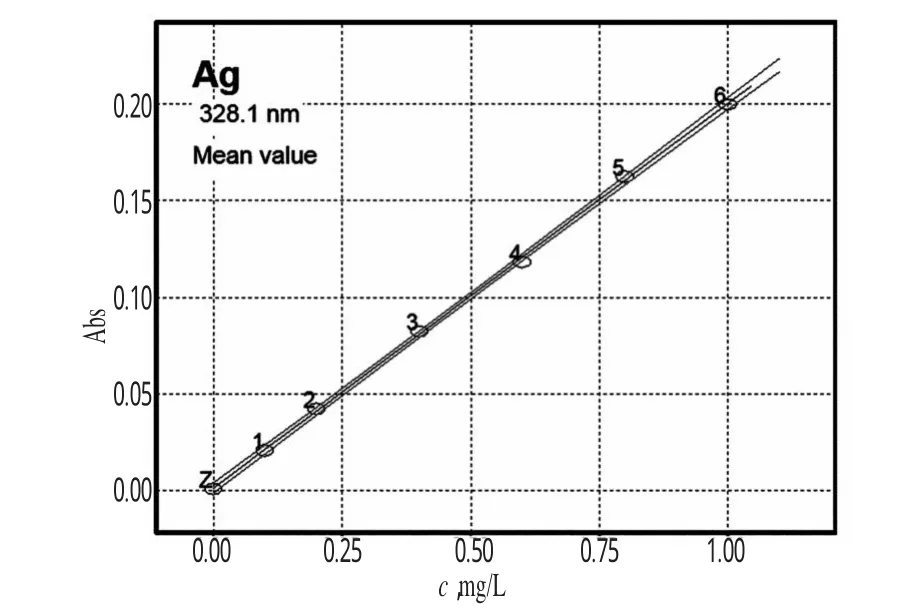
图1 Ag标准溶液的原子吸收工作曲线Fig 1 Atomic absorption curves of standardAg solution
2.3.3 精密度试验 精密吸取质量浓度为0.4 mg/L的Ag标准溶液进行10次平行测定,测得平均值为0.4006 mg/L,RSD=0.494%(n=10),表明方法精密度良好。
2.3.4 加样回收率试验 在样品中加入Ag标准溶液,进行回收率测定,结果见表3。

表3 加样回收率试验结果(n=10)Tab 3 Results of recovery tests(n=10)
3 结果
MTs含量与Ag的质量浓度在最终上清液中成正比,按照MTs与Ag的结合方式,可以推算出最终MTs的含量。张保林等[7]运用该方法对博霖饮品中MTs含量进行测定,研究表明银饱和分析法对测量MTs具有很高的准确性和重现性。该法推算原理如下[8]:理论上每分子MTs可以结合20个Ag+,但研究中往往实际结合量偏低,这是由于氧化造成分子间和分子内形成了二硫键。对兔肝Zn MTs或Cd MTs结合Ag+的研究表明,1 mol MTs的蛋白饱和量为17~18 mol Ag+,1 μg Ag+结合3.55 μg MTs。因此,样品中MTs的含量计算公式为:
式中,cAg+为最终上清液中Ag+的质量浓度;cBKG为空白样品最终上清液中的读数;VT和SV分别为最终总体积和加入样品液体积。
本研究用甘氨酸溶液制备成Ag+浓度分别为0.5、1.0、1.5、2.0、2.5 ppm的标准液,以原子吸收法测定吸光度,得到Ag标准曲线;MTs质量浓度对应Ag吸光度在一定范围内成线性关系,最适测量范围为5~20 μg/ml。样品MTs含量=5.65×102 A(Ag),相关系数f=0.999。式中,A为吸光度,在MTs质量浓度大于20 μg/ml时需先进行适当稀释。样品中MTs含量见表4。

表4 样品中MTs含量(n=5)Tab 4 Contents of MTs in samples(n=5)
使用SPSS16.0统计软件对不同组别数据按照α=0.01水平进行t检验。结果表明,同一重金属不同浓度间诱导MTs无统计学差异;对于同一重金属不同部位的诱导,Cu诱导的肌肉和内脏中的MTs浓度无统计学差异,而Cd、Zn、Pb组别均有统计学差异,表现为Cd和Pb诱导的MTs在内脏中表达较多,而Zn诱导的MTs则主要在肌肉中表达较多。
4 讨论
研究表明,重金属在蚯蚓体内的分布主要有两种方式:通过表皮的被动扩散与肠道的主动蓄积;对于主动蓄积的重金属,其主要蓄积部位集中在肠道、肾管和前列腺而不在肌肉和体壁[9]。蚯蚓体内本身存在低水平的MTs,在经过重金属的诱导后能够产生大量的MTs表达。因此,采用本研究方法,根据MTs含量在蚯蚓体内的分布,可推测重金属在蚯蚓体内的代谢轨迹。
本研究中,Cd、Pb诱导的MTs量在内脏中均明显较肌肉中多,显示参环毛蚓对Cd、Pb具有主动蓄积的效应。其中,Cd的诱导浓度远低于其他金属,但诱导的MTS总量与其他金属诱导总量相近,可见Cd对MTs的诱导能力最强。本实验按照国家土壤质量标准所设置的Cd高、中、低浓度之间诱导的MTs量差别不大,在这种情况下,蚯蚓本身个体差异因素可能会造成低浓度蓄积量高于高浓度的情况。而Cu在肌肉与内脏中诱导的MTs量相近,表明Cu在蚯蚓体内的分布呈均匀状态,其主动蓄积的能力并不明显。而对于Zn,蚯蚓具有明显的体内代谢作用。
本研究结果也表明,在国家土壤标准这一较低浓度重金属环境下,参环毛蚓受同一金属不同浓度诱导,其MTs表达差异并不明显,而且Cd、Pb和Zn之间的诱导能力差异也不明显。因此,在考察参环毛蚓MTs受重金属诱导的应激特性时,应首先摸索参环毛蚓在不同重金属中的长期最高耐受浓度,以此为基准,设立对数级别差异的浓度差,以考察其MTs表达量的差异。
银饱和分析法是基于Ag与MTs的高亲合力及MTs的对热稳定性,通过原子吸收法测定与MTs结合的Ag+含量,从而推算出MTs含量的方法。Ag对MTs的结合能力远高于一般金属,且该方法对不同的金属离子不具有偏向性,因此能用于经不同重金属诱导的MTs的准确定量。研究显示,银饱和分析法可用于测定含量范围较广的MTs,尤其适合于测定低质量浓度的MTs,最低限为1µg/ml[10]。本研究建立的银饱和分析法,不需要预先将MTs从样品中分离纯化,不需要特殊的仪器,不易受样品及操作中O2的影响,可以对样品中的MTs直接测定,具有简便、快速、准确的优点。
[1]李薇,肖翔林,吴文如.药用动物重金属富集作用的利与弊[J].中国药房,2007,18(12):954.
[2]李薇,沈克,杨洁瑜,等.广地龙对重金属富集特性的初步研究[J].中药材,2007,30(5):519.
[3]Wimmer U,Wang Y,Georgiev O.Two major branches of anti-cadmium defense in the mouse:MTF-1/metallothioneins and glutathione[J].Nucleic Acids Res,2005,33(18):5715.
[4]JE Morgan,AJ Morgan.The accumulation of metals(Cd,Cu,Pb,Zn and Ca)by two ecologically contrasting earthworm species(Lumbricus rubellus and Aporrectodea caliginosa):implications for ecotoxicological testing[J].Applied Soil Ecolo,1999,13(1):9.
[5]王达,葛刚,吴兰,等.金属硫蛋白(MTs)的分离纯化与检测技术[J].江西科学,2004,22(1):61.
[6]OECD.OECD guidelines for the testing of chemicals[S].1998:207.
[7]张保林,盛湘蓉,刘兴军,等.金属硫蛋白测定方法——银饱和分析法[J].药物生物技术,1996,3(1):31.
[8]Abelson JN,Simon MI.Methods in Enzymology[M].New York:Academic Press,1991:205.
[9]Morgan AJ,Sturzenbaum SR,Winters C,et al.Differential metallothionein expression in earthworm(Lumbricus rubellus)tissues[J].Ecotoxicol Environ Saf,2004,57(1):11.
[10]田晓丽,郭军华.金属硫蛋白的研究进展[J].国外医学药学分册,2005,3(2):119.
