内皮型一氧化氮合酶基因G894T多态性与老年钙化性心瓣膜病的关系
2013-05-17侯冰心程永红张美红毛拥军
侯冰心,胡 松,程永红,张美红,毛拥军
(青岛大学医学院附属医院特需保健科,青岛 266003)
老年钙化性心瓣膜病(senile calcific valve disease,SCVD)又称老年退行性心瓣膜病(senile degenerated heart valvular disease,SDHVD),是一种与年龄相关、以瓣膜钙化为主要特点的心瓣膜疾病,主要累及主动脉瓣和二尖瓣,尤以主动脉瓣的主动脉面病变较多、程度较重,是引起老年人心律失常、心力衰竭、甚至猝死的原因之一[1,2]。有研究显示,SCVD的发生有家族聚集性及遗传倾向[3]。既往研究显示,载脂蛋白E基因、维生素D受体基因等与SCVD的发生有关[4,5]。近年来发现,在主动脉瓣表面有内皮细胞表型,与主动脉瓣心室面相比,主动脉面的内皮细胞表型较多,且其分布程度与钙化严重程度成正相关[6]。内皮型一氧化氮合酶(endothelial nitric oxide syntheses,eNOS)由内皮细胞表达,对心血管疾病发生有重要作用[7]。本研究利用基因芯片技术及病例对照研究流行病学方法,探讨eNOS G894T多态性与SCVD的相关性,为其病因学研究、防治提供依据。
1 对象与方法
1.1 对象
选择2010年至2011年青岛大学医学院附属医院特需保健科就诊患者,经心脏超声检查确诊为瓣膜退行性变65岁以上的SCVD患者132例,其中男77例,女55例,年龄范围65~92(79.2±6.3)岁;选择无瓣膜钙化65岁以上的患者 108例作为对照,其中男52例,女56例,年龄范围65~90(78.0±6.1)岁。
排除标准:风湿性心瓣膜病,先天性心瓣膜疾病,感染性心瓣膜疾病,严重心、脑、肾疾病,多脏器功能衰竭,甲状腺、甲状旁腺疾病,骨质疏松,慢性肾功能不全,恶性肿瘤以及其他影响钙磷代谢的疾病和药物作用。
1.2 方法
1.2.1 病史采集、体格检查及生化指标测量 就诊当日进行既往病史、吸烟史、用药史等询问。对身高、体质量、血压等进行测量,计算体质量指数(body mass index,BMI)。
次日清晨于安静状态下取平卧位抽取空腹血,应用日立7600-210全自动生化分析仪检测空腹血糖(fasting blood glucose,FBG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。
1.2.2 心脏超声检查 全部病例由 GE Vivid7彩色多普勒心脏超声仪(美国GE公司)进行心脏超声检查。探头频率为3.5MHz。患者取左侧卧位或仰卧位,行胸骨旁左室长轴、心尖四腔、心尖五腔、胸骨旁短轴等常规切面进行探测。观察各心腔大小、室壁厚度、活动度、收缩及舒张功能,瓣膜形态、厚度、回声强弱、运动情况,并运用彩色、脉冲或连续多普勒测量各瓣口血流流速及压差。有瓣膜狭窄者用描记法测量瓣口面积。
超声心动图诊断瓣膜钙化的标准[8]:瓣膜或瓣环厚度≥2.0~3.0mm,伴有回声增强(回声强度大于同切面主动脉根部后壁回声强度),瓣叶僵硬,活动度减低,无瓣膜交界处粘连和融合。
1.2.3 eNOS基因多态性测定 BaiO-BE系列基因芯片检测仪、BE-2.0生物芯片识读仪(上海百傲科技有限公司),PCR扩增仪(德国 Eppendorf AG 22331 Hamburg)。抽取受检者肘静脉血 2~3ml,乙二胺四乙酸(EDTA)抗凝,充分混匀。
基因多态性测定方法同文献[9],低渗法裂解红细胞,分离白细胞,饱和酚/氯仿法抽提白细胞基因组DNA,加Tirs-EDTA液(TE)溶解DNA,―20℃保存。利用PCR扩增eNOS基因的特异片段,PCR反应体系为25∶l,反应条件为94℃热启动5 min,再94℃变性25s,56℃退火25s,72℃延伸25s,反复40个循环,最后72℃延伸5min,进而冷却至4℃。在杂交仓中将基因芯片与PCR扩增产物混匀杂交,加入显色溶液,后置于BaiO基因生物芯片识读仪上检测,检测结果由图像 Array Doctor软件自动分析生成,最后检测出eNOS G894T多态性。
1.3 统计学处理
应用SPSS17.0统计软件,组间人群基因分布应用 Hardy-Weinberg平衡检验,以P>0.05表明样本具有群体代表性。计量资料采用±s表示,组间均数比较应用t检验。基因型及等位基因的频率采用直接计数法,定性资料组间差异比较应用c2检验。采用二分类多因素logistic回归分析各因素与SCVD之间的关系。
2 结 果
2.1 SCVD组与对照组之间基因频率分布
对SCVD组与对照组中eNOS G894T基因型分布进行基因多态性遗传平衡检验。结果显示,两组的基因型分布符合 Hardy-Weinberg遗传平衡定律(P>0.05),本研究选取样本具有群体代表性。
2.2 基线特征比较
选取的132例瓣膜钙化的受检者中,65岁以上 9例,70岁以上 58例,80岁以上 59例,90岁以上6例;108例对照组中,65岁以上9例,70岁以上 56例,80岁以上 41例,90岁以上 2例。两组年龄、男女比例差异无统计学意义,两组间有可比性。
SCVD组合并各瓣膜病变情况:单纯主动脉瓣钙化69例(52.3%),主动脉瓣合并二尖瓣钙化53例(40.2%),单纯二尖瓣钙化10例(7.6%)。
2.3 SCVD组与对照组 eNOS G894T突变位点基因型及等位基因分布频率
SCVD组GG基因型101例,GT基因型23例,TT基因型8例,T等位基因频率14.8%;对照组GG基因型98例,GT基因型7例,TT基因型3例,G等位基因频率94.0%。因对照组TT基因型较少,故将GT与TT合并一项进行统计。结果显示,SCVD组GT+TT基因型、T等位基因频率均明显高于对照组,差异有统计学意义(基因型c2=8.486,P=0.004;等位基因c2=9.425,P=0.002;表1) 。
2.4 二分类多因素logistic回归分析
将是否有瓣膜钙化作为二分类因变量,eNOS G894T多态性、年龄、性别、吸烟史、高血压病史、高血脂病史、冠心病病史、糖尿病病史及血压、血糖、血脂等作为自变量进行逐步logistic回归分析,结果显示eNOS G894T多态性、TC、LDL-C、FBG水平、BMI、收缩压水平以及高血压病史、冠心病病史、高血脂病史均与SCVD相关,差异有统计学意义(P<0.05),为SCVD的危险因素。性别、吸烟、舒张压水平、TG水平等,虽然两组频数或均数统计有差别,但经logistic回归分析,差异无统计学意义(P>0.05),不是SCVD的危险因素(表2)。
3 讨 论
随着社会发展和人口老龄化,SCVD发病率逐年上升,更成为国外老年人群中(>65岁)瓣膜置换的首要原因[1]。随着我国人口老龄化,患病率也呈逐年上升趋势,且随年龄增长而增加。刘丽等[2]在对北京地区军队老年人群SCVD的流行病学研究中提示:高血压、脑卒中、高血脂、家族史是SCVD显著的危险因素。因此,对SCVD病因研究也已成为近些年心血管热点之一。研究显示,SCVD不仅是与年龄相关的不可逆退行性变,与机械压力、内皮损伤、炎症反应、脂质沉积、RAAS系统的激活、骨化反应、钙质沉积等过程相关[10]。另分子生物学研究发现,其发病机制还与基质金属蛋白酶、血管内皮细胞生长因子、转化生长因子-β1、Wnt、Nocth1信号通路等有关[11]。
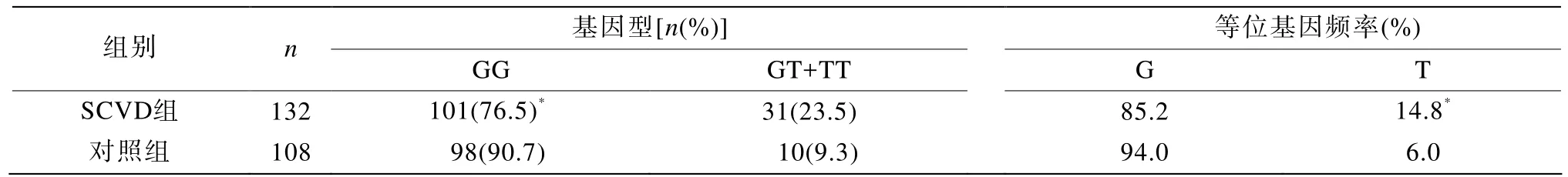
表1 SCVD组与对照组eNOS G894T突变位点基因型及等位基因分布频率Table 1 Comparison of eNOS G894T genotype and allele frequency between case group and control group
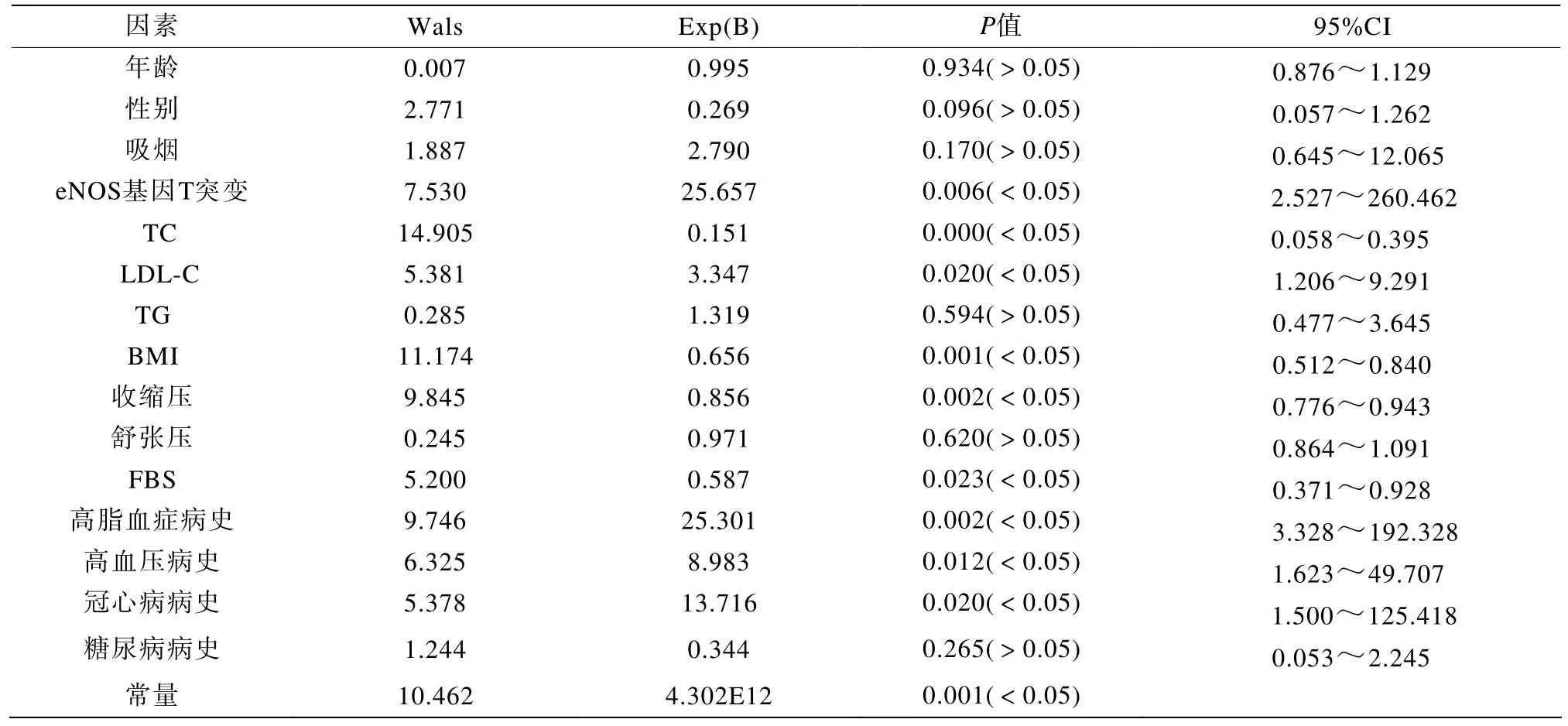
表2 SCVD组与对照组多因素logistic回归分析Table 2 Binary logistic regression analysis
关于SCVD发病机制的探究近年来逐渐深入至基因水平。Probst等[3]在对法国西部地区流行病调查中发现,退行性主动脉钙化存在家族聚集性。这为SCVD可能为基因遗传病提供理论依据。Novaro等[4]在对802位超声诊断为钙化性瓣膜病的患者分析中发现,载脂蛋白E基因(apolipoproteinE,apoE)与SCVD相关,apoE2/4和apoE3/4基因型在钙化性主动脉狭窄(calcified aortic stenosis,CAS)中更为常见,apoE4等位基因是主动脉狭窄的有意义的独立预测指标,这一结果在校正年龄、性别、冠状动脉疾病、LDL-C等因素后仍有意义。Ortlepp等[5]的一项病例对照研究证实,维生素D受体基因多态性与CAS存在相关性,其中维生素D基因中的B等位基因在CAS患者中的基因频率高于对照组。以上研究表明SCVD可能是一种与遗传相关的疾病。
Simmons等[6]在对正常猪主动脉瓣膜的组织病理学研究中发现,与主动脉瓣心室面相比,主动脉面的内皮细胞表型较多,且其分布程度与钙化严重程度呈正相关。有报道称,内皮细胞参与到血管钙化的启动过程中,血管钙化时内皮细胞、间充质细胞和造血干细胞相互作用且对机械刺激、炎症、代谢发生反应,激活骨形态发生信号,这些因素相互作用,在骨髓导致骨矿化,在动脉壁则导致血管钙化[12]。以上研究提示,钙化性心瓣膜病的发生可能与内皮功能有关。一氧化氮合酶目前分为三种亚型:神经型一氧化氮合成酶、诱生型一氧化氮合成酶iNOS、eNOS。其中eNOS主要在血管内皮细胞表达,并在心血管疾病中具有重要作用。国外学者发现,在主动脉瓣上同样有eNOS的表达,其主要通过合成NO发挥扩张血管、抑制血管平滑肌细胞增生、抗血小板聚集和抗炎、抗氧化以及抑制血管紧张素Ⅱ等多种生物学作用[7]。eNOS基因多态性中,G894T等位基因携带者动脉粥样硬化的易感性高。本研究显示,SCVD组eNOS G894T基因,GT、TT基因型频率高于对照组,且T等位基因频率高于对照组,提示eNOS G894T多态性可能与为SCVD的发病有关,其具体作用机制尚不清楚,可能与RAAS系统激活、炎症-损伤反应、NO保护作用减弱、Ca2+增加及脂质的易沉积性等途径相关。同时logistic回归分析发现eNOS G894T多态性、TC、LDL-C、FBG、BMI、收缩压水平以及高血压病史、冠心病病史、高血脂病史等因素为老年钙化性心瓣膜病的相关危险因素,与文献报道大体一致[2,3]。
综上所述,本研究结果表明,eNOS G894T多态性与SCVD关系密切。但是由于SCVD多为老年患者,存在多病性、不典型性等特点,该病影响因素较多,与其他心血管疾病存在交叉病理过程,临床筛选病例统一性较差,以及人种差异等影响,目前关于SCVD的病因学研究存在一定争议,对于该病基因学的相关研究还需有进一步大样本量的临床流行病学研究证实,具体作用机制还需要进行更加详细缜密的研究。
[1]Vaishnava P,Fuster V,Goldman M,et al. Surgery for asymptomatic degenerative aortic and mitral valve disease[J].Nat Rev Cardiol,2011,8(3): 173-177.
[2]刘 丽,赵玉生,王士雯,等. 北京地区军队老年人群退行性心脏瓣膜病流行病学研究[J]. 中华流行病学杂志,2006,27(10): 836-839.
[3]Probst V,Le Scouarnec S,Legendre A,et al. Familial aggregation of calcific aortic valve stenosis in the western part of France [J]. Circulation,2006,113(6): 856-860.
[4]Novaro GM,Sachar R,Pearce GL,et al. Association between apolipoprotein E alleles and calcific valvular heart disease[J]. Circulation,2003,108(15): 1804-1808.
[5]Ortlepp JR,Hoffmann R,Ohme F,et al. The vitamin D receptor genotype predisposes to the development of calcific aortic valve stenosis[J]. Heart,2001,85(6): 635-638.
[6]Simmons CA,Grant GR,Manduchi E,et al. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves[J]. Circ Res,2005,96(7): 792-799.
[7]Colombo MG,Paradossi U,Andreassi MG,et al. Endothelial nitric oxide synthase gene polymorphisms and risk of coronary artery disease[J]. Clin Chem,2003,49(3): 389-395.
[8]Baumgartner H,Hung J,Bermejo J,et al. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice[J]. Eur J Echocardiogr,2009,10(1):1-25.
[9]李晓明,陈洪军,毛拥军. 内皮型一氧化氮合酶G894T基因多态性与冠状动脉病变的关系[J]. 中国老年学杂志,2011,10(31): 3683-3686.
[10]Li YB,Hu CL,Liu J,et al. Calcific aortic valve disease should not be considered as a degenerative disease anymore[J]. Med Hypotheses,2007,68(6): 1233-1235.
[11]Hakuno D,Kimura N,Yoshioka M,et al. Molecular mechanisms underlying the onset of degenerative aortic valve disease[J]. Mol Med,2009,87(1): 17-24.
[12]唐朝枢,齐永芬. 关注血管钙化发病新机制的研究[J]. 中国医学前沿杂志(电子版),2010,2(3): 5-8.
