陈化烟叶表面可培养寡营养菌多样性分析
2013-04-29何家亨等
何家亨等

摘要:通过低浓度营养培养基分离4种不同陈化烟叶表面的微生物,经过连续2~4周的培养,共获得55株不同的菌株,通过16S rDNA扩增和测序进行初步的分子鉴定后,进行BLAST比对分析,挑选每个菌株最大一致性的同源菌株16S rDNA序列一起进行系统聚类分析。结果表明, 陈化烟叶中微生物存在着广泛的多样性,每种烟草中都拥有自己独特的微生物菌群,存在大量的兼性寡营养菌,专性寡营养菌较少,而且烟叶的品种和等级直接影响到微生物的种群和数量。
关键词:陈化烟叶;寡营养菌;细菌多样性;16 S rDNA序列;聚类分析
中图分类号:TS41+4 文献标识码:A 文章编号:0439-8114(2013)06-1292-06
烟叶在制成成烟之前需要经过漫长的陈化期,烟叶陈化是卷烟工业的一种初加工方法。当年收获的新烟叶,其品质都存在不同程度的缺陷,不宜直接用于制造卷烟,必须进行陈化处理[1]。在陈化发酵过程中,烟叶主要化学成分发生变化,青、杂气和刺激性大大减轻,香气显露,气味醇和,色泽均匀并加深[2]。烟叶表面的微生物发酵作用,对烟叶的陈化起着重要的作用。新烟叶在经过漫长的陈化阶段后,烟叶的品质进一步得到改善,有害物质的含量也随着降低。这个时期一般需要2~3年,如何缩短这个时期一直是科研工作者的研究热点[1,3-5]。
烟叶表面含有丰富的微生物已有大量研究报道,如Zhao等[6]通过非纯培养的方法对多种不同陈化时期的烟叶表面微生物进行了研究,采用16S rDNA PCR-DGGE技术进行多样性分析发现,早期陈化阶段各种烟叶拥有相似的优势微生物种群结构,主要有5种细菌,其中3种为未培养微生物。Huang等[7]通过RLFP 技术构建OTUs(Operational taxonomic units)克隆文库比较陈化与非陈化烟叶细菌多样性发现,在陈化的烟叶中存在大量的未培养微生物。韩锦峰等[8]通过对未发酵、自然陈化及人工发酵期间的烤烟叶面微生物进行分离、鉴定,并对不同发酵时期微生物进行动态研究,结果表明,未发酵烤烟叶面微生物数量最多,但是随着自然陈化及人工发酵的进行,叶面微生物数量均逐渐减少,且以芽孢杆菌属(Bacillus)和梭状芽孢杆菌属(Clostridium)为优势种群。朱大恒等[9]研究也发现烤烟中以芽孢杆菌和梭状芽孢杆菌为优势种群。而且大量研究表明烤烟叶面微生物中,细菌占绝对优势,放线菌和霉菌较少,细菌中以芽孢杆菌属为优势菌群,霉菌中以曲霉为优势菌群。优良品种烤烟叶面微生物的数量较大,种类也较多。因此研究不同烟草表面的微生物多样性具有重要意义。
寡营养菌概念提出时没有特指哪一类的微生物[10]。直到1979年,Kuznetsov等[11]才提出了寡营养菌是特指那些第一次培养时可以在含碳浓度为1~15 mg/L培养基中生长的细菌,并把它分为两类,一类为在寡营养和富营养条件下均能生长的细菌,称为兼性寡营养菌;另一类为只能在寡营养培养基中生长的细菌,称为专性寡营养菌。科研工作者现在已经从多种生境中分离到了寡营养菌,它广泛存在于海洋、湖泊、河流、土壤甚至饮用水中。Arthur[12]指出了寡营养菌营养偏好的原因,Button等[13]则研究了它对营养物质利用的动力学机制,发现寡营养菌的米氏常数较低,对营养物质的亲和力大于富营养菌,因而在寡营养条件下能够获得竞争优势。国内关于寡营养菌的研究起步晚,报道得也少。潘惠霞等[14]通过分离新疆沙漠中寡营养菌并对其在防风固沙方面进行研究发现,一些寡营养菌产生的胞外多糖能够对沙粒产生粘连作用。和振花等[15]对极地海水中寡营养菌多样性进行了研究。
目前尚没有研究烟叶中寡营养菌的报道,根据以往关于陈化烟叶表面微生物分离和多样性的报道推测,在漫长的陈化过程中,尤其是对于烟草品质提升有关键作用的中后期,可利用的简单营养物质几乎消耗殆尽,大部分菌株死亡,只有寡营养菌株才有可能生长。随着陈化时间的延长,烟草的等级就越高,品质就越好,最后起作用的主要是寡营养菌。因此,研究陈化烟叶中寡营养菌的多样性,对于解释传统的陈化作用如何利用微生物来改善烟叶品质有着十分重要的意义。此次试验尝试利用寡营养培养基对陈化烟叶表面的可培养寡营养菌进行分离和多样性研究。
1 材料与方法
1.1 材料
1.1.1 烟叶样品 2010年的广西百色烤烟K326 C3F等级,湖北恩施烤烟云85 C3F等级,湖北恩施烤烟云85 B3F等级,湖北宜昌马里兰烟马里兰1号中部一级。
1.1.2 培养基 DNG固体培养基:TSB 15 mg,去离子水100 mL,pH 7.0,121 ℃灭菌30 min。DNG液体培养基:TSB 15 mg, Gellan agar 1.5 g,CaCl2溶液37.5 μmol/L,去离子水100 mL,pH 7.0,121 ℃灭菌30 min。LB固体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂粉15 g/L。
1.2 方法
1.2.1 材料的预处理 取适量的烟叶在无菌条件下剪碎,用100 mL去离子水浸泡10 min,在摇床上200 r/min振荡20 min。利用无菌纱布过滤,取滤液,然后离心去上清,用1 mL无菌水重悬。
1.2.2 陈化烟叶中菌株的分离与筛选 取100 μL滤液进行10倍梯度稀释,稀释液涂布DNG固体平板,并用封口膜或者一次性PE手套密封,于25 ℃培养2~4周,每隔3 d观察1次,将获得的单菌落进行分区划线进一步分离与纯化。将已获得纯培养的菌株接种于LB固体培养基中,观察菌落的生长状态。
1.2.3 陈化烟叶中分离菌株的16S rDNA分子鉴定 提取已获得纯培养菌株的总DNA[16],采用16S rDNA通用引物[17]进行PCR扩增,正向引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物为1492R: 5′-ACGGCTACCTTGTTACGACTT-3′。按如下条件进行PCR扩增:94 ℃、5 min;94 ℃、30 s,54 ℃、30 s,72 ℃、90 s,30个循环;72 ℃、7 min。PCR产物采用凝胶纯化试剂盒纯化,纯化步骤参照试剂盒说明书进行。纯化的PCR产物送上海桑尼生物科技有限公司进行测序,测序结果进行BLAST同源比对。
1.2.4 不同烟叶分离寡营养菌的系统聚类分析 将每种烟叶所分离寡营养菌的16S rDNA序列进行BLAST比对分析,挑选每个菌株最大一致性的同源菌株的16S rDNA序列一起利用软件Clustal W 2.0和MEGA 5.1进行聚类分析,构建系统进化树。
1.2.5 专性寡营养菌的鉴别 将筛选出的菌株再次在富营养培养基中培养,不能生长的为专性寡营养菌;能生长的菌株,为了排除污染的可能性,将可以生长的菌株进一步用寡营养培养基培养,能在寡营养培养基生长的为兼性寡营养菌。
2 结果与分析
2.1 广西百色烤烟K326 C3F等级可培养寡营养菌的分离与16S rDNA系统进化分析
通过利用寡营养和长期培养的方法,从该烟叶中共分离出12株菌株,具体见表1。利用Clustal W 2.0和MEGA 5.1进行聚类分析,构建系统进化树如图1所示。从图1可以看出,在C3F等级陈化烟叶中一共存在10个菌属,它们分别为泛菌属(Pantoea)、假单胞菌属(Pseudomonas)、微杆菌属(Microbacterium)、古氏库特菌属(Kurthia gibsonii)、不动杆菌属(Acinetobacter)、副球菌属(Paracoccus)、法氏沃氏菌属(Wautersiella falsenii)、微小杆菌属(Exiguobacterium)、微球菌属(Micrococcus)和类芽孢杆菌属(Paenibacillus)。通过1.2.5的方法发现菌株C3F18只能在寡营养培养基生长,由此可以看出在此种陈化烟叶中只有C3F18为可培养的专性寡营养菌,其他菌株均为兼性寡营养菌株。
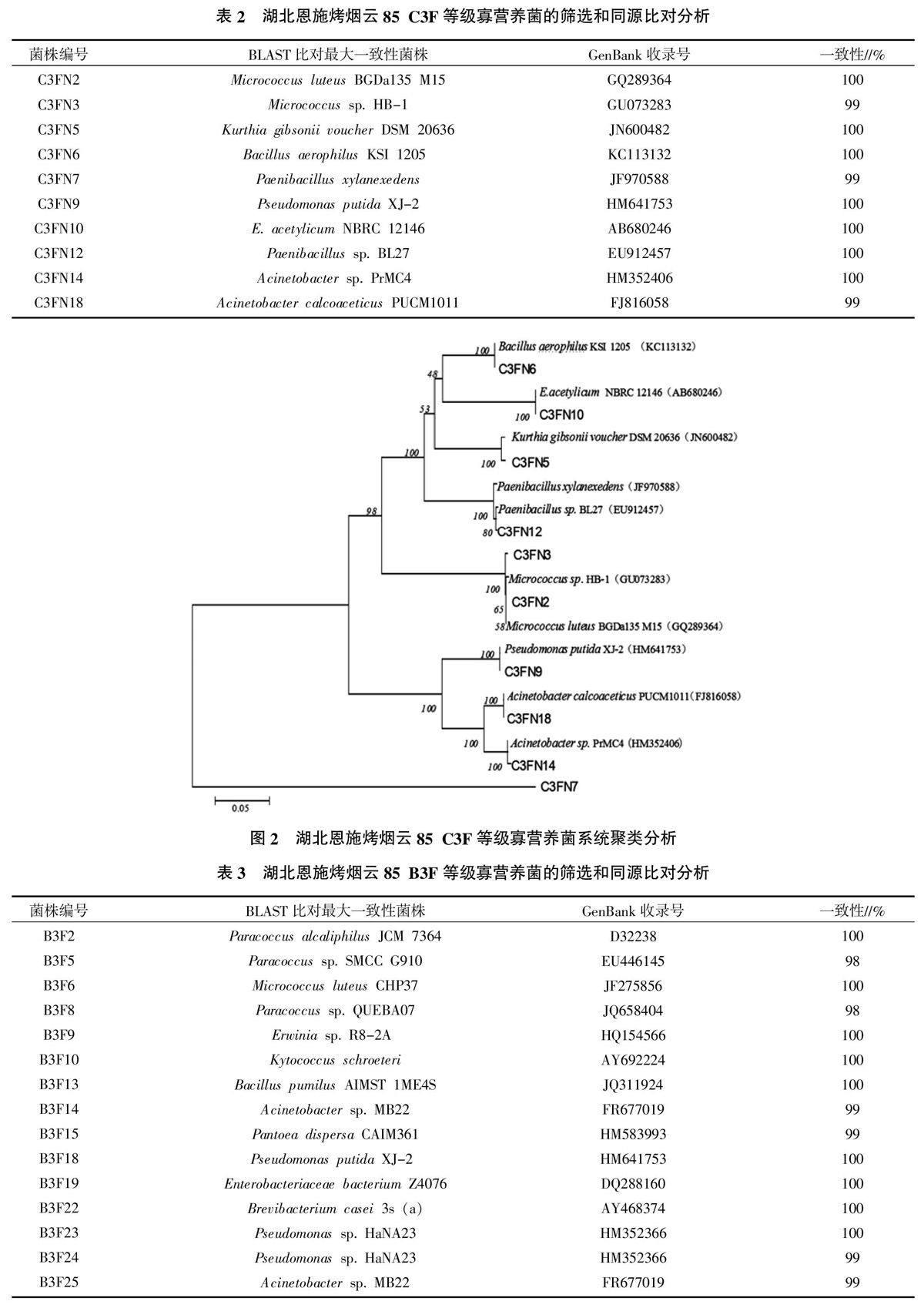
2.2 湖北恩施烤烟云85 C3F等级可培养寡营养菌的分离与16S rDNA系统进化分析
通过利用寡营养和长期培养的方法,从该烟叶中共分离出10株菌株,具体见表2。利用Clustal W 2.0和MEGA 5.1进行聚类分析,构建系统进化树如图2所示。从图2可以看出,在恩施云85 C3F等级陈化烟叶中一共存在7个菌属,分别为假单胞菌属、古氏库特菌属、微小杆菌属、微球菌属、类芽孢杆菌属、不动杆菌属和芽孢杆菌属。C3FN7和C3FN18只能在寡营养培养基中生长,由此可以看出在此种陈化烟叶中只有C3FN7和C3FN18为可培养的专性寡营养菌,其他的菌株均为兼性寡营养菌株。
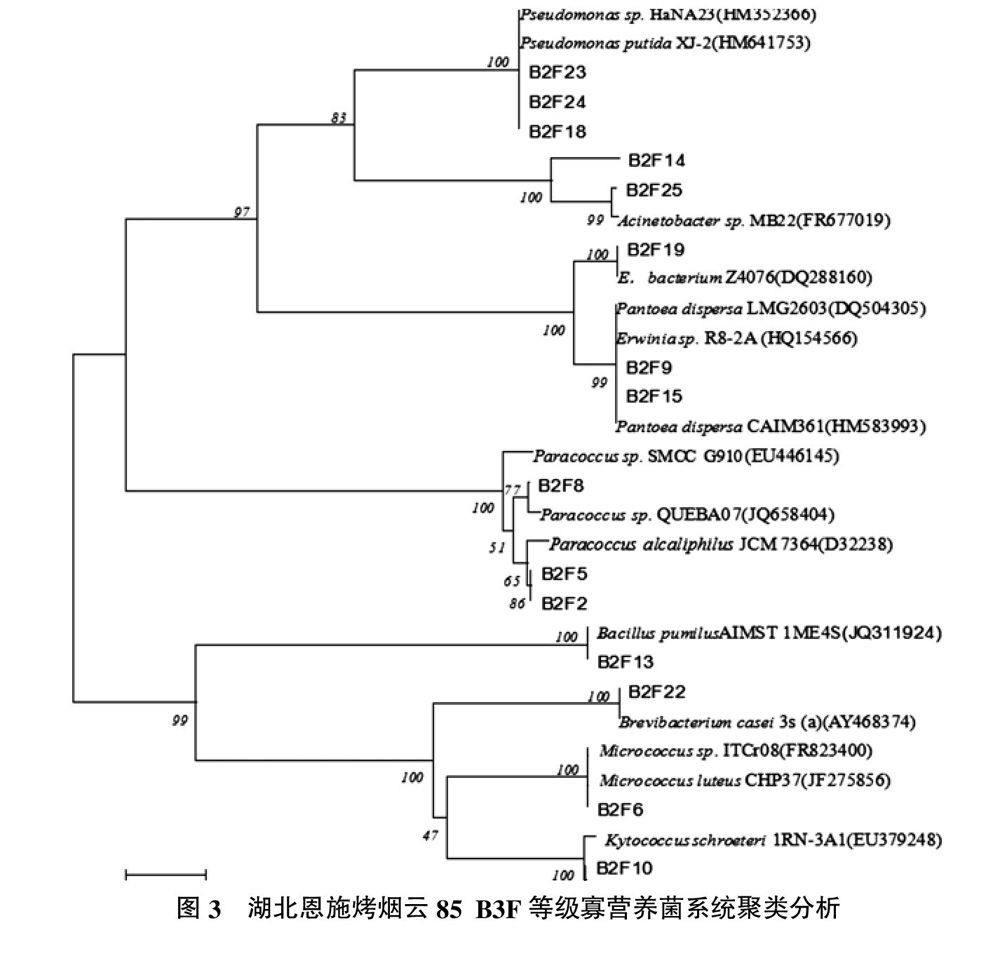
2.3 湖北恩施烤烟云85 B3F等级可培养寡营养菌的分离与16S rDNA系统进化分析
通过利用寡营养和长期培养的方法,从该烟叶中共分离出15株菌株,具体见表3。利用Clustal W 2.0和MEGA 5.1进行聚类分析,构建系统进化树如图3所示。从图3可以看出,该种陈化烟叶中一共存在10个属,分别为副球菌属、微球菌属、假单胞菌属、不动杆菌属、肠杆菌属(Enterobacter)、节杆菌属(Brevibacterium)、欧文氏菌属(Erwinia)、盖球菌属(Kytococcus)、短小芽孢杆菌属(Bacillus pumilus)以及泛菌属。分离的菌株都能在富营养培养基上生长,可见从此种烟草中分离的均为兼性寡营养菌。
2.4 湖北宜昌马里兰烟马里兰1号中部一级可培养寡营养菌的分离与16S rDNA系统进化分析
通过利用寡营养和长期培养的方法,从该烟叶中共分离出18株菌株,具体见表4。利用Clustal W 2.0和MEGA 5.1进行聚类分析,构建系统进化树如图4所示。从图4进化树中可以看出,该种陈化烟叶中一共存在10个属,它们分别为假单胞菌属、短波单胞菌属(Brevundimonas)、醋酸杆菌属(Acetobacter)、法氏沃氏菌属、副球菌属、微球菌属、盖球菌属、考克氏菌属(Kocuria)、鞘脂杆菌属(Sphingobacterium)、类香菌属(Myroides)。菌株M10和M32只能在寡营养培养基中生长,由此可以看出在此种陈化烟叶中有2种可培养的专性寡营养菌。
3 讨论
由于寡营养菌独特的生态功能,对于减少烟叶中有害物质,提高烟叶的经济价值,增加烟农收入,改善烟草存储条件,改善吸烟者的健康状况都有重要的意义。通过分离这4种烟叶的寡营养菌,结合烟叶本身的特色,发现微生物的多样性和烟叶的品种和质量有一定的内在联系,例如湖北恩施烤烟云85中的B3F和C3F两个等级烟叶中的Kytococcus schroeteri和Bacillus pumilus以及Enterobacteriaceae bacterium为湖北恩施烤烟云85中独特的微生物,又因为B3F的物质含量多些,对应的微生物种类也相应多些。而4种烟叶中由于马里兰烟叶与其他烤烟烟叶有着明显不同,微生物种类一是数量上多于其他三类,种类上也和其他三类差异很大,这一是因为马里兰烟叶本身的香气物质不一样,物质种类有差异,物质分解后产物也有差异,二是马里兰烟叶在凉棚中晾制,产生微生物也会更多。
参考文献:
[1] 汤朝起,许建铭,张 俊,等.烟叶自然陈化研究进展及设想[J].中国烟草科学,1999,20(3):17-19.
[2] 周冀衡,朱小平,王彦亭,等. 烟草生理与生物化学[M].合肥:中国科学技术大学出版社,1996.463-487.
[3] 刘维涓,杨伟祖,包德修,等.高压静电场用于烟叶陈化处理的研究[J].中国烟草科学,2003,24(1):11-14.
[4] 钱 卫,田 敏,李丽莉,等.烤烟叶面微生物5种水解酶的产生、温度稳定性及其在烟叶人工陈化中的应用[J].山东大学学报(理学版),2006,41(5):155-160.
[5] 张俊松,徐玉琼,张常记,等.超高压条件下烟叶含水率对香味成分的影响[J].中国烟草科学,2008,29(6):24-29.
[6] ZHAO M Q, WANG B X, LI F X, et al. Analysis of bacterial communities on aging flue-cured tobacco leaves by 16S rDNA PCR-DGGE technology [J]. Appl Microbiol Biotechnol, 2007,73:1435-1440.
[7] HUANG J W, YANG J K, DUAN Y Q, et al. Bacterial diversities on unaged and aging flue-cured tobacco leaves estimated by 16S rRNA sequence analysis[J]. Appl Microbiol Biotechnol, 2010,88:553-562.
[8] 韩锦峰,朱大恒,刘卫群,等.陈化发酵期间烤烟叶面微生物活性及其应用研究[J].中国烟草科学,1997,18(4):13-14.
[9] 朱大恒,陈 锐,陈再根,等.烤烟自然醇化与人工发酵过程中微生物变化及其与酶活性关系的研究[J].中国烟草学报,2001, 7(2):26-30.
[10] VAL H S, SAMANTHA B J, ROBERT W H. Eutrophication of freshwater and marine ecosystems[J]. Limnol Oceanogr,2006,51(1):351-355.
[11] KUZNETSOV S I, DUBINIA G A, LAPTEVA N A. Biology of oligotrophic bacteria [J]. Ann Rev Microbiol,1979,33 (3):377-387.
[12] ARTHUR L K. Oligotrophs and copiotrophs[J]. Bioessays,2001,23(7):657-661.
[13] BUTTON D K, SCHUT F, QUANG P, et al. Viability and isolation of marine bacteria by dilution culture: Theory, procedures and initial results[J]. Appl Environ Microbiol, 1993, 59(1):881-891.
[14] 潘惠霞,程争鸣,张雪梅,等.干旱荒漠区寡营养细菌及其生态特性的研究[J].中国科学D辑:地球科学,2006,36(增刊II):119-125.
[15] 和振花,杨季芳,陈吉刚,等.北极海水中可培养寡营养细菌多样性[J].海洋湖沼通报,2011(4):58-67.
[16] MILLER D N,BRYANT J E,MADSEN E L,et al.Evaluation and optimization of DNA extraction and purification procedures for soil and sediment samples[J]. Appl Environ Microbi,1999,65:4715-4724.
[17] LANE D J. 16S/23S rRNA sequencing[A].STACKEBRANDT E, GOOD F M. Nucleic acid techniques in bacterial systematic[C].Chichester:Wiley,1991.115-175.
