锌离子对脂多糖作用下大鼠腹膜间皮细胞转分化的影响及机制
2013-04-26张秀丽,梁单,樊怡等
腹膜透析(PD)是慢性肾脏病一体化治疗的主要替代治疗方法之一。腹膜纤维化是维持性腹膜透析患者常见的严重并发症,是各种原因导致腹膜问题的最终转归,是导致腹膜结构改变和超滤功能丧失,致使患者退出PD的主要原因之一[1]。无论是反复发生的腹膜炎,还是非生物相容性的PD液或PD液在加热处理过程中产生的降解产物,都是引起腹膜纤维化的常见原因[2,3]。脂多糖(LPS)是革兰阴性菌细胞壁的裂解成分,是该类细菌的主要致病因素之一。腹膜间皮细胞(PMC)是腹膜发挥透析作用的主要细胞群,在调节腹膜功能,抑制炎症和纤维化方面起关键作用[4]。近年研究发现,以高糖为主的PD液、多种炎症细胞因子等可导致PMC发生向肌纤维母细胞的转分化(EMT),是PMC发生纤维化的早期阶段。大量的研究表明,机体必需微量元素锌(Zn)是机体多种酶的必需组分或激活因子,参与多种信号通路的传导,具有抗炎、抗纤维化、抗氧化应激的作用[5,6]。本实验旨在研究Zn对LPS诱导的大鼠腹膜间皮细胞(RPMCs)的EMT的影响,从而为Zn在PD中的应用提供理论基础。
材料与方法
材料
实验动物 清洁级SD雄性大鼠,体重120~160 g,由中国医科大学实验动物中心提供。
主要试剂 DMEM/F12干粉培养基和胎牛血清(美国GIBCO)、胰蛋白酶、兔抗大鼠肌动蛋白α(α-SMA)、脂多糖粉剂(美国Sigma)、逆转录试剂盒(杭州博日)、兔抗大鼠核因子κB(NF-κB)、NF-κB抑制蛋白(I-κB)、磷酸化NF-κB(p-NF-κB)、磷酸化I-κB(p-I-κB)、上皮钙黏素(E-cadherin)、Ⅰ型胶原蛋白(Collagen Ⅰ)抗体(Santa-Cruz)。
方法
大鼠腹膜间皮细胞的原代培养,传代与鉴定 局麻后无菌取大鼠大网膜,在PBS中洗去红细胞,然后用含0.125%胰蛋白酶、0.01%EDTA的PBS液消化(37℃) 20~25 min,之后弃去消化液再加入胎牛血清(FBS)终止消化,吹打收集消化下来的单个细胞, 4℃下离心(800 r/min,5 min),得到细胞团,用DMEM/F12培养液(含青霉素、链霉素100 U/ml及20% FBS) 重悬细胞,接种于25 cm2的培养瓶中,在CO2孵箱中培养24h后首次换液,以后每2~3d换液1次。待细胞融合达80%时传代,用PBS 洗1次后,加0.125%胰蛋白酶2 ml室温消化3 min, 用FBS终止消化,4℃离心,细胞团用DMEM/F12 生长液重悬, 以2×106个/ml的密度接种于25 cm2的培养瓶中,在CO2孵箱中培养24 h后首次换液,以后每2~3 d换液1次。第2代被培养的细胞汇合至90%时经倒置相差显微镜观察并用细胞角蛋白抗体及波形蛋白抗体行免疫组化染色进行鉴定, 明确其为RPMC,纯度>99%。第3代细胞用于实验[10]。
实验分组 第3代腹膜间皮细胞达90%融合时(细胞数约为5×106)进入实验,用1%胎牛血清培养基培养24h同步化后,随机分为下列各组:(1)正常对照组:只加DMEM/F12培养基;(2)LPS组: 100 μg/ml LPS作用48h;(3)硫酸锌(ZnSO4)作用组:30 μmol/L ZnSO4作用24h后加100 μmol/L LPS作用48h。LPS及ZnSO4的浓度选择均采用四哩盐比色(MTT)间接法观察TP在不同时间段和不同剂量下杀伤活性的变化筛选,具体参照文献[11]。
RPMCs增生率测定 RPMCs接种于96孔培养板,每孔0.1 ml培养基,24h后细胞贴壁,更换培养液,分别加入100 μg/ml LPS、 30 μmol/L ZnSO4、100 μg/ml LPS复合培养44h后。每孔加MTT 10 μl,4h 后, 吸净培养液,加入 DMSO 150 μl,振荡10 min,使结晶充分溶解,酶标仪测量490 nm波长的吸光度值。
免疫荧光 RPMCs转至24孔板,分组处理同前,每组设4复孔,多聚甲醛固定,0.3% Triton-X 破膜,BSA室温孵育30 min。一抗4℃孵育过夜,羊抗鼠Alexa Fluor 488标记荧光二抗室温下孵育120 min。荧光显微镜下观察E-cadherin、Collagen Ⅰ的表达。E-cadherin、Collagen Ⅰ蛋白表达的信号呈绿色荧光。
半定量RT-PCR检测 提取细胞总RNA,按照TRIzol Reagent说明书进行操作。然后按照反转录试剂盒(美国MBI)说明书进行反转录。采用引物为:α-SMA ( 5′-GCTCTGTAAGGCGGGCTTTG-3’,5′-AAGACGGAATAGCCACGCTCA-3′);E-cadherinsense(5′-CAGGATTACAAGTTCCCG-3,5’-G ̄A ̄C ̄T ̄G ̄T ̄C ̄C ̄G ̄C ̄T ̄G ̄C ̄C ̄T ̄T ̄C ̄A ̄C-3’);Collagen Ⅰ(5′-G ̄C ̄G ̄T ̄A ̄A ̄C ̄G ̄A ̄T ̄G ̄G ̄T ̄G ̄C ̄T ̄G ̄T ̄C ̄G ̄G-3′,5′-A ̄T ̄A ̄A ̄C ̄C ̄T ̄T ̄G ̄A ̄A ̄C ̄T ̄C ̄C ̄A ̄G ̄T ̄A ̄A-3′);PCR扩增后,PCR扩增产物用3%琼脂糖凝胶进行电泳分离观察,成像,Image-pro Plus 6.0软件包分析。
应用流式细胞术,采用活性氧(ROS)检测试剂盒检测各组别的ROS表达 细胞内的ROS水平采用DCFH-DA荧光探针进行检测。取对数生长期的细胞,接种于100 mm 培养皿中。在含20% FBS的DMEM/F12培养基中,培养48h,加入处理药物作用48h,CCCP做阳性对照。使用无血清的DMEM/F12培养基洗细胞1次,加入终浓度30 μmol/L的DCFH-DA 于37℃孵育1h,每5 min震荡细胞一次。用无血清的DMEM/F12培养基洗细胞3次,药物处理细胞,常规消化,DCFH-DA染色,流式细胞仪(FACSCalibur,Becton-Dickinson,USA)进行检测,CellQuestTM软件 (Becton-Dickinson)分析并计算ROS阳性率。
Western Blot法检测NF-κB、 I-κB、 p-NF-κB、 p-I-κB蛋白表达 冰上裂解细胞,4℃ 12 000 r/min离心5 min,留取上清用Bradford法测定蛋白浓度。总蛋白上样于12% SDS-PAGE胶电泳分离,电转移至PVDF膜上,以含5%脱脂奶粉的TBST封闭60 min后,分别加入兔抗大鼠NF-κB、 I-κB、,p-NF-κB、 p-I-κB抗体,小鼠抗大鼠β-actin抗体(1∶1 000,北京中杉金桥),4℃过夜,洗膜,分别加入辣根过氧化物酶标记的山羊抗兔IgG(1∶1 500 ,北京中杉金桥)、山羊抗小鼠IgG(1∶1 500,北京中杉金桥),室温孵育2h,洗膜,ECL发光法显影,扫描仪成像,自动成像系统分析。
统计学分析采用SPSS 18.0统计软件进行统计学处理,数据均以均数±标准差表示,各组间比较采用单因素方差分析,样本均数间的两两比较采用Tukey’s 检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
MTT测定RPMCs增生测定MTT实验吸光度值反映各组细胞数目。对照组MTT结果显示,随培养时间延长各组细胞吸光度明显增加。LPS明显抑制RPMCs的增生, 培养48h MTT吸光度值与对照组相比明显降低,而加入ZnSO4培养48h MTT吸光度值明显高于LPS组 (图1)。

图1 MTT法测定细胞增生率
细胞免疫荧光结果LPS培养48h后细胞形态开始发生变化,由典型的上皮逐渐变为梭形及不规则形,类似肌成纤维细胞,而ZnSO4作用组细胞表型改变明显减轻。同时LPS组RPMCs 的E-cadherin荧光表达强度明显减弱,而Collagen Ⅰ 荧光表达强度明显增强,与此相比,ZnSO4作用组E-cadherin荧光表达强度明显增强 、 Collagen Ⅰ荧光表达强度下降(图2)。
ZnSO4对LPS诱导的RPMCs的α-SMA、E-cadherin、Collagen Ⅰ基因表达的影响为了检测Zn对LPS诱导的RPMCs的EMT的影响,我们采用 RT-PCR 检测α-SMA、E-cadherin、Collagen Ⅰ基因表达,LPS可导致α-SMA 和Collagen Ⅰ的上调表达,补充锌可明显抑制LPS引起的α-SMA 和Collagen Ⅰ的表达。我们同时发现,LPS可下调E-cadherin的基因表达,补充锌可明显逆转LPS引起的E-cadherin基因的下调表达(图3)。以上结果证实补充锌可有效减轻RPMCs发生EMT。

图2 大鼠腹膜间皮细胞E-cadherin及Collagen Ⅰ染色结果(IF,×400)
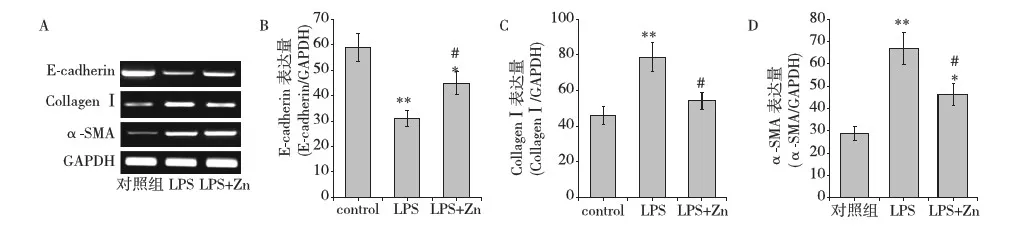
图3 ZnSO4对LPS诱导的RPMCs的α-SMA、E-cadherin、Collagen Ⅰ基因表达的影响
ZnSO4对LPS诱导的RPMCs的ROS产生的影响既往文献证实,氧化应激在PMC的EMT及腹膜纤维化进程中发挥重要的作用[12,13]。抑制氧化应激反应可有效地逆转或阻抑PMC的EMT进程,提示氧化应激反应在腹膜间皮细胞的EMT中起关键作用。因此,为了检测Zn对RPMCs的EMT影响及其机制,我们应用流式细胞术,采用ROS检测试剂盒检测各组别的ROS表达。结果发现,LPS组ROS产生明显增多,而补充锌可明显减少LPS引起的ROS产生(图4)。以上结果提示,Zn可能是通过抑制LPS诱导的氧化应激反应而发挥阻抑RPMCs的EMT的作用。
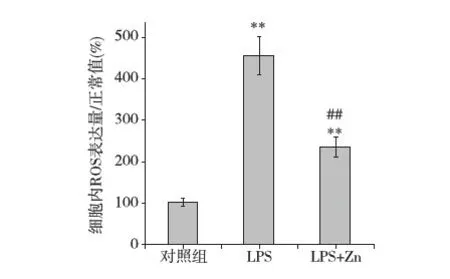
图4 ZnSO4对LPS诱导的RPMCs的ROS表达的影响
ZnSO4对LPS诱导的NF-κB信号通路的影响既往的文献证实NF-κB信号通路在多种细胞发生EMT过程中发挥重要的作用[14]。我们推测,Zn可能通过此通路对LPS诱导的RPMCs的 EMT进行调节。我们应用Western Blot检测各组别NF-κB通路关键蛋白NF-κB、I-κB的表达情况。结果显示,各组NF-κB、I-κB的总表达变化不明显, LPS组细胞的p-NF-κB、p-I-κB表达明显升高。而补充锌能够明显降低LPS引起的p-NF-κB、 p-I-κB的上调表达。这表明Zn可通过抑制NF-κB 信号通路的活化进而阻抑RPMCs的EMT(图5)。

图5 NF-κB,I-κB表达的Western Blot检测结果
讨 论
PD相关性腹膜炎是PD患者最常见的感染因素,是导致患者死亡率增高及患者退出PD的重要原因之一。PMC在维持腹膜对感染的宿主防御反应中起重要作用。然而,近来研究发现,长期以高糖为主的腹膜透析液(PDF),多种炎症因子的刺激可以导致PMC发生EMT[15]。PMC发生EMT是PD患者腹膜功能逐渐降低的关键因素之一。既往的研究证实,补充锌能够抑制或减轻一些动物模型的纤维化和临床上的慢性炎症疾病,而锌缺乏能够加重或导致纤维化[9]。文献证实,终末期肾病(ESRD)患者(包括血液透析和PD患者)均存在不同程度的锌缺乏[7,8]。因此,我们有理由推测Zn可能对腹膜的纤维化有一定的影响。本实验中,LPS可导致体外培养的RPMCs发生EMT,而补充锌可有效抑制EMT。另外,补充锌明显抑制LPS诱导的氧化应激反应和NF-κB信号通路的活化,其可能是Zn发挥抗EMT作用的重要机制之一。
EMT是发生腹膜纤维化早期病变的关键。以高糖为主的PDF、多种炎性细胞因子等可导致PMC向肌纤维母细胞转分化,并且EMT而来的肌纤维母细胞可能是参与腹膜纤维化的主要细胞。因此,临床上对EMT的防治可能会延缓腹膜纤维化的进程。E-cadherin是一种细胞间黏附分子,存在于正常上皮细胞的连接处,是细胞之间连接的关键物质。E-Cadherin表达下调,α-SMA表达上调以及细胞外基质和胶原蛋白的增多是EMT的重要特征。其中Collagen Ⅰ具有代表性,因此我们选用了Collagen Ⅰ作为EMT的观察指标之一,并检测其基因和蛋白水平的变化。本研究发现,LPS组RPMCs的标记蛋白E-cadherin mRNA表达显著下调,α-SMA、Collagen Ⅰ mRNA表达显著上调。免疫荧光结果也提示E-cadherin、Collagen Ⅰ蛋白表达与基因表达趋势一致。这些结果证实LPS能诱导RPMCs发生EMT。而添加ZnSO4后,α-SMA、Collagen Ⅰ的表达显著降低,E-cadherin的表达升高。而且细胞表型由间皮细胞向成纤维细胞表型改变也明显减轻,提示ZnSO4具有潜在抑制RPMCs 发生EMT的作用。
Himmelfarb等[16]和Karamouzis等[17]研究证实, 长时间进行透析的ESRD的患者随着透析时间的延长,氧化应激损伤的程度也随之增加。近年研究进一步表明,氧化应激在PMC的EMT及腹膜纤维化进程中发挥重要的作用[12,13]。以高糖为主导的PDF及炎症过程中产生的LPS、炎症因子等可导致氧化应激反应使PMC产生过多的ROS,可诱导PMC发生EMT[18]。肾小管上皮细胞、肝纤维化中星状细胞向肌纤维母细胞的EMT与氧化应激的关系也被证实,同时降低脂质过氧化水平,可抑制EMT[19]。Zn和氧化应激反应及纤维化的关系也被众多的研究证实。锌缺乏可以引起氧化应激进而损伤细胞器、破坏细胞膜或细胞功能、引起细胞凋亡、EMT及纤维化[20,21]。相反,补充锌能够通过减少ROS的产生下调氧化应激反应。 我们的实验结果提示LPS可导致细胞ROS表达量升高,而加入ZnSO4后能够减少ROS的表达量,提示锌阻止或减轻EMT可能是通过降低氧化应激反应。
NF-κB 信号转导通路是各种细胞发生EMT的基本和关键通路之一[13,14],NF-κB最常见的形式是由p50/p52亚单位与p65亚单位形成的二聚体,正常情况下存在于胞质,与抑制性因子I-κB结合成复合物。应激、病原体或促炎症因子等激活I-κB激酶(IKK)使I-κB磷酸化,进而通过泛素化途径降解I-κB,释放NF-κB入核,与相应的靶基因结合,启动促炎症因子、纤维化因子等相关基因的转录。我们前期的研究也表明,LPS可导致转化生长因子β1(TGF-β1) 和TNF-α在RPMCs的高表达, 促进RPMCs发生EMT(未发表资料)。 Zn能够抑制NF-κB的表达已经在多种细胞被证实,其主要是通过抑制I-κB的磷酸化进而抑制NF-κB的活化[22,23]。我们发现各组的总的NF-κB、I-κB的表达变化不明显, LPS组细胞的p-NF-κB、p-I-κB表达明显升高。而补充锌能够明显降低LPS引起的p-NF-κB、p-I-κB的上调表达。提示ZnSO4可以直接与NF-κB的亚基p65/p50结合,也可抑制I-κB的活化,形成转录抑制复合物,降低了NF-κB与DNA结合活性,抑制NF-κB的DNA合成,从而抑制其表达。
LPS 可诱导 RPMCs发生EMT,ZnSO4能在一定程度上抑制LPS诱导的RPMCs发生EMT,这一作用可能与其抑制氧化应激反应和NF-κB信号转导通路的活化有关。提示Zn在PD相关性炎性反应中对PMC具有一定的保护作用,为PD相关腹膜炎及腹膜纤维化的防治提供了新的实验材料。
2 Ha H,Yu MR,Lee HB.High glucose-induced PKC activation mediates TGF-beta 1 and fibronectin synthesis by peritoneal mesothelial cells.Kidney Int,2001,59(2):463-470.
3 Cendoroglo M,Sundaram S,Jaber BL,et al.Effect of glucose concentration,osmolality,and sterilization process of peritoneal dialysis fluids on cytokine production by peripheral blood mononuclear cells and polymorphonuclear cell functions in vitro.Am J Kidney Dis,1998,31(2):273-282.
4 Nagy JA.Peritoneal membrane morphology and function.Kidney Int Suppl,1996,56:S2-S11.
5 Vallee BL.The function of metallothionein.Neurochem Int,1995,27(1):23-33.
6 Vallee BL,Falchuk KH.The biochemical basis of zinc physiology.Physiol Rev,1993,73(1):79-118.
7 ese P,Gallieni M,Brancaccio D,et al.Trace elements in dialysis fluids and assessment of the exposure of patients on regular hemodialysis,hemofiltration and continuous ambulatory peritoneal dialysis.Nephron,1992,61(4):442-448.
8 Wang AY,Sea MM,Ip R,et al.Independent effects of residual renal function and dialysis adequacy on dietary micronutrient intakes in patients receiving continuous ambulatory peritoneal dialysis.Am J Clin Nutr,2002,76(3):569-576.
9 Takahashi M,Saito H,Higashimoto M,et al.Possible inhibitory effect of oral zinc supplementation on hepatic fibrosis through downregulation of TIMP-1: A pilot study.Hepatol Res,2007,37(6):405-409.
10 Hjelle JT,Golinska BT,Waters DC,et al.Isolation and propagation in vitro of peritoneal mesothelial cells.Perit Dial Int,1989,9(4):341-347.
11 Yang L,Wang J,Fan Y,et al.Effect of 1,25(OH)(2)D(3) on rat peritoneal mesothelial cells treated with high glucose plus lipopolysaccharide.Cell Immunol,2011,271(1):173-179.
12 Gotloib L,Wajsbrot V,Cuperman Y,et al.Acute oxidative stress induces peritoneal hyperpermeability,mesothelial loss,and fibrosis.J Lab Clin Med,2004,143(1):31-40.
13 Cannito S,Novo E,di Bonzo LV,et al.Epithelial-mesenchymal transition: from molecular mechanisms,redox regulation to implications in human health and disease.Antioxid Redox Signal,2010,12(12):1383-1430.
14 Huber MA,Kraut N,Beug H.Molecular requirements for epithelial-mesenchymal transition during tumor progression.Curr Opin Cell Biol,2005,17(5):548-558.
15 Margetts PJ,Bonniaud P,Liu L,et al.Transient overexpression of TGF-{beta}1 induces epithelial mesenchymal transition in the rodent peritoneum.J Am Soc Nephrol,2005,16(2):425-436.
16 Himmelfarb J.Oxidative stress in hemodialysis.Contrib Nephrol,2008,161:132-137.
17 Karamouzis I,Grekas D,Karamouzis M,et al.Enhanced oxidative stress with a gradient between plasma and muscle interstitial fluid in patients with end stage renal failure on hemodialysis.Hormones (Athens),2008,7(1):62-69.
18 Ksiazek K,Breborowicz A,Jörres A,et al.Oxidative stress contributes to accelerated development of the senescent phenotype in human peritoneal mesothelial cells exposed to high glucose.Free Radic Biol Med,2007,42(5):636-641.
19 Rhyu DY,Yang Y,Ha H,et al.Role of reactive oxygen species in TGF-beta1-induced mitogen-activated protein kinase activation and epithelial-mesenchymal transition in renal tubular epithelial cells.J Am Soc Nephrol,2005,16(3):667-675.
20 Oteiza PI,Olin KL,Fraga CG,et al.Zinc deficiency causes oxidative damage to proteins,lipids and DNA in rat testes.J Nutr,1995,125(4):823-829.
21 Ho E,Ames BN.Low intracellular zinc induces oxidative DNA damage,disrupts p53,NFkappa B,and AP1 DNA binding,and affects DNA repair in a rat glioma cell line.Proc Natl Acad Sci U S A,2002,99(26):16770-16775.
22 Auwardt RB,Mudge SJ,Chen CG,et al.Regulation of nuclear factor kappaB by corticosteroids in rat mesangial cells.J Am Soc Nephrol,1998,9(9):1620-1628.
23 Uzzo RG,Leavis P,Hatch W,et al.Zinc inhibits nuclear factor-kappa B activation and sensitizes prostate cancer cells to cytotoxic agents.Clin Cancer Res,2002,8(11):3579-3583.